Билет 15
Прямое окислительное дезаминирование. Роль глутаматдегидрогеназы.

Ок/дезаминирование- преобладающий тип реакции отщипления амино группы от ак с освобождением NH3(искл гистидин.внутримол). Пр-сс протекает в 2 стадии:1-ферм-ая с обр иминокислоты.2-с уч-ем воды и обр-ем NH3 и а-кетокисл). ОксидазаL(ФМНилиФАД) оптимум pH10.Поэтому почти не активна в организме. ОксидазаD(ФАД) преобладающая. Восстан-ые флавиннуклеотиды оксидаз окисляются О,обр-ся H2O2,кот-ая под каталозой расщ-ся на воду и кислород.
Глутаматдегидрогеназа-фермент,кат-ий ок/дез L-глутаминовой к.Анаэробный фермент (НАД,НАДФ).Реакция включает анаэр фазу дегидрирования глутаминовой к.с обр-ем иминоглутаровой к и спонтанный гидролиз на NH3 и а-кетокислоту.Восстановленный НАДН далее окисляется при участии флавиновых ферментов и цитохромной системы с обр-ем воды.
Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединици,активный в мультимерной форме. При диссоциации этой молекулы на субъединицы фермент приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природе
2)Реакции образования серотонина. Роль. По химическому строению серотонин относится к биогенным аминам, классу триптаминов.
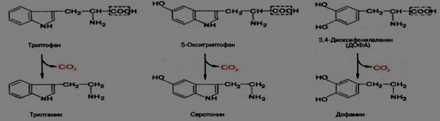
Серотонин-биогенный амин(класс триптаминов) обр-ся в результате декарбоксилирования 5-окситриптофана ферментом декарбоксилазой. Серотонин-сосудосужевающее действие,регулирует АД,t,дыхание,почечную фильтрацию,явл-ся медиатором нервных пр-ов в цнс.Причастен к аллергии, токсикозу,геморрагический деатез,карциноидный синдром.
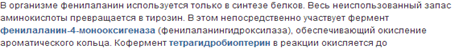
Полное окисление фенилаланина.
Фенилаланин –незаменимая аминокислота.В то же время тирозин заменим при достаточном поступлении фенилаланина в организм.Основной путь превращения фенилаланина-окисление его в тирозин.Реакция катализируетс ферментом фенилаланин-4-монооксигеназой(коф-тетрагидробиоптерин)Блокирование этой реакции ведет к развитию наследственного заюолевания фенилкетонурии.

Билет 14
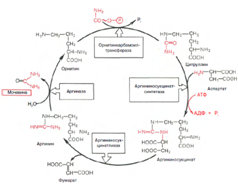
Орнитиновый цикл
Основным механизмом обезвреживания аммиака в организме является
биосинтез мочевины. На первом этапе синтезируется макроэрги-
ческое соединение карбамоилфосфат – метаболически активная форма
аммиака
 .
.
На втором этапе цикла мочевинообразования происходит конденсация
карбамоилфосфата и орнитина с образованием цитруллина; реакцию ка-
тализирует орнитин-карбамоилтрансфераза.На следующей стадии цитруллин превращается в аргинин в результате
двух последовательно протекающих реакций. Первая из них, энергозави-
симая,– это конденсация цитруллина и аспарагиновой кислоты с обра-
зованием аргининосукцината (эту реакцию катализирует аргининосукцинат-
синтетаза). Аргининосукцинат распадается в следующей реакции на ар-
гинин и фумарат при участии другого фермента – аргининосукцинатлиазы.
На последнем этапе аргинин расщепляется на мочевину и орнитин под
действием аргиназы.
Суммарная реакция синтеза мочевины без учета всех промежуточных
продуктов может быть представлена в следующем виде:
СO2 + NH3 + ЗАТФ + 2Н2O + Аспартат –> Мочевина + 2АДФ + АМФ +
+ Фумарат + 2Рi + РРi.
Билет 13
Образование гистамина.Роль.
Гистамин-сосудорасширяющее действие, увеличивает приток лейкоцитов к воспалению,секреция Hcl,отношение к аллергиям.
3)Синтез меланинов.
Фе нилаланин и тирозин –предшественники меланинов.Этот процесс обеспечивает пигментацию кожи,глаз,волос.Катализирует фермент тирозиназа.
Синтез меланинов - сложный, многоступенчатый, разветвлённый процесс.

Билет 12
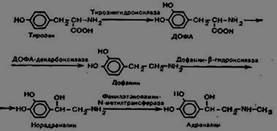
Образование Дофамина.Роль
Дофамин-предшественник катехоламинов.Обр-ся из 3.4-диоксифенилаланин,который в свою очередь обр-ся из тирозина при тиррозин3-монооксигеназа(тетрагидробиоптерин)Она катализирует реакцию опр-ую скорость синтеза катехоламинов,регулирующих ссс.снижает АД
3)Цистеин,его участие в образовании биологически важных метаболитов.Полное окисление цистеина.Судьба H 2 S
1)синтез белков2)образование дисульфидной связи в третичной структуре белка3)тиогруппа часто входит в активный центр ферментов4)идет на синтез таурина,глутатиона.
Билет 11.
Образование ГАМК
Продукт а-декарбоксилирования глутаминовой кислоты –гамма-аминомасляная(ГАМК).Эту реакцию катализирует высокоспецифичный фермент-глутаматдекарбоксилаза.(Его кофактором является пиридоксальфосфат).

ГАМК обладает тормозящим действием на работу ЦНС.ГАМК используют в клинике при заболеваниях ЦНС,связанных с резким возбуждением коры больших полушарий(Н-р:при эпилептических припадках вводят глутаминовую кислоту,и сокращение припадков обусловлено действием ГАМК.
Билет 10
ОБРАЗОВАНИЕ КРЕАТИНИНА
Конечн ый продукт креатина-креатинин.-этот продукт спонтанной циклизации,ктр образуется при дегидратации креатина.

 NH2-C(=NH)-N(-CH3)-CH2-COOH - С(=NH)-N(CH3)-CH2-CO-NH
NH2-C(=NH)-N(-CH3)-CH2-COOH - С(=NH)-N(CH3)-CH2-CO-NH
 КРЕАТИН – ВОДА КРЕАТИНИН
КРЕАТИН – ВОДА КРЕАТИНИН
Креатинин выводится с мочой,это постоянная величина,зависящая от мышечной массы.Он не реабсорбируется в почечных канальцах.Креатинин выводится при астении,мышечной дистрофии.
3) Синтез адреналина и норадриналина. Биологическая роль.
Образуются из дофамина за счет декарбоксилирования.Дофа обр-ся из тирозина при гидроксилазе. Тирозин3 -монооксигеназа находится внадпочечниках, мозге ПНС.Простетической группой явл-тетрадигидробиоптерин. Она катализирует реакцию опр-ую скорость синтеза катехоламинов,регулирующих ссс.снижает АД
БИЛЕТ 9
Билет 8
Билет 7
БИЛЕТ 6
1)непрямое окислительное дезаминирование аминокислот.Роль глутаматдегидрогеназы. Непрямой путь дезаминирование аминокислот через реакции трансаминирования называется трансдезаминированием.Оно протекает в две стадии:1)аминокислоты реагируют с альфа-кетоглутаровой кислотой в реакции трансаминирования с образованием глутаминовой кислоты и соответсвующей кетокислоты.
 СH3-C(NH2)-COOH +COOH-(CH2)2-C =O -COOH CH3- C=O =COOH + COOH-CH2-CH2-C(NH2)-COOH
СH3-C(NH2)-COOH +COOH-(CH2)2-C =O -COOH CH3- C=O =COOH + COOH-CH2-CH2-C(NH2)-COOH
Аланил альфа-кетоглутарат пируват глутамат
Реакция трансаминирования обратима, она катализируется ферментами – аминотрансферазами. Аминотрансферазы содержат в качестве кофермента производные пиридоксина (витамин В6) – пиридоксаль-фосфат и пиридоксамин-фосфат.
2)глутаминовая кислота подвергается окислительному дезаминированию под действием фермента глутаматдегидрогеназы(ее кофермент НАД+ или НАДФ+)

 COOH-CH2-CH2-C(NH2)-COOH 1 стад COOH-CH2-CH2-C=(NH)-COOH 2 стад (+вода) COOH-глутамат
COOH-CH2-CH2-C(NH2)-COOH 1 стад COOH-CH2-CH2-C=(NH)-COOH 2 стад (+вода) COOH-глутамат
CH2-CH2-C = О -СOOH +NH3
2)образование гистамина.Роль.
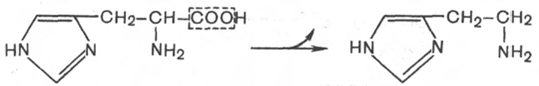
Гистидин=гистамин
Обладает сосудорасширяющим свойсвом,много гистамина образуется в области воспаления,беспечивает приток лейкоцитов-обеспечение защиты организма,секреция соляной кислоты, имеет прямое отношение к явлениям сенсибилизации и десенсибилизации
3)Цистеин,его участие в образовании биологически важных метаболитов.Полное окисление цистеина.Судьба H 2 S
Билет 5
Образование креатинина
Конечн ый продукт креатина-креатинин.-этот продукт спонтанной циклизации,ктр образуется при дегидратации креатина.

 NH2-C(=NH)-N(-CH3)-CH2-COOH - С(=NH)-N(CH3)-CH2-CO-NH
NH2-C(=NH)-N(-CH3)-CH2-COOH - С(=NH)-N(CH3)-CH2-CO-NH
 КРЕАТИН – ВОДА КРЕАТИНИН
КРЕАТИН – ВОДА КРЕАТИНИН
Креатинин выводится с мочой,это постоянная величина,зависящая от мышечной массы.Он не реабсорбируется в почечных канальцах.Креатинин выводится при астении,мышечной дистрофии.
Образование таурина.Биологическая роль.
В животных тканях с высокой скоростью декарбоксилируются также два производных цистеина – цистеиновая и цистеинсульфиновая кислоты. В процессе этих специфических ферментативных реакций образуется таурин, который используется в организме для синтеза парных желчных кислотТаурин принимает участие в обмене липидов, улучшает энергетические и обменные процессы, входит в состав жёлчных кислот В цнс выполняет функцию тормозящего нейромедиатора, обладает противосудорожной активностью. Способствует нормализации обменных процессов в тканях глаза при заболеваниях дистрофического характера.при сердечно-сосудистой недостаточност
Билет 4
Билет 3.
1)Реакция образования креатинфосфата.Органная локализация креатинфосфокиназы.Роль креатинфосфата в организме.
Креатин подвергается фосфорилированию в мышцах в состоянии покоя при избытке АТФ.
 NH2-C(=NH)-N(-CH3)-CH2-COOH NH—(PO3H2)-C(=NH)-N(-CH3)-CH2-COOH
NH2-C(=NH)-N(-CH3)-CH2-COOH NH—(PO3H2)-C(=NH)-N(-CH3)-CH2-COOH
 КРЕАТИН КРЕАТИНФОСФАТ(АТФ превращается в АДФ)
КРЕАТИН КРЕАТИНФОСФАТ(АТФ превращается в АДФ)
Благодаря креатинфосфату концентрация АТР в мышечных клетках поддерживается на постоянном и притом довольно высоком уровне(участвует в энергетич обмене).
Содержится в цитоплазме и митохндриях миокарда,скелетной мускулатуре и тканях мозга.
Билет.
Образование глутамина.Значение процесса в обезвреживании аммиака.
В результате реакций дезаминирования и окисления биогенных аминов освобождается большое кол-во аммиака-высокотоксичное соединение.И он должнен подвергаться связыванию в тканях с образованием нетоксичных соединений,ктр выделяются с мочой.В мозге,сетчатке,почках,печени и мышцах-синтез глутамина.Он транпортирует аммиак в нетоксичной форме.Реакция катализируется глутаминсинтетаой(класс лигаз).

Билет.
Образование креатина.
В синтезе креатина принимают участие три аминокислоты:аргинин,глицин и метионин.
1)протекает в печени и поджелудочной
2)в почках и поджелудочной


Образование ГАМК.Биологическая роль.
Продукт а-декарбоксилирования глутаминовой кислоты –гамма-аминомасляная(ГАМК).Эту реакцию катализирует высокоспецифичный фермент-глутаматдекарбоксилаза.(Его кофактором является пиридоксальфосфат).

ГАМК обладает тормозящим действием на работу ЦНС.ГАМК используют в клинике при заболеваниях ЦНС,связанных с резким возбуждением коры больших полушарий(Н-р:при эпилептических припадках вводят глутаминовую кислоту,и сокращение припадков обусловлено действием ГАМК.
Билет 15
Прямое окислительное дезаминирование. Роль глутаматдегидрогеназы.

Ок/дезаминирование- преобладающий тип реакции отщипления амино группы от ак с освобождением NH3(искл гистидин.внутримол). Пр-сс протекает в 2 стадии:1-ферм-ая с обр иминокислоты.2-с уч-ем воды и обр-ем NH3 и а-кетокисл). ОксидазаL(ФМНилиФАД) оптимум pH10.Поэтому почти не активна в организме. ОксидазаD(ФАД) преобладающая. Восстан-ые флавиннуклеотиды оксидаз окисляются О,обр-ся H2O2,кот-ая под каталозой расщ-ся на воду и кислород.
Глутаматдегидрогеназа-фермент,кат-ий ок/дез L-глутаминовой к.Анаэробный фермент (НАД,НАДФ).Реакция включает анаэр фазу дегидрирования глутаминовой к.с обр-ем иминоглутаровой к и спонтанный гидролиз на NH3 и а-кетокислоту.Восстановленный НАДН далее окисляется при участии флавиновых ферментов и цитохромной системы с обр-ем воды.
Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединици,активный в мультимерной форме. При диссоциации этой молекулы на субъединицы фермент приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природе
2)Реакции образования серотонина. Роль. По химическому строению серотонин относится к биогенным аминам, классу триптаминов.

Серотонин-биогенный амин(класс триптаминов) обр-ся в результате декарбоксилирования 5-окситриптофана ферментом декарбоксилазой. Серотонин-сосудосужевающее действие,регулирует АД,t,дыхание,почечную фильтрацию,явл-ся медиатором нервных пр-ов в цнс.Причастен к аллергии, токсикозу,геморрагический деатез,карциноидный синдром.







 .
.




 NH2-C(=NH)-N(-CH3)-CH2-COOH - С(=NH)-N(CH3)-CH2-CO-NH
NH2-C(=NH)-N(-CH3)-CH2-COOH - С(=NH)-N(CH3)-CH2-CO-NH КРЕАТИН – ВОДА КРЕАТИНИН
КРЕАТИН – ВОДА КРЕАТИНИН
 СH3-C(NH2)-COOH +COOH-(CH2)2-C =O -COOH CH3- C=O =COOH + COOH-CH2-CH2-C(NH2)-COOH
СH3-C(NH2)-COOH +COOH-(CH2)2-C =O -COOH CH3- C=O =COOH + COOH-CH2-CH2-C(NH2)-COOH
 COOH-CH2-CH2-C(NH2)-COOH 1 стад COOH-CH2-CH2-C=(NH)-COOH 2 стад (+вода) COOH-глутамат
COOH-CH2-CH2-C(NH2)-COOH 1 стад COOH-CH2-CH2-C=(NH)-COOH 2 стад (+вода) COOH-глутамат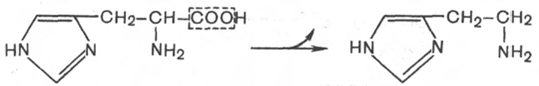

 NH2-C(=NH)-N(-CH3)-CH2-COOH NH—(PO3H2)-C(=NH)-N(-CH3)-CH2-COOH
NH2-C(=NH)-N(-CH3)-CH2-COOH NH—(PO3H2)-C(=NH)-N(-CH3)-CH2-COOH КРЕАТИН КРЕАТИНФОСФАТ(АТФ превращается в АДФ)
КРЕАТИН КРЕАТИНФОСФАТ(АТФ превращается в АДФ)






