

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
История учения о ферментах. Сходство и отличие ферментов и неорганических катализат-в. Классификация и номенклатура ферментов. Классы, подклассы, подподклассы. Примеры.
Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся. Ферменты катализируют химические реакции, происходящие в организме.
Учение о ферментах выделено в самостоятельную науку – энзимологию. Термин «энзим» (от греч. en zyme – в дрожжах), так же, как и «фермент» (от лат. fermentatio – брожение), означает процесс, связанный с выделением газов, брожением.
1783 г – Спалланцани доказал, что переваривание пищи – химический процесс, а не механический. Этими работами положил начало развитию энзимологии (конец 18 века)
I научное представление о ферментах - 1814 г., К.С. Кирхгоф нашел и объяснил действие амилазы.
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс кат-ся некой жизненной силой, находящейся в дрожжевых кл-х (феномен брожения).
В 1897 году Э. Бюхнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки (выделил дрожжевой фермент зимазу).
Сходства ферментов и катализаторов:
1. Катализируют энергетически возможные реакции.
2. Энергия химической системы остается постоянной.
3. В ходе катализа направление реакции не изменяется.
4. Не расходуются в процессе реакции.
Отличия ферментов от катализаторов:
1. Скорость ферментативной реакции выше.
|
|
2. Обладают высокой специфичностью.
3. Реакции проходят в физиологических условиях: 37 оС, р, рН.
Классификация и номенклатура ферментов.
Классификация ферментов осуществляется по типу катализируемой реакции и ее механизму, выделяют 7 классов: (2018 г.):
I. ОКСИДОРЕДУКТАЗЫ - ферменты, катализирующие окислительно-восстановительные реакции. Класс насчитывает 22 подкласса. Примером подклассов могут служить ферменты, действующие на СН-ОН-группу, на СН-СН-группу, на СН-NН2-группу и на гемсодержащие доноры. На подподклассы деление производится в зависимости от акцептора – НАД+ или НАДФ+, дисульфиды, кислород.
*дегидрогеназы, редуктазы, оксидазы, пероксидазы, монооксигеназы, диоксигеназы.
II. ТРАНСФЕРАЗЫ - катализируют реакции переноса химических групп с молекулы одного вещества на молекулу другого вещества. В подклассы выделяются в зависимости от состава переносимой группы (одноуглеродные фрагменты, альдегидные и кетогруппы, фосфорсодержащие, азотсодержащие группы). На подподклассы деление производится в зависимости от вида переносимой группы – метил, карбоксиметил или формил, аминогруппы.
*С1-трансферазы, амино-трансферазы, гликозил-трансферазы, фосфо-трансферазы.
III. ГИДРОЛАЗЫ - катализируют реакции разрушения химических связей с участием воды. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи. Гидролазы представлены ферментами ЖКТ (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры.
*эстеразы, пептидазы, гликозидазы, амидазы
IV. ЛИАЗЫ - катализируют реакции разрушения химических связей без участия воды. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт. Примером подклассов являются ферменты, например, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи. Среди подподклассов выделяют карбоксилиазы, гидролиазы
*С-С-лиазы, С-О-лиазы, C - N лиазы
|
|
V. ИЗОМЕРАЗЫ - катализируют реакции изомерных превращений. Подклассы выделяют в зависимости от типа реакции. Например, выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) и эпимеразы (превращения D,L-изомеров, -D-глюкозу), другие b-D-глюкозу в a имеющих более одного центра асимметрии, например, подклассы – цис-транс-изомеразы, внутримолекулярные трансферазы (мутазы), внутримолекулярные оксидоредуктазы. Среди подподклассов выделяют действующие на аминокислоты и их производные, на углеводы и их производные, перемещающие С=С-связи
*цис-транс-изомеразы, внутримолекулярные трансферазы, эпимеразы
VI. ЛИГАЗЫ (СИНТЕТАЗЫ) - катализируют реакции синтеза. Примером подклассов служат группы ферментов по виду образуемой связи: углерод-кислород, углерод-сера, углерод-азот, углерод-углерод. Среди подподклассов выделяют ферменты, синтезирующие соединения типа кислота-тиол, амиды.
* образование С-С, С-О, C - S, C - N связей
VII. ТРАНСЛОКАЗЫ – переносят ионы через мембраны.
Номенклатура
1) Существует тривиальная номенклатура – названия сложившееся исторически. Например, пепсин, трипсин. Для некоторых ферментов к названию субстрата добавляется окончание "-аза" – уреаза, амилаза, липаза.
2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактат-де-гирогеназа.
3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.
4) По классификации ферментов каждый фермент имеет свой шифр, который записывается 4 цифрами, например фермент
Алкогольдегидрогеназа: 1.1.1.1.
Лактатдегидрогеназа 1.1.1.27
Обозначения цифр:
· 1-класс
· 2-подкласс
· 3-подподкласс
· 4- порядковый номер
Например, шифр уреазы выражается цифрами 3.5.1.5. Это означает, что уреаза относится к 3-му классу (первая цифра) ферментов, все представители которого катализируют реакции гидролиза. Вторая цифра (5) говорит о том, что уреаза принадлежит к 5-му подклассу этого класса, куда зачислены все ферменты, ускоряющие гидролиз С - N-связей, не являющихся пептидными. Третья цифра шифра (1) указывает на принадлежность уреазы к подподклассу 5-го подкласса, члены которого ускоряют гидролиз линейных амидов, а последняя цифра (5) - порядковый номер уреазы в этом подподклассе.
|
|
15. Современные представления о химической природе и строении ферментов. Активный (каталитический) и аллостерический центры. Ферменты-протеины и ферменты-протеиды. Химическая природа и структура коферментов: НАД, НАДФ, ФАД, ФМН, КоАSH, ГДФ, пиридоксальфосфат, ТГФК.
По хим. пр ферменты – это белки, они имеют несколько уровней структурной организации. Очень большое количество ферментов не имеют 4-ую структуру, т.е. являются олигомерами.
Свойства ферментов:
-амфотерность (могут существовать в растворе в виде анионов, катионов и амфионов);
-электрофоретическая подвижность благодаря наличию в них положительных и отрицательных зарядов,
-в изоэлектрической точке не обнаруживают подвижности в эл. поле.
-неспособны к диализу через полупроницаемые мембраны.
-легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств.
Строение ферментов
Существуют два типа ферментов.
1) Ферменты — простые белки, состоят только из аминокислот (пепсин, трипсин, РНКаза и др.). (Ферменты-протеины)
2) Ферменты — сложные белки. (Ферменты-протеиды) Имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор.
Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат),различные пероксидазы (содержат гем), лактатдегидрогеназа (содержит Zn2+), амилаза (содержит Ca2+).
Кофакторы являются:
а) орг. вещ-ми — производными витаминов (т.е. коферментами) и др. соединениями (гем, глутатион);
б) ионами металлов Mg, Cu, Mo, Zn, Fe.
Активный центр ферментов
Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа.. Расположен в узком гидрофобном углублении (щели) поверхности молекулы фермента. Установлено, что у сложных ферментов в состав активного центра входят также простетические группы.
|
|
В активном центре условно различают:
1- каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом.
2- связывающий центр, или контактную («якорную») площадку, которая отвечает за связывание и ориентацию субстрата в активном центре, обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом.
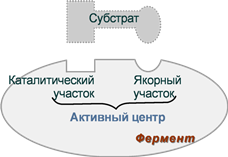
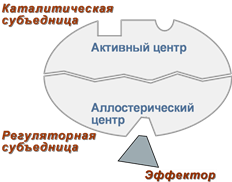
Схема строения фермента Схема строения аллостерического фермента
Аллостерический центр
(allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы, называемой активатором или ингибитором вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Химическая природа и структура коферментов: НАД, НАДФ, ФАД, ФМН, КоАSH, ГДФ, пиридоксальфосфат, ТГФК.
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
- ковалентными связями;
- ионными связями;
- гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы – производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
- тиаминмонофосфат (ТМФ);
-тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
- тиаминтрифосфат (ТТФ).


ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
- флавинмононуклеотид (ФМН);
- флавин аденин динуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
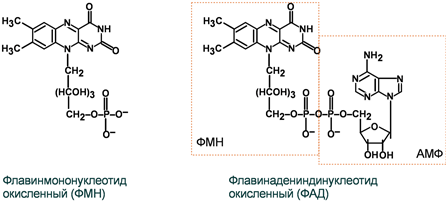
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую.
|
|
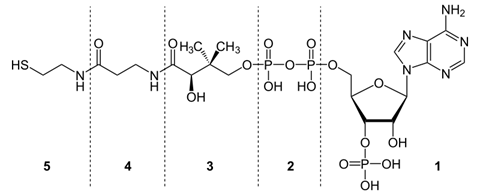
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА.
Кофермент А (коэнзим А, КоА, СоА, HSKoA) - кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты.
Молекула КоА состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты (3), которая в свою очередь связанна пептидной связью с аминокислотой в-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой пептидной связью с остатком в-меркаптоэтаноламина (5).
4 группа: никотинамидные, производные витамина РР - никотинамида:
Представители:
- никотин-амид-аденин-динуклеотид (НАД);
- никотин-амид-аденин-динуклеотид-фосфат (НАДФ).
НАД, NAD -- кофермент, входит в состав ферментов группы дегидрогеназ, катализирующих ОВР; выполняет функцию переносчика электронов и водорода, которые принимает от окисляемых веществ. Восстановленная форма (NADH) способна переносить их на другие вещества.
Это динуклеотид, молекула которого построена из амида никотиновой кислоты и аденина, соединённых между собой цепочкой, состоящей из двух остатков D-рибозы и двух остатков фосфорной кислоты; применяется в клинической биохимии при определении активности ферментов крови.
НАДФ, NADP - кофермент некоторых дегидрогеназ - ферментов, катализирующих ОВР в живых клетках. NADP принимает на себя водород и электроны окисляемого соединения и передаёт их на другие вещества. В хлоропластах растительных клеток NADP восстанавливается при световых реакциях фотосинтеза и затем обеспечивает водородом синтез углеводов при темновых реакциях.
NADP, -- кофермент, отличающийся от NAD содержанием ещё одного остатка фосфорной кислоты, присоединённого к гидроксилу одного из остатков D-рибозы, обнаружен во всех типах клеток.
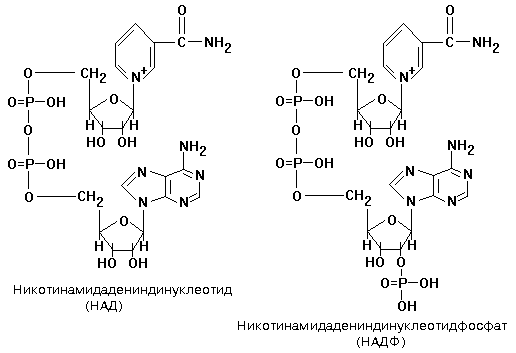
5 группа: пиридоксиновые, производные витамина В6.
| Пиридоксальфосфат (PLP) — наиболее важный кофермент в метаболизме а\к. Ф* принимает участие и в других реакциях аминокислот, таких, как декарбоксилирование и дегидратирование. | 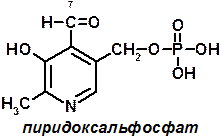
|
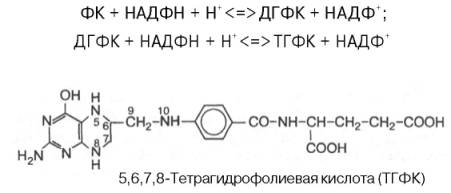
6 группа: фоливые коферменты
Коферментные функции фолиевой кислоты связаны не со свободной формой витамина, а с восстановленным его птеридиновым производным. Восстановление сводится к разрыву двух двойных связей и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8 с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает в 2 стадии в животных тканях при участии специфических ферментов, содержащих восстановленный НАДФ. Сначала при действии фолат-редуктазы образуется дигидрофолиевая кислота (ДГФК), которая при участии второго фермента – дигидрофолат-редуктазы – восстанавливается в ТГФК:
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена.
УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
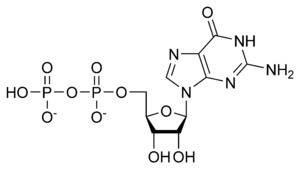
Гуанозин-дифосфат (ГДФ, GDP,) — нуклеотид, эфир пирофосфорной кислоты с гуаниловым нуклеозидом. ГДФ состоит из пирофосфата, сахара пентозы рибозы и азотистого основания гуанина.
ГДФ:
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в ОВР, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ - амилазы, Mg2+ - АТФ-азы (например, миозиновой АТФ-азы).
16. Ферменты. Изменения энергетической диаграммы реакции при участии ферментов. Понятие о механизме действия холинэстеразы. Специфичность ферментов. Виды специфичности. Теории специфичности.
Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся. Ферменты катализируют химические реакции, происходящие в организме.
Изменение энергетической диаграммы при участии фермента:
Для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции.
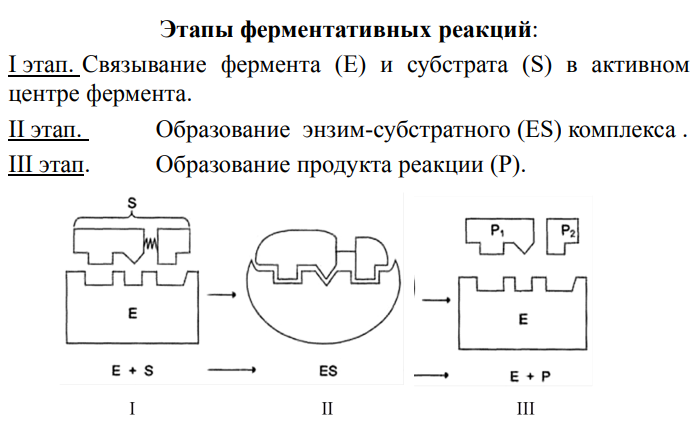
Согласно общепринятым представлениям о механизме ферментативного катализа, субстрат S и фермент E находятся в равновесии с очень быстро образующимся фермент-субстратным комплексом FE, который сравнительно медленно распадается на продукт реакции P с выделением свободного фермента; т.о., стадия распада фермент-субстратного комплекса на продукты реакции является скоростьопределяющей (лимитирующей).
Исследование зависимости скорости ферментативной реакции от концентрации субстрата при неизменной концентрации фермента показали, что с увеличением концентрации субстрата скорость реакции сначала увеличивается, а затем перестает изменяться.
Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.
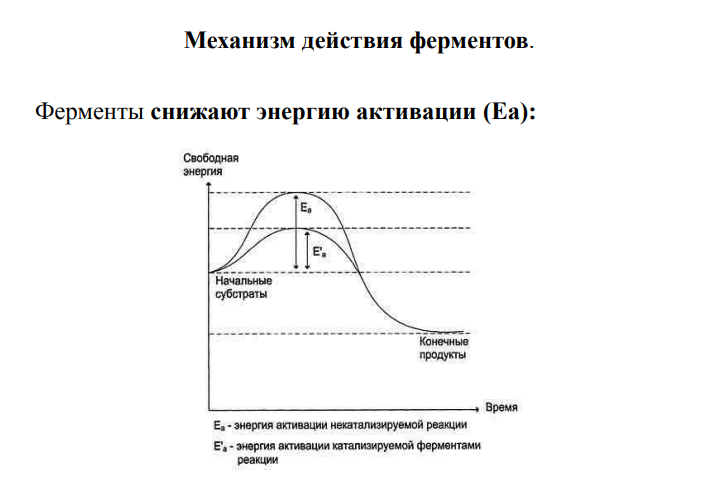
Механизм действия ферментов
В основе действия ферментов лежит их способность ускорять реакции за счет уменьшения энергии активации субстрата. Ферменты деформируют электронные оболочки субстратов, облегчая таким образом взаимодействие между ними. Энергия, необходимая для того, чтобы привести молекулы в активное состояние, называется энергией активации. Роль обычного катализатора (и еще в большей мере биологического) состоит в том, что он снижает энергию активации субстрата.
-На первой стадии фермент-го катализа происходит мгновенное образование фермент-субстратного комплекса, где фермент и субстрат могут быть связаны ионной, ковалентной или иной связью.
-На второй стадии субстрат под воздействием связанного с ним фермента видоизменяется и становится более доступным для соответствующей химической реакции. Эта стадия определяет скорость всего процесса.
-На третьей стадии происходит хим. реакция, в рез-те к-й обр-ся комплекс продукта реакции с ферментом.
-Заключительным процессом является высвобождение продукта реакции из комплекса.
Пример на ацетилхолинэстеразе:
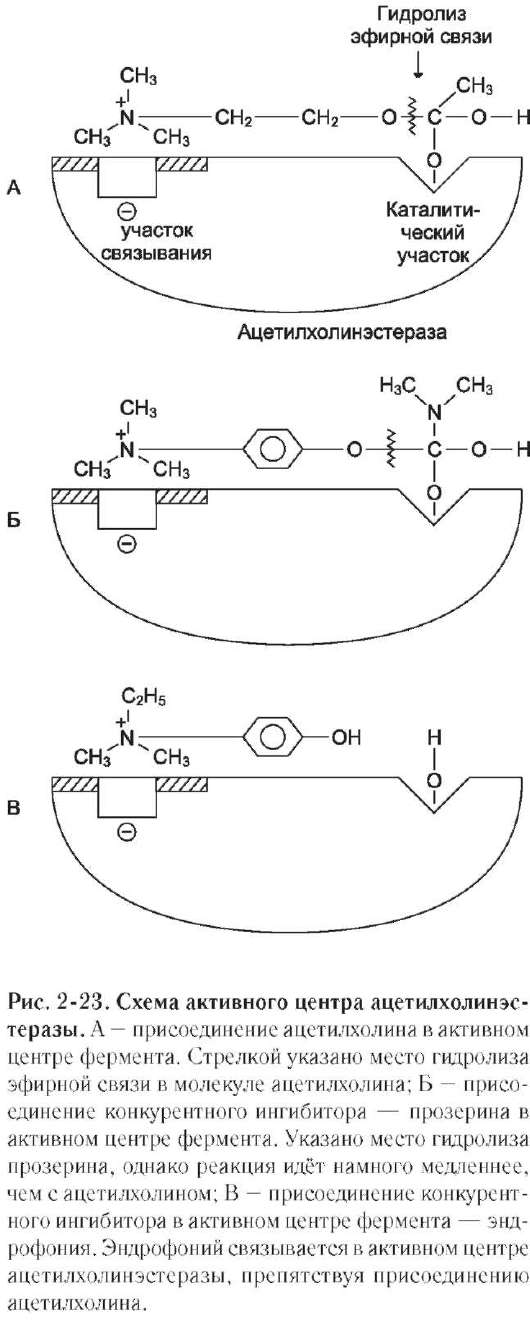
| Активный центр фермента состоит из двух функционально важных и пространственно разделенных участков:
-связывающего, куда входит карбоксильная группа -COO-, электростатически взаимодействующая с заряж-м азотом N+ субстрата;
-каталитического, ответственного за эстеразную активность фермента, в состав которого входят остатки Ser, His,Tir.

|
В процессе реакции атом водорода гидроксильной группы Tir активного центра связывается с атомом кислорода ацетилхолина (будущая спиртовая группа продукта реакции – холина). В результате увеличивается положительный заряд на углеродном атоме ацетильной группы субстрата, который атакуется отрицательно заряженным атомом кислорода серина. Отрицательный заряд на атоме кислорода серина возникает в результате образования водородной связи между атомом Н серина и атомом N гистидина. Связь между С (ацетила) и О (холина) разрывается с образованием в качестве промежуточного соединения ацетилсерина. Отщепляющийся от серина протон связывается кислородным атомом тирозина, и первоначальное состояние тирозина восстанавливается. Гидролиз ацетилсерина начинается с диссоциации молекулы воды за счет взаимодействия протона с атомом N гистидина. Освободившийся гидроксил атакует сложноэфирную связь ацетилсерина. Результатом гидролиза является освобождение уксусной кислоты. Ион водорода (Н+), временно связанный с гистидином, освобождается и связывается с кислородом серина. Образовавшиеся холин и уксусная кислота освобождаются из активного центра за счет диффузии.
Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента.
1. Стереоспецифичность – катализ только одного из стереоизомеров, например:
· специфичность к L- или D-аминокислотам – например, почти все ферменты человека взаимодействуют с L-аминокислотами,
· специфичность к цис- и транс-изомерам. Например, аспартаза реагирует только с транс-изомером – фумаровой кислотой, но не с малеатом (цис-изомер).
2. Абсолютная специфичность – фермент производит катализ только одного вещества. Например, уреаза расщепляет только мочевину, глюкокиназафосфорилирует только D-глюкозу.
3. Групповая специфичность – катализ субстратов с общими структурными особенностями, т.е. при наличии определенной связи или химической группы, например:
· наличие пептидной связи: • бактериальный фермент субтилизин специфичен к пептидной связи независимо от строения образующих ее аминокислот, • пепсин катализирует разрыв пептидной связи, образованной аминогруппами ароматических аминокислот, • тромбин в своих субстратах расщепляет пептидную связь только между аргинином и глицином, · наличиеα1,4-гликозидных связей в крахмале и гликогене - их гидролизует α-амилаза слюнной и поджелудочной желез, · наличие ОН-группы: алкогольдегидрогеназа окисляет до альдегидов одноатомные спирты (этанол, метанол, пропанол).
4. Относительная групповая специфичность – превращение субстратов с нек-ми общ-и признаками. Нап-р, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000.
Теории специфичности:
1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.

2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.

Кинетика ферментативных реакций. Константа Михаэлиса. Скорость ферментативных реакций. Уравнение Михаэлиса-Ментена. Зависимость скорости ферментативных реакций от концентрации субстрата и фермента, от температуры и рН.
Кинетика ферментативных реакций. Фермент взаимодействует со своим субстратом и образуется энзим-субстратов комплекс(ES),который часто распадается или диссоциируется (вновь образуется субстрат и фермент),но также преобразуется с образованием продукта.

Константа Михаэлиса - характеризует сродство фермента к субстрату.
! Чем ниже ее значение, тем сильнее сродство, быстрее образуется ES-комплекс и быстрее идёт реакция в целом. 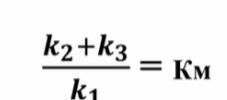
| Уравнение и график Михаэлиса-Ментена- главное уравнение ферментативной реакции, описывающее зависимость ее скорости от концентрации субстрата. По мере увеличения концентрации субстрата, скорость возрастает. Уравнение Михаэлиса-Ментен показывает взаимосвязь максимально возможной скорости, реальной скорости реакции, константы Михаэлиса и концентрации субстрата | 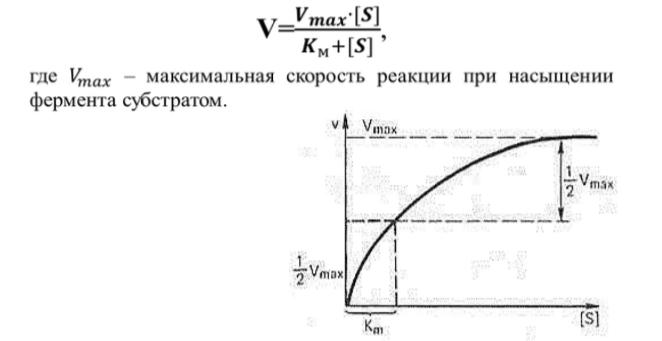
|
. 
P.s.:
1)Скорость ферментативной реакции макс-на: все акт.центры ферментов могут быть заняты субстратом.
2)Скорость ферментативной реакции равна половине максимальной
3) Скорость ферментативной реакции зависит от концентрации субстрата.
Зависимость скорости реакции от температуры – описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента.
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. в значениях до денатурации белков. Наряду с этим, как исключение, имеются ферменты некоторых микроорганизмов, существующих в воде горячих источников и гейзеров.
| При понижении температуры активность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи), температура тела которых понижается до 3-5°С. Это свойство ферментов также используется в хирургической практике при проведении операций на грудной полости, когда больного подвергают охлаждению до 22°С. | 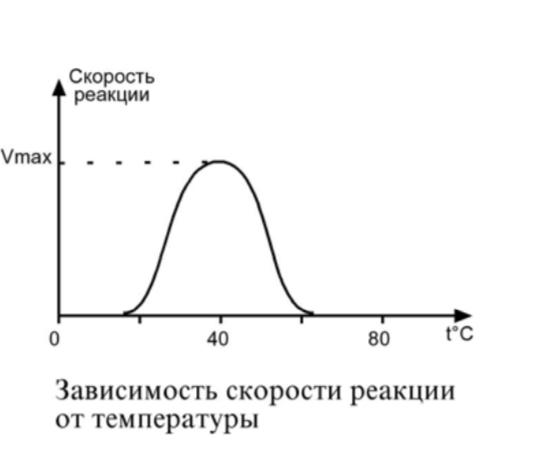
|
| Зависимость скорости реакции от рН – описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН. Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0. | 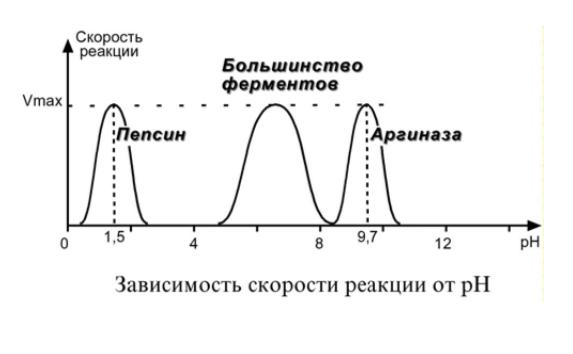
|
| Зависимость скорости реакции от концентрации субстрата. При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермент и скорость реакции снижается. | 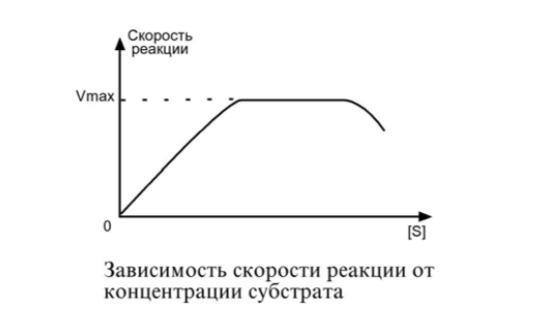
|
| Зависимость от концентрации фермента При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта. | 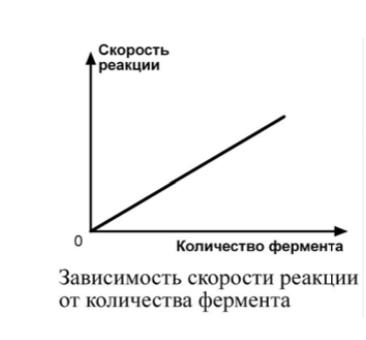
|
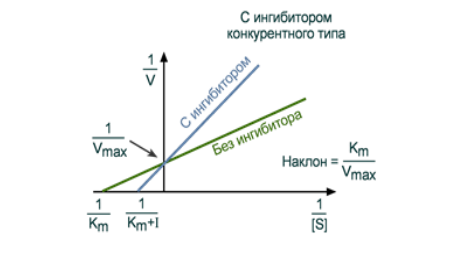
Конкурентное ингибирование
При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Лактатдегидрогеназа(ЛДГ)
Лактатдегидрогеназа (L‑лактат:НАД‑оксидоредуктаза, ЛДГ, КФ 1.1.1.27) является гликолитическим ферментом и катализирует следующую реакцию:
Лактат + НАД  Пируват + НАДН
Пируват + НАДН
В сыворотке крови фермент существует в пяти молекулярных формах, различающихся по первичной структуре, кинетическим свойствам, электрофоретической подвижности.. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2).
По изменению изоферментного состава оценивают метаболическое состояние органов и тканей.
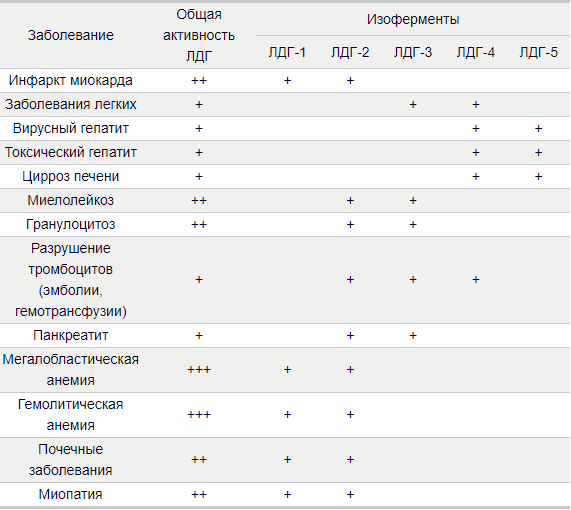
Все заболевания, протекающие с разрушением клеток, сопровождаются резким повышением активности ЛДГ в сыворотке крови. Нарастание общей активности фермента обнаруживается при таких заболеваниях как инфаркт миокарда, некротическое поражение почек, гепатит, панкреатит, воспаление и инфаркт легкого, опухоли различной локализации, повреждения, дистрофия и атрофия мышц, гемолитические анемии и физиологическая желтуха новорожденных, лимфогранулематоз, лейкозы.
Увеличение в крови активности ЛДГ1 и ЛДГ2 – наиболее характерно для инфаркта миокарда.
Щелочная фосфатаза
Активность щелочной фосфатазы в сыворотке крови возрастает при тяжелом рахите, заболеваниях печени (механическая желтуха, острые гепатиты, циррозы), различных заболеваниях костной системы и снижается при хроническом гломерулонефрите, квашиоркоре, гипотиреозе и цинге. Норма активности щелочной фосфатазы в крови женщины — до 240 Ед/л, мужчины — до 270 Ед/л.
Креатинкиназа(КК)
Димерный фермент креатинкиназа представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, наиболее активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы.
И в мышцах, и в сердце, и в головном мозге есть этот фермент, но наблюдаются разные соотношения его изоферментов. Если в крови преобладает форма фермента BM, значит у человека – инфаркт миокарда. Причем, активность КК1 (BM) достигает своего пика в крови в 1-2 сутки от начала инфаркта миокарда. 
Медицинская энзимология – это раздел биохимии, изучающий применение ферментов в медицине.
В медицинской энзимологии выделяют три основных направления:
•энзимопатология
•энзимодиагностика
•энзимотерапия
Энзимопатологии (энзимопатии) – состояния, связанные с патологическим увеличением или снижением активности ферментов. Наиболее часто встречается снижение их активности с нарушением соответствующих метаболических процессов. При энзимопатологии клиническое значение может иметь:
· накопление субстрата реакции, например: фенилаланина при фенилкетонурии, свободного билирубина при физиологических желтухах новорожденных, некоторых жиров при болезнях лизосомального накопления (липидозы),
· недостаток продукта, например: меланина при альбинизме, катехоламинов при паркинсонизме,
· обе особенности одновременно, как при гликогенозах, сопровождающихся гипогликемией при избытке гликогена в печени.
По характеру нарушения выделяют первичные и вторичные энзимопатии
Первичные (наследственные) энзимопатии связаны с генетическим дефектом и наследственным снижением активности. Например, фенилкетонурия связана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. В результате накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект. Заболевание подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты.
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак.
Энзимодиагностика – это исследование активности ферментов плазмы крови, мочи, слюны с целью диагностики тех или иных заболеваний. Примером может служить фермент лактатдегидрогеназа, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры. Увеличение активности α-амилазы в плазме крови и моче наблюдается при воспалительных процессах в поджелудочной и слюнных железах.
Энзимотерапия – это использование ферментов в качестве лекарственных средств.
Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал и т.п.), содержащие пепсин, трипсин, амилазу и т.п., и используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте.
Тканевой фермент гиалуронидаза нужна организму для обратимого изменения проницаемости межклеточного вещества, в основе которого находится гиалуроновая кислота. Лекарственную форму гиалуронидазы – лидазу – вводят для размягчения рубцов, появления подвижности в суставах, рассасывания гематом.
Цитохром с – белок, участвующий в процессах тканевого дыхания. Его применяют при асфиксии новорожденных, астматических состояниях, сердечной недостаточности, различных видах гепатита и т.п.
Мультиферментные (мультиэнзимные) комплексы (МЭК) - это объединение нескольких ферментов, катализирующих последовательные превращения субстрата.
Различают три типа мультиферментных комплексов:
· ферменты растворены в цитоплазме и контакт субстратов с ними осуществляется посредством диффузии;
· ферменты соединены друг с другом за счет белок-белковых взаимодействий;
· ферменты соединены друг с другом и иммобилизованы на внутриклеточных или цитоплазматических мембранах.
В каждом мультифсрмснтном комплексе имеется, по крайней мере, один аллостерический фермент, осуществляющий регуляцию суммарной реакции всего ферментного ансамбля. Чаше всего этот фермент катализирует скорость первой (самой медленной) реакции, а его отрицательным модулятором является конечный продукт всего процесса в целом.
История учения о ферментах. Сходство и отличие ферментов и неорганических катализат-в. Классификация и номенклатура ферментов. Классы, подклассы, подподклассы. Примеры.
Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся. Ферменты катализируют химические реакции, происходящие в организме.
Учение о ферментах выделено в самостоятельную науку – энзимологию. Термин «энзим» (от греч. en zyme – в дрожжах), так же, как и «фермент» (от лат.
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!