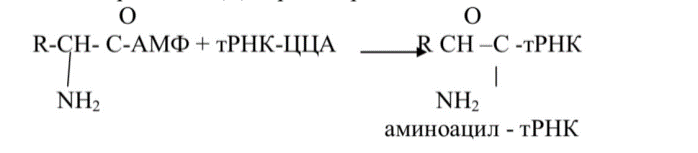Реутилизация пуриновых оснований – это процесс повторного их использования. Он особенно актуален в быстрорастущих тканях (эмбриональная, регенерирующая, опухолевая), когда активно идет процесс синтеза нуклеиновых кислот и недопустима потеря их предшественников.
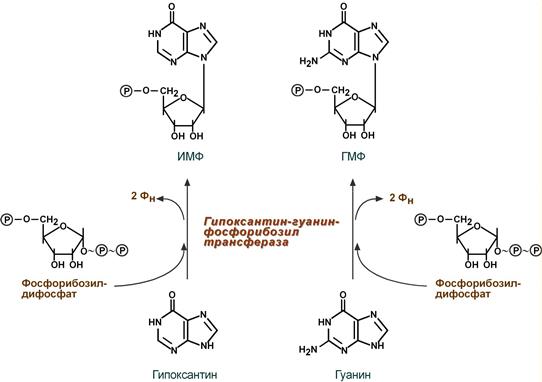
Сущность реутилизации заключается в присоединении к аденину, гуанину или гипоксантину рибозо-5-фосфата и образовании АМФ, ГМФ или ИМФ. Эту реакцию осуществляют соответствующие трансферазы. Наиболее характерным примером является реутилизация гипоксантина и гуанина под влиянием фермента гипоксантин-гуанин-фосфорибозил-трансферазы. В качестве источника рибозo-5-фосфата используется фосфорибозилдифосфат.
Катаболизм пуринов
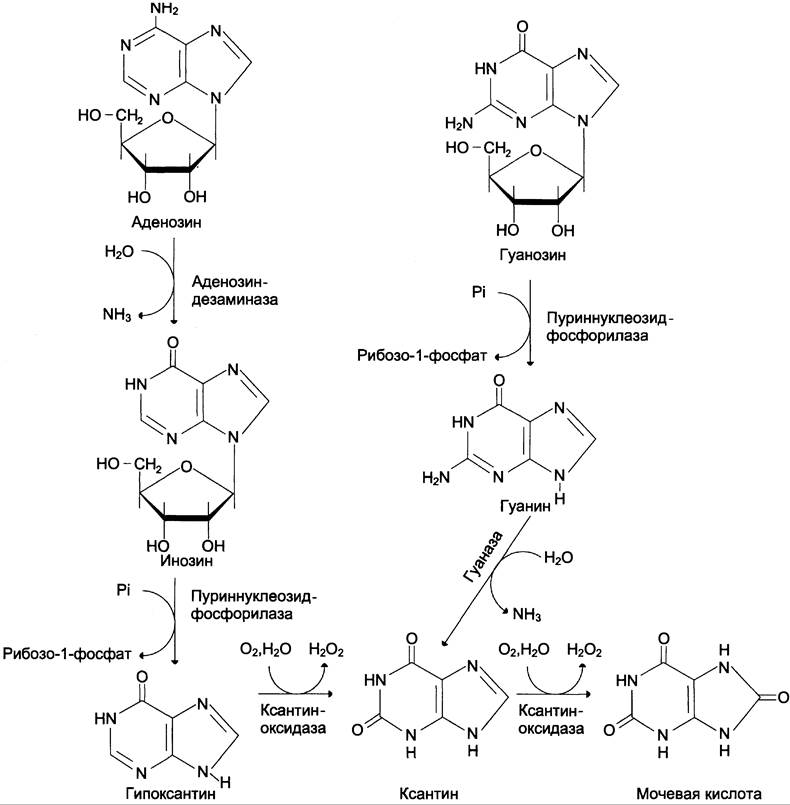
Самым частым нарушением обмена пуринов является повышенное образование мочевой кислоты с развитием гиперурикемии. В зависимости от длительности и тяжести гиперурикемия проявляется:
1. Появление тофусов – отложение кристаллов мочевой кислоты в мелких суставах ног и рук, в сухожилиях, хрящах, коже.
2. Нефропатии с поражением почечных канальцев и мочекаменная болезнь.
3. Подагра
Когда гиперурикемия принимает хронический характер, говорят о развитии подагры
В крови мочевая кислота находится в форме ее солей – уратов натрия. Растворимость уратов в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой, образуя тофусы (греч. tophus – пористый камень, туф). Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции – развивается подагрический артрит. В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног.
Длительное время подагру считали "болезнью гурманов", однако затем внимание исследователей переместилось к наследственному изменению активности ферментов метаболизма пуринов:
o увеличение активности ФРДФ-синтетазы – приводит к избыточному синтезу пуринов,
o уменьшение активности гипоксантин-гуанин-фосфорибозил-трансферазы – из-за этого ФРДФ не используется для реутилизации пуриновых оснований, а участвует в первой реакции их синтеза. В результате возрастает количество разрушающихся пуринов и одновременно повышается их образование.
Оба ферментативных нарушения рецессивны и сцеплены с X-хромосомой. Подагрой традает 0,3-1,7% взрослого населения земного шара, соотношение заболевших мужчин и женщин составляет 20:1.
Основы лечения: Диета – снижение поступления предшественников мочевой кислоты с пищей и уменьшение ее образования в организме. Для этого из рациона исключаются продукты, содержащих много пуриновых оснований – кофе, чай, шоколад, мясные продукты, печень, красное вино, пиво. Предпочтение отдается вегетарианской диете с количеством чистой воды не менее 2 л в сутки.
К лекарственным средствам лечения подагры относят аллопуринол, по структуре схожий с гипоксантином. Ксантиноксидаза окисяет аллопуринол в аллоксантин, и последний остается прочно связанным с активным центром фермента и ингибирует его. Фермент осуществляет, образно говоря, самоубийственный катализ. Как следствие, ксантин не превращается в мочевую кислоту и, поскольку гипоксантин и ксантин лучше растворимы в воде, они более легко выводятся из организма с мочой.
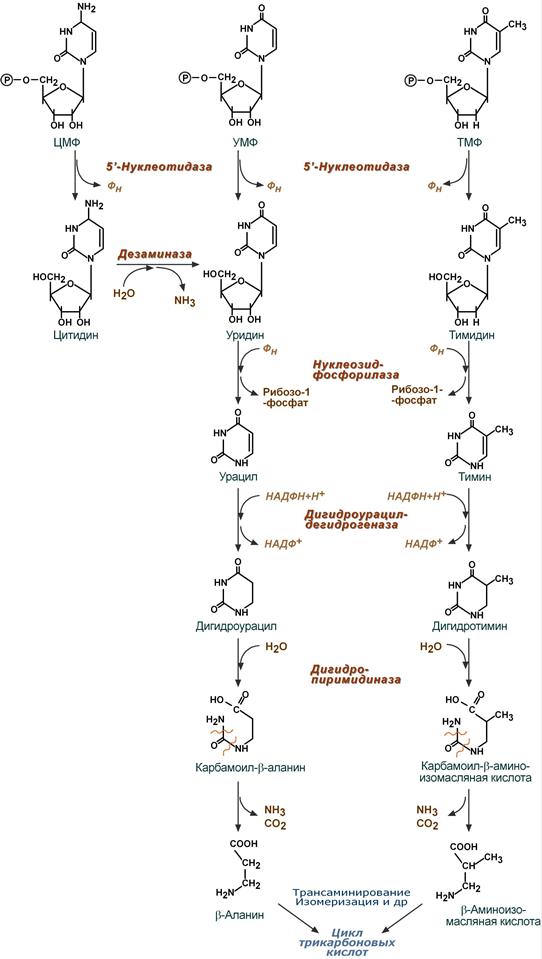
76. Биосинтез и катаболизм пиримидиновых нуклеотидов. Дополнительные пути синтеза пиримидиновых нуклеотидов. Оротовая кислота, метилурацил как лекарственные препараты.

Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует аспарагиновая кислота, глутамин, СО2, затрачивается 2 молекулы АТФ. В отличие от разветвленного синтеза пуринов этот синтез происходит линейно, т.е. пиримидиновые нуклеотиды образуются последовательно, друг за другом.
Условно можно выделить 3 общих этапа синтеза и реакции синтеза УТФ и ЦТФ:
1. Образование карбамоилфосфата
в отличие от синтеза мочевины происходит в цитозоле большинства клеток организма.
2. Образование пиримидинового кольца
Формирование пиримидинового кольца происходит после присоединения аспартата и реакций дегидратации и окисления. Первым пиримидиновым основанием является оротовая кислота.
3. Синтез оротидинмонофосфата и уридинмонофосфорной кислоты
В реакции с фосфорибозилдифосфатом (ФРДФ) к оротовой кислоте присоединяется рибозо-5-фосфат и образуется оротидилмонофосфат, при декарбоксилировании превращающийся в (УМФ).
Источником фосфорибозилдифосфата является первая из двух реакций синтеза фосфорибозиламина при образовании пуринов.
Синтез УТФ осуществляется в 2 стадии посредством переноса макроэргических фосф-х групп от АТФ.
5. Синтез ЦТФ происходит из УТФ с затратой энергии АТФ при участии глутамина, являющегося источником NH2-группы.
Распад пиримидиновых нуклеотидов происходит параллельно, с использованием одинаковых реакций и ферментов. Можно отметить несколько специфичных ферментов:
1. Фермент 5'-нуклеотидаза отщепляет 5'-фосфатную группу от ЦМФ, УМФ и ТМФ.
2. Дезаминаза проводит окислительное дезаминирование цитидина.
3. Нуклеозид-фосфорилаза удаляет рибозу от уридина и тимидина.
4. Дигидроурацил-дегидрогеназа – восстановление урацила и тимина.
5. Дигидропиримидиназа осуществляет гидролитическое расщепление пиримидинового кольца.
6. Далее происходит гидролитическое отщепление аммиака и углекислого газа.
7. После окончательного разрушения пиримидинового кольца появившиеся β-аминокислоты направляются в реакции трансаминирования, после чего соответствующие кетокислоты изомеризуются и далее сгорают в ЦТК.
Оротовая кислота улучшает репродуктивное здоровье, благоприятно влияет на развитие плода при беременности. Была показана эффективность оротовой кислоты у детей от 6 месяцев до 10 лет, страдающих различными кожными заболеваниями (экзема, нейродермит, псориаз, ихтиоз).
Метацил (Metacilum) — 4-метилурацил. Метацил ускоряет процессы клеточного размножения в тканях и органах, стимулирует кроветворение (преимущественно лейкопоэз), повышает специфический иммунитет, оказывает противовоспалительное действие, способствует эпителизации слизистых оболочек. По экспериментальным данным, у облученных животных метацил, назначаемый одновременно с антибиотиками и сульфаниламидными препаратами, усиливает терапевтическую эффективность последних. М. предложен как стимулятор кроветворения, для ускорения заживления вялотекущих ран, трофических язв и т. Д
77. Переваривание и всасывание железосодержащих хромопротеинов. Особенности всасывания и обмена железа. Синтез порфиринов, гема и гемоглобина. Регуляция синтеза гемоглобина. Эритропоэтин.
При попадании в желудок под действием HCl желудочного сока железо высвобождается из элементов пищи (гемопротеины, железосодержащие белки).
Всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). Для лучшего всасывания железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+ используется аскорбиновая кислота. Железо мясных продуктов преимущественно находится в двухвалентной гемовой форме, и поэтому хорошо всасывается.
Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Образованный в желудке при участии HCl комплекс [железо(III)—муцин] взаимодействует с мембранным белком интегрином, железо переносится внутрь клетки и восстанавливается до Fe (II) параферритином, и далее при помощи мобилферрина перемещается к месту использования. Роль этого пути очень низка.
2. Другая часть негемового железа (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты или при участии ферроредуктазы (DcytB, дуоденальный цитохром B) и далее переносится внутрь белком DMT-1 (divalent metal ion transporter-1). Этот же транспортер переносит в клетку другие двухвалентные металлы, т.е. существует постоянная конкуренция между ионами Fe2+ и ионами кальция, цинка, магния.
3. Основным способом всасывания (до 20-30% от полученного с пищей) является транспорт гемового железа. Гемовое железо связывается с белком НСР1 и в цитозоле высвобождается из гема при действии гемоксигеназы, и далее переносится по клетке.
Регуляция всасывания
Транскрипционные факторы, от активности которых зависит экспрессия DMT и HCP1, чувствительны к содержанию железа в энтероците и к степени внутриклеточной гипоксии. Больные с выраженной железодефицитной анемией способны повышать абсорбцию железа до 20-40 мг/сут.
Основным и отрицательным регулятором всасывания железа является белок гепсидин, подавляющий экспрессию генов DMT и ферропортина.
Останется железо в энтероците или будет выводиться в кровь зависит и от насыщенности трансферрина. При "пустом" трансферрине железо будет более активно переноситься через базолатеральные мембраны наружу и присоединяться к трансферрину.
Значительно больше поступает железа при питании мясными продуктами – 20-30% и из яиц и рыбы − 10-15% от поступившего в ЖКТ (гемовое железо), хуже всего оно всасывается из растительных продуктов – на 1-5%. Аскорбиновая кислота в пище намного улучшает усвояемость железа.
Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина и танина (чай, кофе, напитки), фосфатов, оксалатов (растительные продукты) значительно ухудшает всасывание железа (в 4-6 раз), т.к. они образуют нерастворимые комплексы с железом (III) и выводятся с калом.
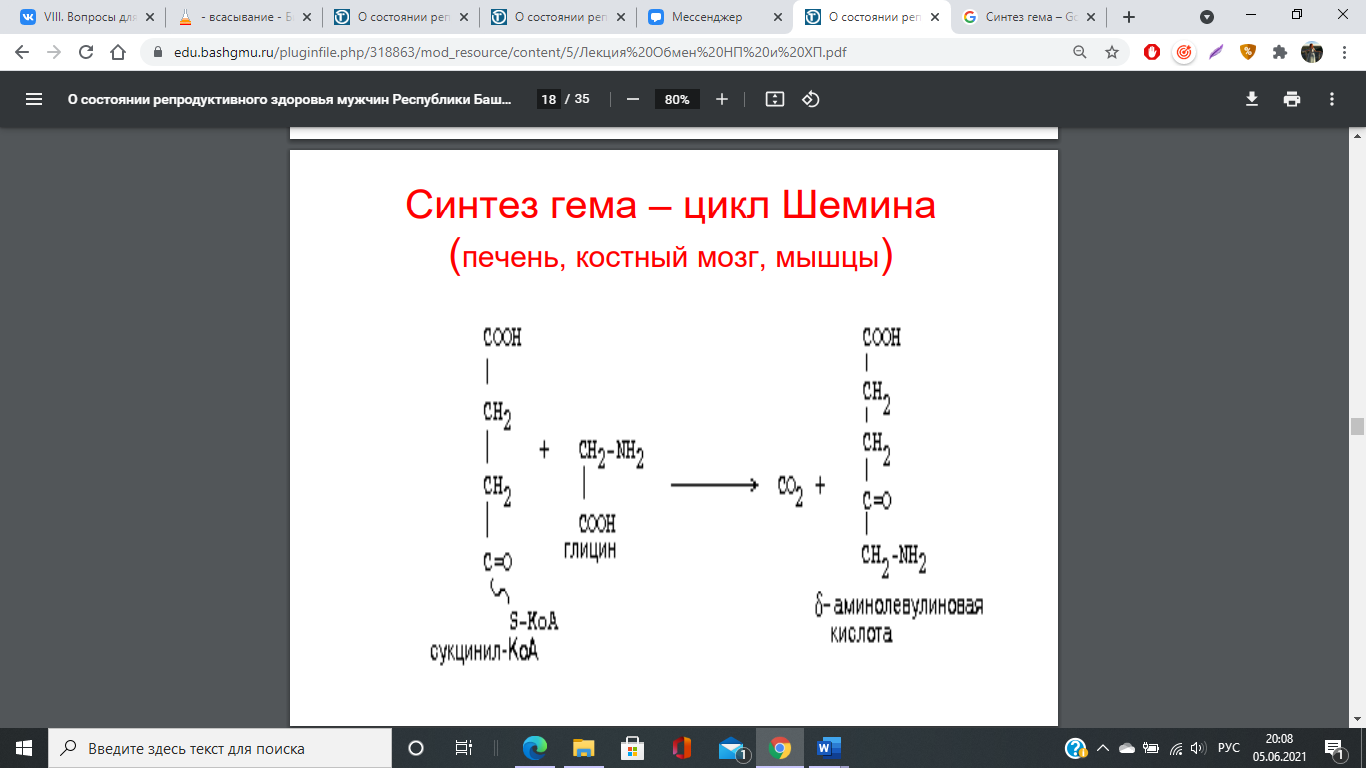
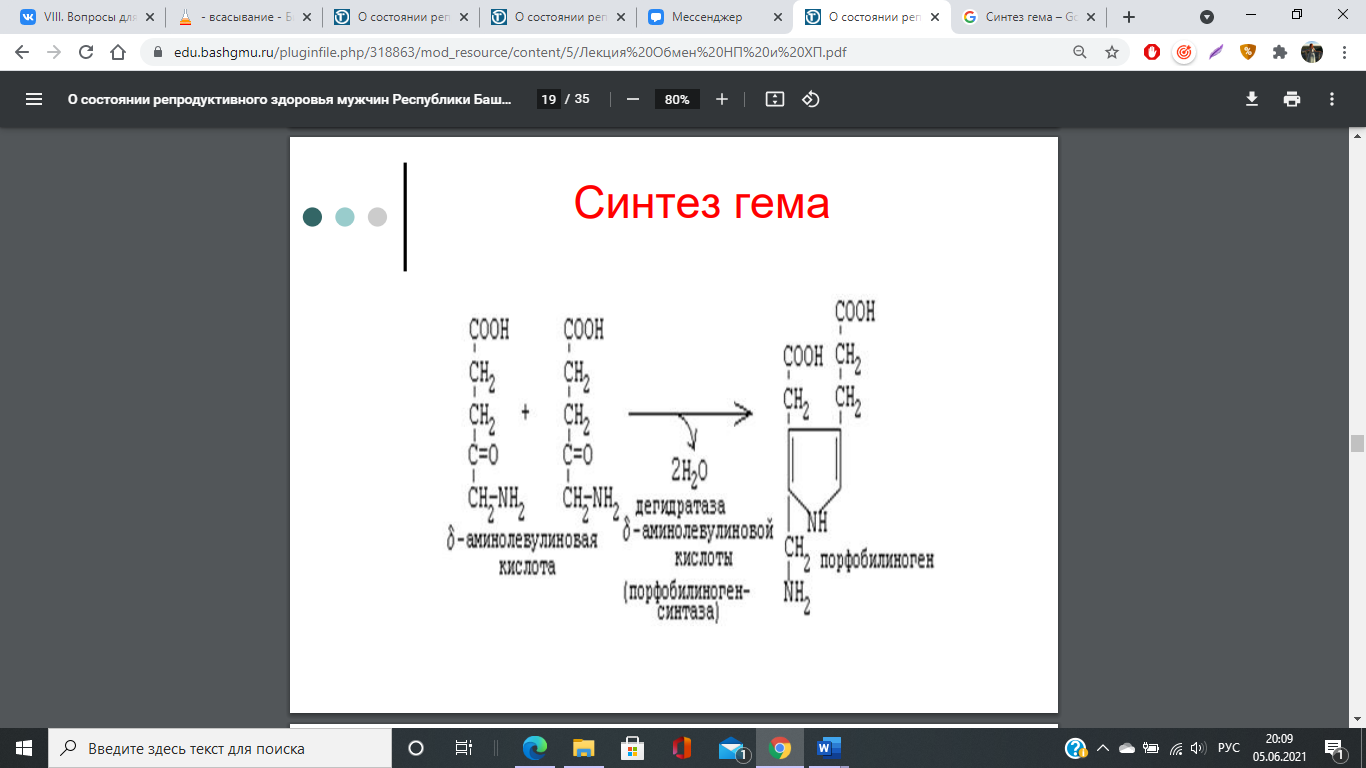
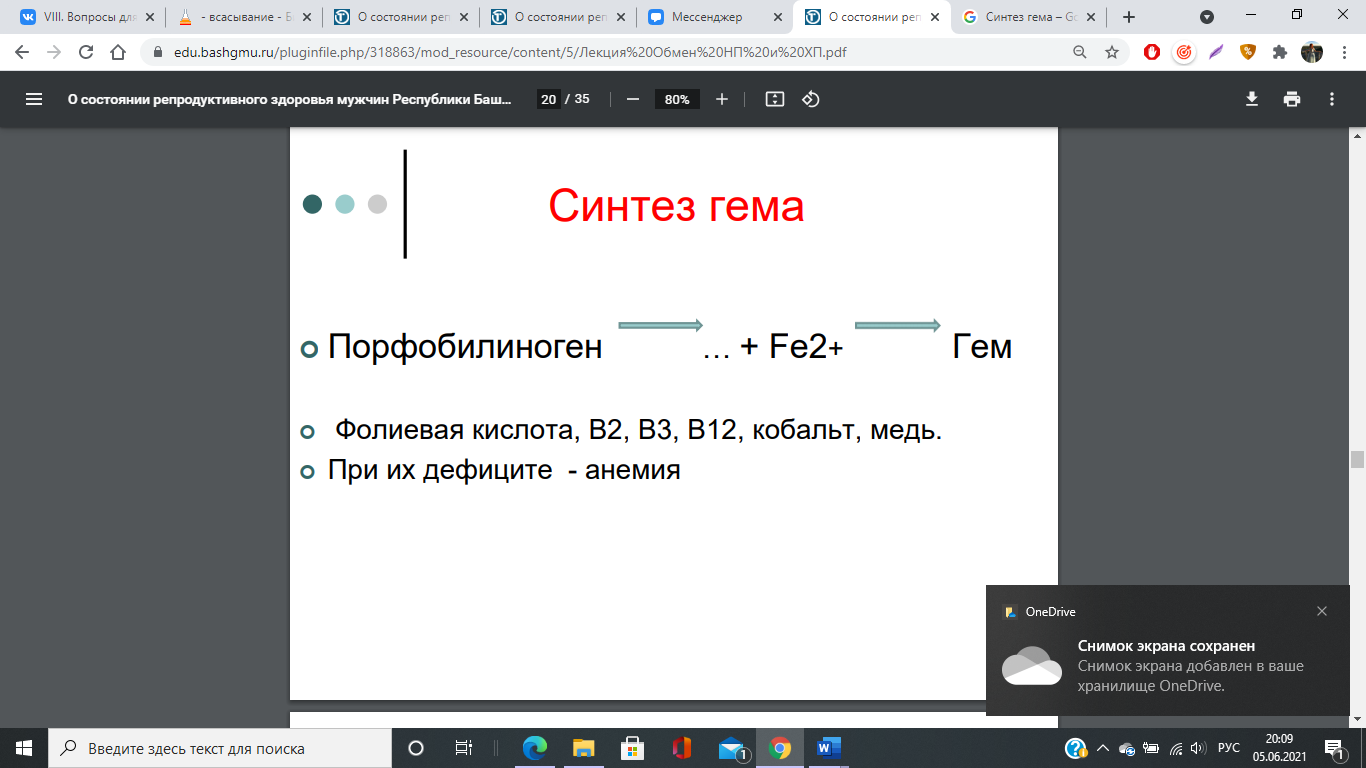
Регуляция синтеза гема
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
1. Гем: напрямую оказывает отрицательный аллостерический эффект на фермент,влияет на транскрипцию фермента. После взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается.
Регуляция синтеза гема и аминолевулинат синтазы???
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsive element-binding proteins – белок, связывающий железочувствительный элемент), который в отсутствии ионов железа обладает сродством к железочувствительному участку IRE (англ. iron-responsive element) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи.
При наличии ионов железа они связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и это инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышению активности аминолевулинатсинтазы способствуют различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
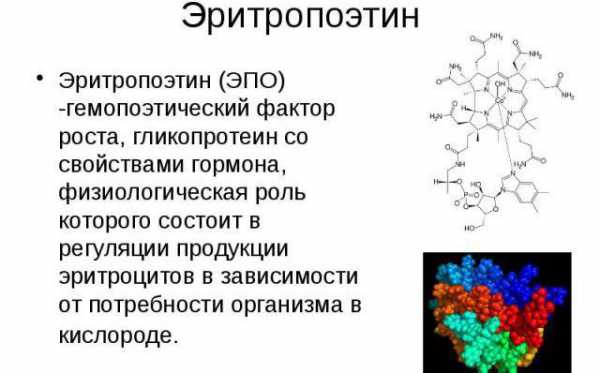
78.Распад гемоглобина и образование желчных пигментов. Отличительные свойства прямого и непрямого билирубина. Нарушения пигментного обмена при желтухах, дифференциальная биохимическая диагностика различных типов желтух. Характеристика катаболизма гемоглобина в неонатальном периоде. Физиологическая желтуха новорожденных.
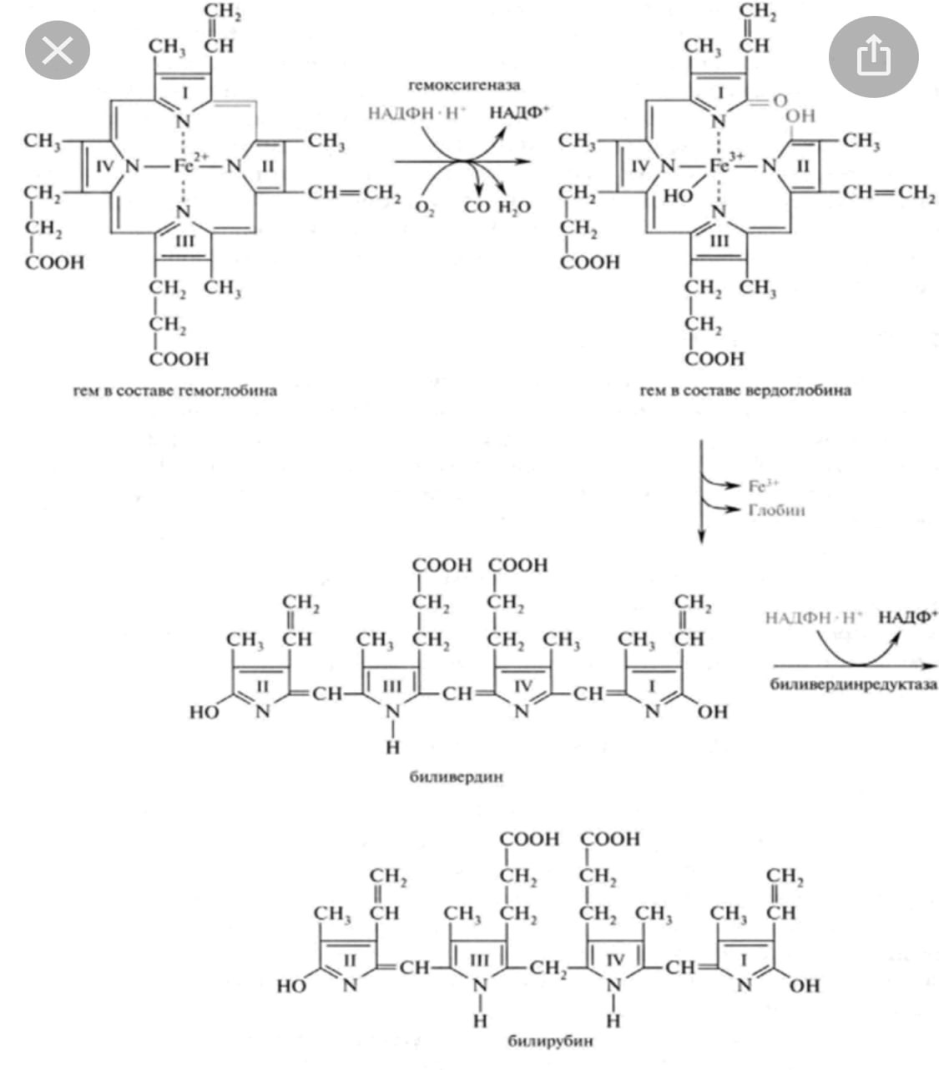
В сутки распадается около 9 Г гемопротеины средняя продолжительность жизни эритроцитов После этого Эритроциты поступают редкие системы мононуклеарных фагоцитов (СМФ) и распадаются. Если эритроциты лизируются в кровеносном русле то его гемоглобин транспортируется в СМФ с помощью специального транспортера гаптоглобина различают три этапа распада Hb
1) в клетках СМФ
2) в гепатоцитах
3) в полости кишечника
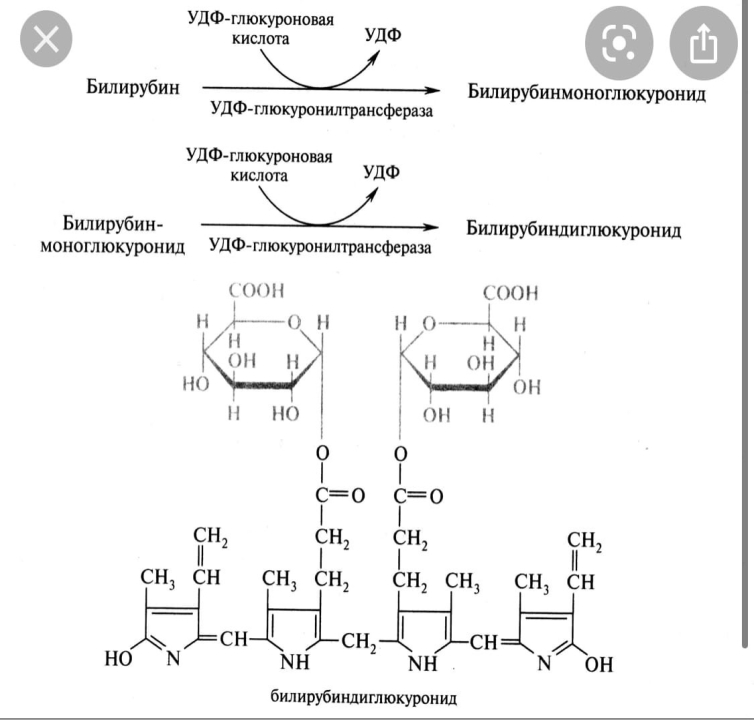
Большая часть прямого билирубина экскретируется в кишечник где идёт 3 фаза распада билирубина. Билирубин образуется в СМФ, поступает в кровь. Он малорастворим и токсичен для нервных клеток, поэтому транспортируется по крови альбуминами такой билирубин называется свободным, неконъюгированный или непрямым. Комплекс билирубин- альбумин доставляется в печень, где происходит 2 фаза распада гемоглобина билирубин освобождается от альбумина поступает в гепатоциты с помощью У-лигандина и доставляется в ЭПС с помощью фермента глутатион сера-трансфераза. Здесь происходит конъюгирование билирубина с глюкуроновой кислотой, что снижает его токсичность и повышает растворимость в воде. Такой билирубин называется связанным,, конъюгированными или прямым. Он не токсичен если попадает в кровь, то выводится вместе с мочой.
Существует группа наследственных,связанных с нарушением образование, превращение и выведение билирубина. При повышении их концентрации в крови, билирубин откладывается в тканях в том числе кожи и слизистой, это вызывает их окрашивание в жёлтый цвет- цвет билирубина. Эти состояния называют желтухи. Выделяет физиологические и патологические желтухи. Физиологическая желтуха- желтуха новорожденных она возникает из-за того что во-первых у новорождённых идет усиленный распад эритроцитов и фетального гемоглобина, во-2х у них имеется возрастная недостаточность система захвата и конъюгирования. Печень не справляется с повышенной нагрузкой поэтому концентрация билирубина повышается такая желтуха возникает между 1 и 3 днями жизни, пик 4 -5 день, проходит через 14 дней.Симптомы желтухи: жёлтый кожный покров, судороги, повышенная температура тела. Лечение фототерапия, переливание крови через пупочную вену и тд. Патогенные желтухи гемолитическая или надпеченочная, паренхиматозная, механическое или подпеченочная, врождённая.
Гемолитическая желтуха связана с усилением внутрисосудистого гемолиза эритроцитов, это происходит при действии гемолитических ядов, из-за резус конфликта, переливание несовместимой группы крови и малярии. Печень не успевает конъюгировать билирубин, поэтому повышается в крови содержание непрямого билирубина. Фекалий и моча имеют темную окраску из-за большого количество ферментов. В моче билирубин отсутствует, так как комплекс билирубин-альбумин не проходит через почечный барьер. В моче повышенное содержание уробилиногена.
Паренхиматозная желтуха возникает при вирусном и токсических гепатоцитах, опухоль в печени, и так далее. Из-за повреждения гепатоцитов, уменьшается захват и конъюгирование билирубина, в крови увеличивается содержание и прямого и непрямого билирубина. В моче появляется б/б и уробилиноген. Моча темного цвета, а фекалии окрашены слабо. Кроме этого у больных повышается активность АсТ и АлТ в крови.
Механическая возникает из-за нарушения оттока желчи в кишечник. Причинами могут быть закупорка желчевыводящих путей камнями или гельминтами, сдавлении их опухолью головки поджелудочной железы.Желчь начинает поступать в кровь. В крови вначале повышается содержание прямого, а затем непрямого билирубина. Появляется уробилиноген и желчные кислоты. Желчные кислоты действует как гемолитический яд, поэтому в крови повышается непрямой билирубин. В моче появляется билирубин уробилиноген и ЖЕЛЧНЫЕ кислоты. Моча ярко темного цвета, кал из-за отсутствия пигмента бесцветен-ахоличный стул.
Врожденная желтуха причиной является врожденная недостаточность или отсутствие билирубин-глюкуронилтрансфераза, УДФ-глюкоронилтрансферазы.
Определение общего билирубина и его фракций используется для диагностики и дифференциальной диагностики желтух различной этиологии – гемолитической (надпеченочной), паренхиматозной (гепатоцеллюлярной, печеночной) и обтурационной (механической, подпеченочной). При гемолитической желтухе гипербилирубинемия развивается в основном за счет непрямого (свободного) билирубина. При паренхиматозной желтухе происходит деструкция гепатоцитов и нарушается экскреция прямого билирубина в желчные ходы, он попадает в кровь. Кроме того из-за функциональной несостоятельности гепатоциты не способны эффективно захватывать из крови непрямой билирубин и конъюгировать его. При паренхиматозной желтухе наблюдается гипербилирубинемия смешанного типа. При обтурационной желтухе нарушается эвакуация желчи в двенадцатиперстную кишку, что приводит к повышению в крови прямого, а в более поздние сроки болезни и непрямого билирубина.
79. Репликация ДНК, условия, ее этапы: инициация, элонгация, терминация. ДНК-полимеразы. Репликативная вилка
Репликация (самоудвоение, биосинтез) ДНК
В 1953 г. Уотсон и Крик открыли принцип комплементарности (взаимодополняемости). Так, А=Т, а Г=Ц.
Условия, необходимые для репликации:
1. строительный материал - дезоксинуклеозидтрифосфаты (дАТФ, дГТФ, дЦТФ ТТФ2
2. ионы Мg2+, играющие стабилизирующую роль;
3. наличие SSB белков (стабилизируют раскручивание цепи ДНК)
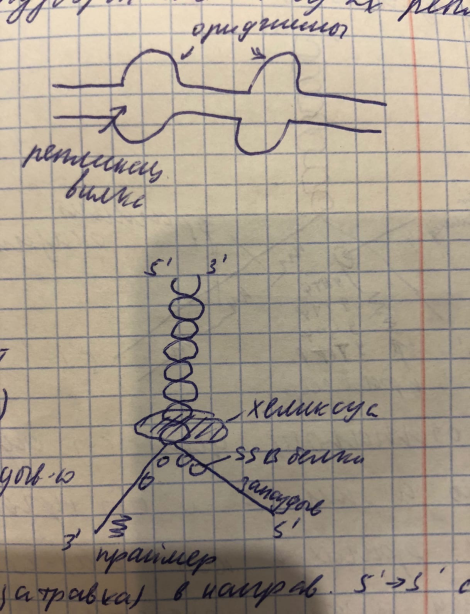
4 матрица - расплетенная двойная спираль ДНК. Это расплетение называется репликативной вилкой
5. наличие ферментов:
- ДНК-хеликаза расплетает двухцепочечной молекулы ДНК на отдельные цепи;
-ДНК-топоизомераза- уменьшает степень скручивания ДНК
- ДНК-полимераза (альфа, бета,гамма и тд)
ДНК полимераза альфа- содержит субъединицу. которая называется праймаза (она синтезирует праймер). Праймер- это короткий фрагмент РНК необходимый для инициации транскрипции.
- ДНК-лигаза - сшивает концы новой ДНК
Основные этапы репликации:
1.Инициация Инициация реакция начинается одновременно во многих участках ДНК, которые называются ориджины и специальный белок распознаёт ориджины и инициирует раскручивания цепи ДНК с помощью хеликазы в двух направлениях, с образованием 2 “пузырей” эти пузыри состоят из двух репликационных вилок.
Репликационная вилка стабилизируется SSB белками. В репликативной вилки различают 2 цепи ведущую (3-5) и отстающую (5-3). Вначале синтезируется праймер в направлении 5 к 3 с помощью праймазы (является субъединицей ДНК полимеразы Альфа). Праймер состоит из 8-10 рибонуклеотид и он нужен потому что ДНК полимераза способны только удлинять растущую цель.
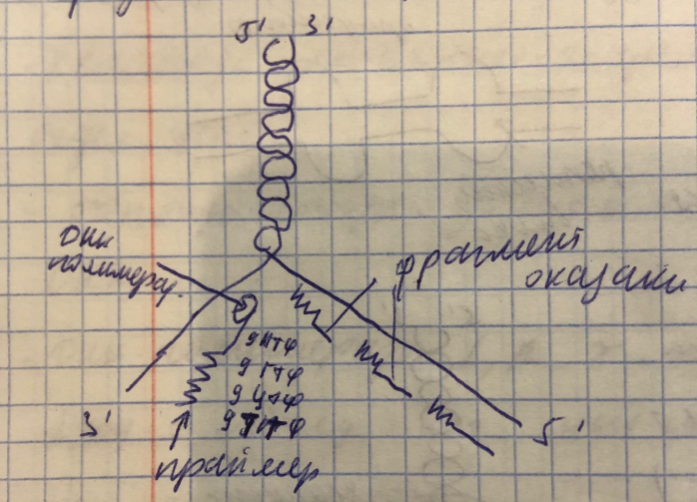
2. Элонгация
синтез новых нитей ДНК при участии ДНК-полимеразы, катализирующей образование фосфодиэфирной связи между новыми нуклеотидами. Присоединение нуклеотидов идет в соответствии с принципом комплементарности. Синтез идет 5’-конца к 3’-концу. На одной цепи синтез происходит непрерывно, а на другой - прерывается с образованием коротких фрагментов. В результате на одной цепи образуются короткие фрагменты - фрагменты Оказаки;
3. Терминация
Наступает тогда, когда встречаются 2 репликативной вилки в соседних ориджин. В этой стадии все праймеры удаляются ДНК полимеразой или специфической РНК-азой, и на их месте РНК полимераза бета достраивает цепь ДНК по принципу комплементарности. Затем ферменты оказаки сшиваются липазой с формированием дочерней полноценной цепи. Нуклеотиды ошибочно включенные в ходе синтеза удаляется ДНК полимеразой Альфа и замещаются ДНК полимеразой бета. На концах хромосом содержится 100 и 1000 раз повторяющихся фрагментов ТТА ГГГ, который называется теломер. Он не несёт генетической информации, но обеспечивает стабильность генома,те защищает хромосому в процессе репликации. При каждом делении теломер укорачивается на 200-300 нуклеотидов поэтому клетка может делиться около 50 раз. после чего она погибает, то есть теломер является своеобразными биологическими часами клетки. Однако у таких клеток как эмбриональные, опухолевые, стволовые есть фермент теломераза, которая после каждого акта деления клетки достраивать теломер до исходной длины. Поэтому такая клетка становится практически бессмертной.
Системы репарации поврежденной ДНК состоит из ферментов эндонуклеаз, экзонуклеаз., ДНК полимераза бета, ДНК лигазы, и тд.
Репликация протекает в ядре и частично в митохондриях в синтетическую фазу митотического цикла (S фаза). Значение репликации состоит в передаче информации от ДНК матери к дочерней ДНК.
80. Биосинтез РНК (транскрипция): условия, механизм и биологическое значение. Основные
этапы: инициация, элонгация, терминация, посттранскрипционный процессинг и-РНК.
Транскрипция – процесс переписывания генетической информации, закодированной в виде определенной последовательности дезоксирибонуклеотидов ДНК, на молекулу РНК.
Условия:
1. ДНК-матрица. Матрицей является одна цепь ДНК, причем не вся целиком, а только те фрагменты, которые несут генетическую информацию о синтезе необходимых в клетке продуктов в данный момент.
2. Рибонуклеозидтрифосфаты (АТФ, ГТФ, УТФ, ЦТФ).
3. Фермент ДНК-зависимая РНК-полимераза. В ядрах эукариот обнаружены 3 специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая пре-рРНК, РНК-полимераза II, ответственная за образование пре-мРНК, РНК- полимераза III, синтезирующая пре-тРНК.
ДНК-зависимая РНК-полимераза состоит из нескольких субъединиц, имеющих несколько центров связывания регуляторных факторов
4. Факторы инициации, элонгации и терминации.
5. Ионы магния.
Этапы транскрипции: 1) синтез первичного транскрипта (образование преРНК),
-инициация
-элонгация
-терминация
2) созревание транскрипта (процессинг) – посттранскрипционная модификация первичного транскрипта.
В отличие от синтеза ДНК синтез РНК является ассиметричным (протекает лишь на одной из цепей ДНК) и консервативным (так как матрица ДНК по окончании процесса возвращается в исходное состояние).
Синтез РНК протекает также, как и синтез ДНК, в направлении 5’ 3’.
Этап -ИНИЦИАЦИЯ
Открытый участок ДНК, с которого начинается процесс транскрипции, называется промотором. С определенной последовательностью нуклеотидов промотора (ТАТА) связывается особый белковый фактор, получивший название ТАТА фактора, который облегчает взаимодействие промотора с РНК-полимеразой. РНК-полимераза присоединяется к промотору и с участием факторов инициации раскручивает примерно один виток двойной спирали.ДНК. К этому участку подходят АТФ или ГТФ, которые присоединяются к соответствующему нуклеотиду матрицы ДНК водородными связями без отщепления пирофосфата.
Этап-ЭЛОНГАЦИЯ
Синтез РНК всегда начинается с пуринового нуклеотида и заканчивается скольжением ДНК зависимой РНК полимеразы, вдоль матрицы ДНК. Полимераза при этом выполняет 3 функции:
1) расщепляет и раскручивает соответствующий фрагмент ДНК
2) образует фосфодиэфирную связь между нуклеотидами растущей цепи РНК по правилу комплементарности. Скорости элонгации составляет 20-30 нуклеотидов в секунду
3) вновь сплетает и скручивает за собой участок ДНК.
Освободившиеся промотор связывает новый ТАТА фактор, факторы инициации и РНК полимераза, то есть один и тот же ген может транскрибироваться одновременно несколькими ферментами.
3 этап- ТЕРМИНАЦИЯ
Синтез прекращается, когда фермент доходит до определенной последовательности ДНК - терминирующего кодона.С помощью РНК-полимеразы и фактора терминации происходит разрушение гибридного комплекса ДНК-РНК и новосинтезированная молекула мРНК отсоединяется от матрицы ДНК. Однако она не является функционально активной молекулой и подвергается созреванию.
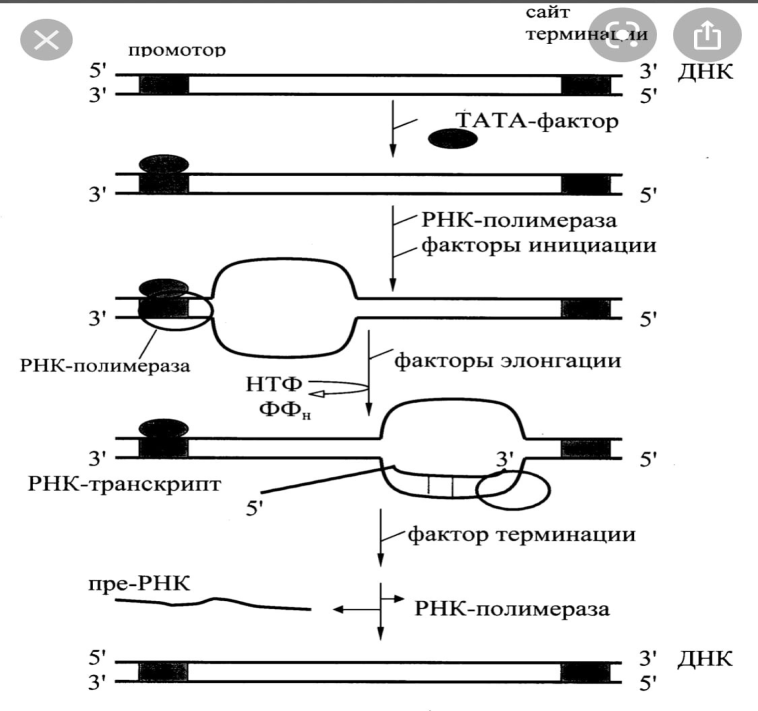
| Участок ДНК, ограниченный промотором и терминирующим кодоном, представляет единицу транскрипции – транскриптон. У эукариот в состав транскриптона входит, как правило, только один ген.
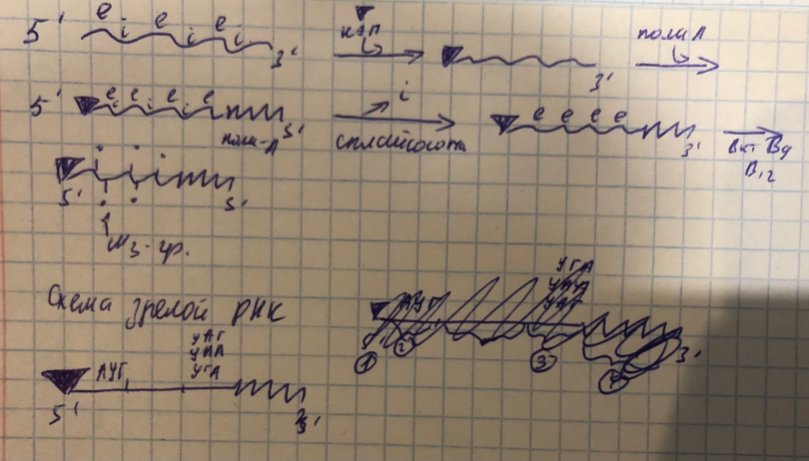
СОЗРЕВАНИЕ ТРАНСКРИПТА..Модификация матричной РНК
Созревание транскрипта (процессинг) – превращение пре-мРНК в функционально активные молекулы. Оно включает:
1-копирование
2-полиаденилирование
3 -сплайсинг
Копирование заключается в присоединении к 5` концу РНК 7 метил-гуанозина, которая называется кэп, по-другому колпачок Он защищает РНК от действия экзонуклеаз.
2 этап полиаденилирование заключается в присоединении к 3` концу полиа-полимеразы. ПолиА-хвост защищает РНК от действия экзонуклеаз и обеспечивае транспорт РНК в цитоплазму.
|
| 3 этап сплайсинг. Вырезание интронов и сшивание экзонов с помощью сплайсосом (это комплекс из 5 молекул РНК и специальных белков). Затем РНК метилируется при участии витамина B9 и B12, Причём метилируется 1 нуклеотид из каждых 400. Созревшая мРНК связывается со специальным белком информером и доставляется им из ядра в цитоплазму к рибосомам.В результате процесса мРНК укорачивается на несколько сотен нуклеотидов. На 5` конце имеется КЭП, к нему примыкается стартовый триплет АУГ. Далее идет информативная часть, которая завершается кодонами УАА, УАГ, УГА- это стоп кодоны. И на 3` конце находится полиАхвост.
| 
|
| | | |
81. Биосинтез белков. Активация аминокислот, субстратная специфичность аминоацил-тРНКсинтетаз, адапторная функция тРНК. Трансляция, этапы (инициация, элонгация, терминация). Энергетические источники. Посттрансляционное созревание молекулы белков. Процесс фолдинга. Ферменты фолдинга, шапероны
БИОСИНТЕЗ БЕЛКА –ТРАНСЛЯЦИЯ
Трансляция – перевод генетической информации, закодированной в виде полинуклеотидной последовательности матричной РНК, в аминокислотную последовательность белковой молекулы.
Участие РНК в процессе синтеза белков.
В синтезе белковой молекулы принимают участие 3 вида РНК:
матричные (информационные), рибосомальные и транспортные.
Матричная (информационная, мРНК) переносит генетический код - транскрибированную в виде кодонов (определенной последовательности триплетов нуклеотидов) информацию, в которой зашифрована аминокислотная последовательность белков, из ядра клетки к рибосомам.
Рибосомальная РНК (рРНК) поддерживает определенную структуру рибосом, обеспечивает правильную ориентацию мРНК и адекватное течение процесса трансляции.
Транспортная РНК (тРНК) выполняет две функции: транспортную т.е. осуществляет транспорт активированных аминокислот к месту синтеза белка и адапторную, т.е. определяет место аминокислоты в первичной структуре строящегося белка.
В ходе процессинга тРНК происходит удаление с помощью нуклеаз концевых нуклеотидных последовательностей; метилирование, дезаминирование, восстановление ряда оснований и присоединение к 3’- концу тринуклеотидной последовательности – ЦЦА. В результате тРНК приобретает специфическую трехмерную конформацию, похожую на лист клевера.
Все тРНК имеют 4 ветви, основными из которых являются две: антикодоновая, содержащая антикодон – триплет нуклеотидов, комплементарный соответствующему триплету (кодону) мРНК, кодирующему определенную аминокислоту, и акцепторная, содержащая на 3’ - конце триплет ЦЦА, к остатку рибозы аденилового нуклеотида которого присоединяется аминокислота.
Этапы синтеза белка
Процесс трансляции протекает в 5 основных этапов: активация аминокислот, инициация, элонгация и терминация синтеза, посттрансляционная модификация.
Активация аминокислот.
1. Активация аминокислот протекает с участием аминоацил-тРНК-
синтетаз. Они обладают индивидуальной специфичностью по отношению к 17 аминокислотам и групповой – к тРНК. В активном центре этих ферментов имеется 4 участка, предназначенные для связывания определенной аминокислоты, транспортной РНК, АТФ и воды (необ-ходимой для участия в гидролитическом отщеплении неправильных аминоациладенилатов).
2. Аминоацил-тРНК-синтетаза образует с участием ионов магния фермент субстратный комплекс с аминокислотой и АТФ, которые взаимодействуют друг с другом с образованием аминоациладенилата и пирофосфата.
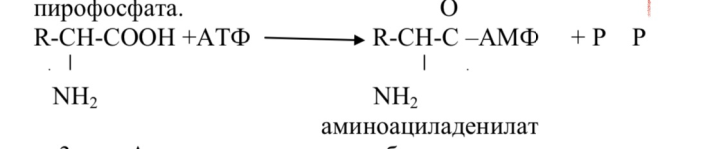
3. Аминоациладенилат, будучи еще связанным с ферментом, взаимодействует с остатком рибозы аденилового нуклеотида, входящего в состав триплета ЦЦА транспортной РНК.
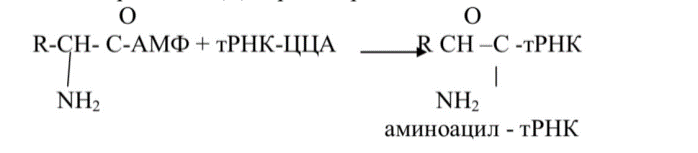
При этом образуется аминоацил-тРНК, который покидает активный центр аминоацил-тРНК-синтетазы
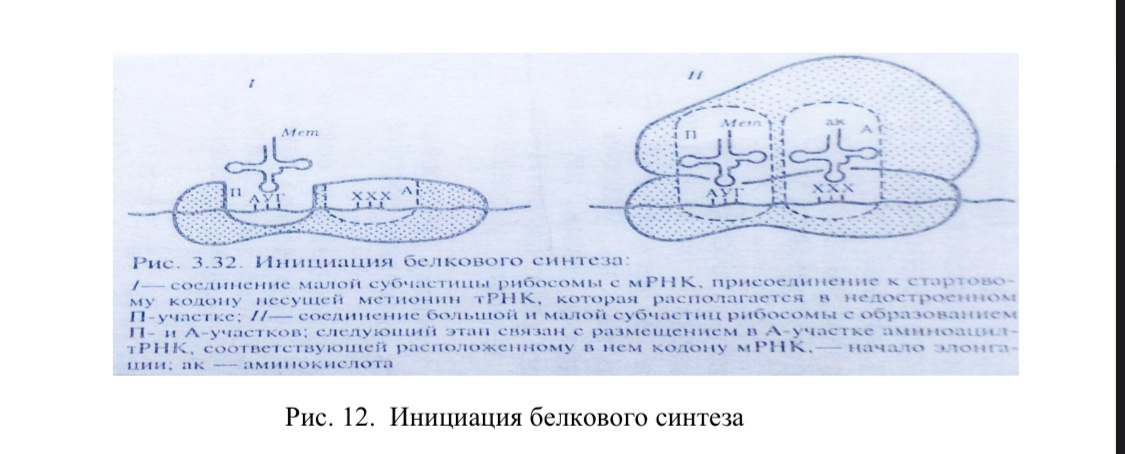
Элонгация полипептидной цепи
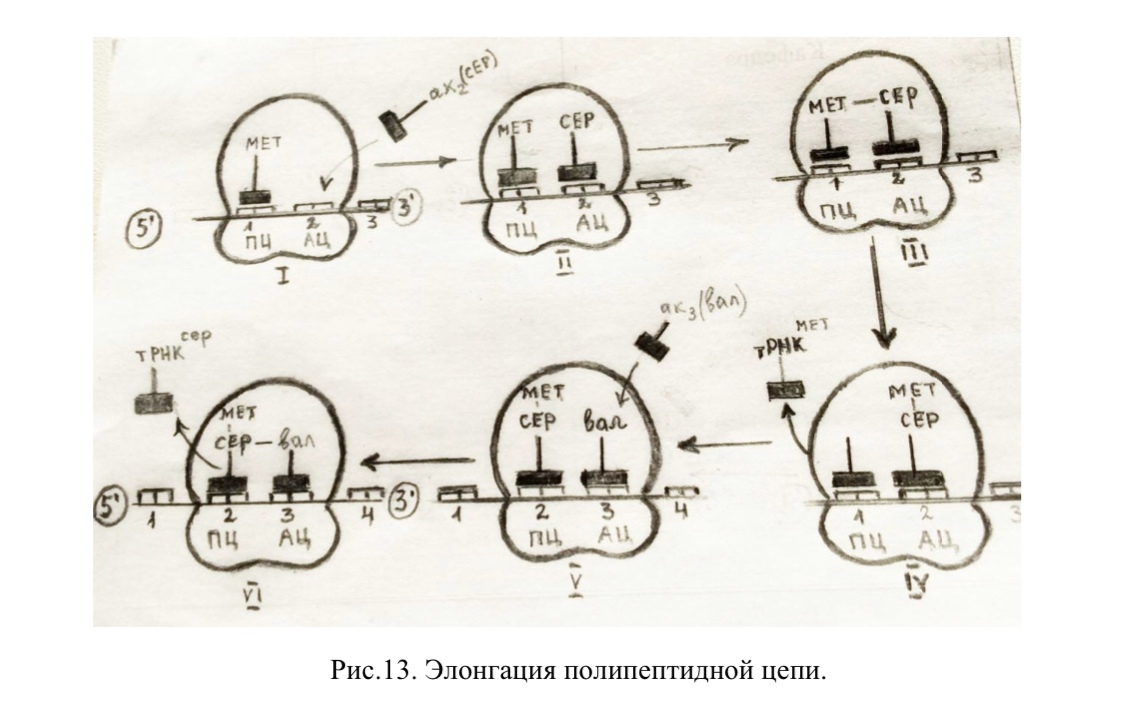
1. В аминоацильный центр инициирующего комплекса с помощью фактора элонгации ЕF-1 и энергии гидролиза ГТФ поступает аминоацил-тРНК, антикодон которой комплементарен находящемуся там кодону мРНК. В результате оба центра рибосомы оказываются занятыми: в пептидильном находится метионил-тРНК, а в аминоацильном - тРНК с присоединенной к ней второй аминокислотой (АК2).
2. Между карбоксильной группой метионина и аминогруппой АК2 за счет пептидилтрансферазной активности рРНК большой субъединицы рибосомы образуется пептидная связь. В результате метионин отщепляется от своей т- РНК и оказывается в аминоацильном центре в составе дипептидил-тРНК.
3. После этого рибосома с участием транслоказы и энергии ГТФ перемещается вдоль матричной РНК на один кодон. В результате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, оказывается в пептидильном центре, а в аминоацильном центре рибосомы открывается следующий кодон. При этом освободившаяся от метионина тРНК поступает в цитозоль, где может вновь соединиться со следующей молекулой метионина.
4. В соответствии с открывшимся кодоном мРНК в аминоацильный центр с помощью EF-1 и энергии ГТФ поступает следующий аминоацил-тРНК с АК3. Пептидилтрансфераза катализирует перенос дипептида с дипептидил- тРНК в миноацильный центр и образование пептидной связи между этим пептидом и АК3.
5. Рибосома с участием транслоказы и энергии ГТФ вновь перемещается на следующий кодон вперед по направлению к 3’-концу мРНК. Таким образом, трипептидил-тРНК располагается в пептидильном центре, а аминоацильный центр с открывшимся в нем следующим кодоном мРНК вновь оказывается свободным. При этом тРНК, доставившая АК2 оказывается вне рибосомы, отсоединяется от мРНК и поступает в цитозоль.
6. Такая последовательность повторяется многократно до тех пор, пока не откроется «немой» кодон.
Терминация синтеза полипептидной цепи
Как только в аминоацильном центре откроется немой (нонсенс) кодон (УАГ, УАА или УГА), не комплементарный ни одному из антикодонов тРНК, в него проникают 2 белковых фактора терминации и ГТФ. За счет энергии ГТФ происходит гидролитическое отщепление от пептидил-тРНК полипептидной цепи и поступление её в цитозоль. Освободившаяся тРНК выходит из пептидильного центра, и рибосома диссоциирует на исходные субъединицы.
В процессе трансляции может одновременно участвовать много рибосом. Они располагаются на мРНК с интервалом около 100 нуклеотидов, образуя комплекс – полирибосому.
Посттрансляционная модификация
Образовавшиеся полипептидные цепи подвергаются структурным изменениям, либо будучи еще связанными с рибосомами, либо после завершения синтеза:
- поступающая в цитозоль с рибосомы полипептидная цепь самопроизвольно приобретает конформацию α-спирали или β- структуры;
- в эндоплазматическом ретикулуме формируется пространственная структура (фолдинг), в осуществлении которого принимают участие особые белки – шапероны, обеспечивающие правильную укладку полипептидной цепи - образуются олигомерные структуры;
- к полипептидной цепи присоединяются простетические группы;
- в процессе формирования третичной структуры полипептидная цепь так же, как и радикалы образующих её аминокислот, может подвергаться различной ковалентной модификации: фосфорилированию, йодированию, гидроксилированию, карбоксилированию, метилированию, гликозили- рованию и др;.
- образуются дисульфидные связи между остатками цистеина, участвующие в образовании третичной структуры;
- с N-конца полипептидной цепи в ряде белков удаляется небольшой фрагмент – происходит ограниченный протеолиз. Он характерен для ферментов желудочно-кишечного тракта, некоторых гормонов (например, инсулина и др.).
Шапероны — сложные белки с консервативным механизмом действия, встречающиеся во всех царствах живой природы. Как говорилось выше, созревающая белковая цепочка выходит из рибосомы. Она еще незрелая, а пребывает в так называемом «расплавленном» состоянии. Шапероны, «подкарауливая» и захватывая белковые цепочки у самого выхода из рибосомного туннеля и таким образом направляя незрелые белки, находящиеся на судьбоносном перепутье, в верное русло. Шапероны не являются специфичными для разных аминокислотных последовательностей зарождающихся цепей, но они могут отличать зрелые белки от незрелых и действуют на последних.
Важнейшая группа шаперонов — шаперонины. Сворачивающийся белок попадает внутрь шаперонина, а «вход» закрывается специальной «шапочкой» либо смыканием краев блоков, из которых состоят кольца, чтобы белковая молекула не покинула шаперонин раньше времени. В таком защищенном состоянии белок может окончательно принять нативную конформацию.
Нужно сказать, что шапероны не только участвуют в фолдинге созревающих цепей, но и помогают «сломанным» белковым структурам, которые возникли в клетке в результате определенных воздействий, вновь принять правильную конформацию. Наиболее типичная причина таких «поломок» — тепловой шок, то есть поднятие температуры.Шапероны выполняют другие важные функции в клетке, например, транспорт белков через мембраны и сборку олигомерных белков.
82. Концепция один ген - один белок. Основной постулат молекулярной биологии. Генетический код, его важнейшие свойства. Механизмы мутации, типы. Мутагенные факторы. Разновидности точечных мутаций. Молекулярные механизмы возникновения наследственных болезней: серповидно-клеточной анемии, врожденная непереносимости сахарозы, гликогенозы и др.
Один ген - один фермент". Согласно этой гипотезе, каждая стадия метаболического процесса, приводящая к образованию в организме (клетке) какого-то продукта, катализируется белком-ферментом, за синтез которого отвечает один ген.
Позднее было показано, что многие белки имеют четвертичную структуру, в образовании которой принимают участие разные пептидные цепи. Поэтому формула, отражающая связь между геном и признаком, была несколько преобразована: "Один ген - один полипептид".
Генетический код- это способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он предназначен для перевода четырёхзначного языка нуклеотидов(А, Г, У, Ц) в двадцатизначный язык аминокислот.
Генетический код обладает рядом особенностей:
1. Универсальность: «кодовые слова» для каждой аминокислоты одинаковы
у всех организмов от вируса до человека.
2. Однонаправленность, линейность – кодоны мРНК «читаются» последовательно с фиксированной стартовой точки.
3. Неперекрываемость: один и тот же нуклеотид не может одновременно входить в два соседние кодона (ААГЦАГЦЦАУУЦ).
4. Непрерывность: в последовательности нуклеотидов отсутствуют такие, которые не входят