Содержание
Введение
Глава I. Обзор литературы
1.1 Лимфоциты
1.2 Дезоксирибонуклеазы секреторных гранул лимфоцитов периферической крови пациентов с АБА
1.3 Методы выделения и изучения лимфоцитов
1.4 Заключение по обзору литературы
1.5 Цели и задачи
Глава II. Материалы и методы
Глава III. Результаты и их обсуждение
Выводы
Список литературы
Введение
Недавние сообщения [1,2] подчеркивают роль апоптоза, аутоиммунитета и Т-лимфоцитов, как потенциально важных факторов в патогенезе хронических обструктивных заболеваниях легких и, в частности, Т-опосредованного иммунного ответа при астме.
Лимфоциты являются ключевым звеном иммунной системы и участвуют почти во всех иммунных и аутоиммунных реакциях, очень важна их роль при аллергических реакциях [3]. Обычно при изучении и оценке иммунного состояния организма, а также исследовании молекулярных механизмов, по которым протекают многие заболевания, главным объектом изучения являются лимфоциты.
Поэтому очень важным этапом в проведении таких исследований является получение чистых и жизнеспособных популяций лимфоцитов.
Глава I. Обзор литературы
Лимфоциты
Лимфоциты - клетки иммунной системы, представляющие собой разновидность лейкоцитов группы агранулоцитов, белых кровяных клеток. Лимфоциты - главные клетки иммунной системы, обеспечивают гуморальный иммунитет (выработка антител), клеточный иммунитет (контактное взаимодействие с клетками-жертвами), а также регулируют деятельность клеток других типов. В крови взрослого человека в норме содержится 20-35 % лимфоцитов (1000-3000 кл/мкл). В то же время кровь содержит только около 2 % лимфоцитов, находящихся в организме, остальные 98% находятся в тканях. Лимфоциты обладают уникальным свойством - способностью распознавать антигены. Лимфоциты образуются в лимфатических узлах, миндалинах, червеобразном отростке, селезенке, вилочковой железе (тимусе) и костном мозге. Большинство покоящихся лимфоцитов представляют собой малые лимфоциты - небольшие клетки с темным ядром, что обусловлено конденсацией хроматина и сравнительно небольшим количеством цитоплазмы, содержащей разрозненные митохондрии. По морфологическим признакам выделяют два типов лимфоцитов: большие гранулярные лимфоциты (чаще всего ими являются NK-клетки или, значительно реже, это активно делящиеся клетки лимфоидного ряда - лимфобласты и иммунобласты) и малые лимфоциты (T и B клетки) [4].
По функциональным признакам различают три типа лимфоцитов: B-клетки, T-клетки, NK-клетки.
· В-лимфоциты распознают чужеродные структуры (антигены) вырабатывая при этом специфические антитела (белковые молекулы, направленные против чужеродных структур).
секреторная гранула лимфоцит иммунная
· Т-лимфоциты выполняют функцию регуляции иммунитета. Т-помощники стимулируют выработку антител, а Т-супрессоры тормозят ее.
· NK-лимфоциты осуществляют контроль над качеством клеток организма. При этом NK-лимфоциты способны разрушать клетки, которые по своим свойствам отличаются от нормальных клеток, например, раковые клетки. Содержание Т-лимфоцитов в крови составляет 65-80 % от общего количества лимфоцитов, В-лимфоцитов - 8-20 %, NK-лимфоцитов - 5-20 %. В образовании антител центральная роль принадлежит B-лимфоцитам. При этом B-лимфоциты обеспечивают специфический приобретенный иммунитет совместно с другими малыми лимфоцитами - T-лимфоцитами, используя разнообразные механизмы, направленные в большинстве случаев на расширение пределов эффективности врожденного иммунитета.
Лимфоциты класса T образуются в зобной железе, или тимусе, откуда они и получили свое обозначение - "T": предшественники T-лимфоцитов поступают в тимус, где и происходит их созревание. T-лимфоциты подразделяются на ряд подклассов. Главные из них это две различные, неперекрывающиеся субпопуляции: клетки одной из них несут маркер CD4 и в основном "помогают" в осуществлении иммунного ответа или индуцируют его (T-хелперы), клетки другой несут маркер CD8 и обладают преимущественно цитотоксической активностью (цитотоксические T-лимфоциты (T-киллеры).
Методы выделения и изучения лимфоцитов
Ультрацентрифуга
Ультрацентрифуги - наиболее узкоспециализированный тип приборов, служащий главным образом для исследовательских задач, седиментации вирусов, выделении субклеточных структур, белков и других высокомолекулярных соединений, нуклеиновых кислот и, в целом, разделения частиц размером 100 нм и менее. Принцип работы ультрацентрифуги аналогичен остальным лабораторным центрифугам, но по своим техническим параметрам они значительно превосходят все лабораторные модели. Они способны достигать скорости 150 000 об/мин и ускорения свыше 1 000 000g. Кроме угловых и бакетных роторов, центрифуги могут оснащаться проточными или зональными роторами с одной большой внутренней полостью для разделяемой жидкости. По исполнению ультрацентрифуги могут быть как настольными, так и напольными. Производятся приборы данного класса компаниями Beckman Coulter и Thermo Scientific.
Мы использовали ультрацентрифугу компании Beckman Coulter OptimaTM L-series.
Напольные ультрацентрифуги серии Optima L способны работать на скорости 100 000 об/мин (L-100K) с ускорением до 694000×g/802000×g (табл.1). Центрифуги комплектуются огромным рядом угловых и горизонтальных роторов, снабжены надёжным вакуумированным индукционным приводом, системой управления и контроля на базе микропроцессора и безопасной для окружающей среды системой охлаждения, в которой не используются фторированные углеводороды или другие жидкие хладагенты, встроенной системой коррекции дисбаланса ротора до 10%. Серия Optima L в полной мере соответствует установленным требованиям при работы с биологически опасными материалами, имеются соответствующие сертификаты на биобезопасность на нескольких уровнях. Центрифуги подключаются к сети 220В, что позволяет размещать их в любом удобном месте. [6]
Таблица 1. Технические характеристики ультрацентрифуг серии Optima L
| Диапазон скоростей
| Optima L-90K: 1 000 - 90 000 об/мин, с шагом 100 об/мин Optima L-100K: 1 000 - 100 000 об/мин, с шагом 100 об/мин
|
| Контроль скорости
| ± 20 об/мин
|
| Максимальное ускорение
| Optima L-90K: 694000×g Optima L-100K: 802 000 × g
|
| Вместимость
| 1 500 мл
|
| Объём образца в одной ячейке
| от 230 мкл до 250 мл
|
| Режимы работы
| По таймеру до 99 часов 59 минут в режим HOLD w2t
|
| Установка температуры
| 0°. +40°C, с шагом 0.1°С
|
| Контроль температуры
| ± 0,5°C от установленного значения
|
| Контроль дисбаланса
| ±5 мл или 10% при объёме менее 5 мл
|
| Температура окружающей среды
| +15°. +40°C
|
| Система охлаждения
| Используется экологически безопасный хладогент
|
| Профили ускорения
| - быстрый: от 0 об/мин до заданной скорости; медленный: от 0 до 500 об/мин, далее быстрый разгон до установленной скорости
|
| Профили торможения
| - динамическое торможение; медленное (до 500 об/мин быстрое торможение, далее медленная остановка; без торможения
|
| Программы
| 9 программ, устанавливаемых пользователем, возможность отложенного старта
|
| Система уменьшения трения
| да
|
| Тепловыделение
| 1 кВт
|
| Уровень шума
| менее 57 дБ
|
| Внешние габариты
| В: 1207 × Г: 673 × Ш: 940 мм
|
| Вес
| 465 кг
|
| Требования к электросети
| 220-240 В,20 А, 50 Гц (однофазный ток)
|
Электрофорез
Электрофорез (от электро - и греч. рhoresis - несение, перенесение) - метод анализа, основанный на способности заряженных частиц к передвижению во внешнем электрическом поле. Передвижение частиц при электрофорезе зависит от ряда факторов, основными из которых являются: напряженность электрического поля, величина электрического заряда, скорость и размер частицы, вязкость, рН и температура среды, а также продолжительность электрофореза [8].
Физический принцип метода заключается в следующем: биологические макромолекулы несут определённый электрический заряд благодаря наличию групп, способных к электролитической диссоциации и концентрации протонов в среде (рН). Под действием электрического поля, в зависимости от знака суммарного заряда положительно заряженные макромолекулы перемещаются к катоду (отрицательно заряженному электроду), а отрицательно заряженные - к аноду (положительному электроду), причём трение об окружающую среду ограничивает скорость миграции. Такое явление носит название электрофореза. Электрическое поле создают в токопроводящих растворах с помощью электродов. [2]
Факторами, обусловливающими подвижность биополимеров в геле, являются: суммарный заряд, масса, форма, линейные размеры макромолекулы и пор геля.
Основой электрофоретического разделения является разная скорость движения заряженных молекул в электрическом поле. Подвижность возрастает с увеличением суммарного заряда. Постепенно исходный препарат, состоявший из различных молекул, разделяется на зоны одинаковых молекул, мигрирующих с одинаковой скоростью. Со временем эти зоны распределяются по длине дорожки.
С другой стороны, разделяемые молекулы движутся в геле. Природа любого геля - ситоподобная структура, в которой молекулы воды удерживаются внутри трехмерной сетки, образованной длинными полимерными молекулами. Используемые гели содержат много жидкости (80-99.5%), в которой (т.е. в рабочем буфере) мигрируют макромолекулы. Фракционируемые макромолекулы любых размеров сталкиваются с нитями полимера, образующего сетку геля, что увеличивает эффективное трение о среду и снижает скорость движения молекул: чем крупнее молекулы, тем меньше их подвижность. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к месту нанесения, чем меньшие (в агарозном, крахмальном и полиакри-ламидном гелях).
Электрофорез ДНК. В основе разделения нуклеиновых кислот электрофорезом в агарозном геле лежит принцип молекулярного сита, так как нуклеиновые кислоты имеют отрицательный суммарный электрический заряд, обусловленный диссоциацией остатков фосфорной кислоты. Величина заряда мало зависит от рН окружающей среды и для всех нуклеиновых кислот отношение заряда к массе практически одинаково, поэтому фракционирование их при электрофорезе идёт за счёт различия размеров и формы молекул. Скорость миграции и эффективность разделения различных образцов нуклеиновых кислот в агарозном геле определяется размером молекул и их конформацией, концентрацией агарозы, напряжённостью электрического поля [8].
ДНК: молекулярная масса измеряется в парах азотистых оснований (base-pairs, англ.), сокращенно - bp, соответственно - килоbp (1000 bр) или кbр.
Молекулы одинакового размера, но различной формы, например фибриллярные и глобулярные белки, обладают разной подвижностью из-за различий в силе трения и электростатического взаимодействия с окружающей средой.
Буфер создает и стабилизирует рН носителя и, тем самым, влияет на скорость миграции разделяемых веществ. С ростом рН ионизация органических кислот возрастает, а оснований, наоборот, уменьшается, и, следовательно, меняется их электрофоретическая подвижность. Оптимальное значение рН рабочего буфера обусловливает не максимальный заряд, а максимальное различие зарядов разных белков исходной смеси.
Рабочие значения напряжения и тока подбирают не только с учетом обеспечения теплоотвода, как для белков, но и с таким расчетом, чтобы напряженность электрического поля в геле не превышала 5 В/см геля. При больших значениях напряженности поля крупные молекулы нуклеиновых кислот могут, деформируясь, "протискиваться" через поры геля независимо от своей массы. Видно, что проведение электрофореза при высоком напряжении эквивалентно уменьшению длины геля и область эффективного разделения ДНК в агарозном геле снижается.
Особенности электрофореза белков. Белки - это цвиттер-ионы, т.е. молекулы, имеющие и положительно (+) заряженные и отрицательно (-) заряженные радикалы. Поэтому молекула белка в растворе при любом рН, отличным от изоэлектрической точки, имеет определенный преобладающий заряд (+) или (-) и мигрирует к соответствующему полюсу в постоянном электрическом поле. Позднее был разработан метод ступенчатого электрофореза (диск - электрофорез (от англ. "discontinuous" - прерывистый). Отличительная особенность диск-электрофореза - это полимеризация на пластине двух гелей: рабочего (мелкопористого) и над ним - "формирующего" (крупнопористого) геля. Диск-электрофорез - метод, сочетающий в себе разделение белков по их общему электрическому заряду, по величине молекулярной массы и по форме. Использование двухслойного носителя с различным размером пор и двух буферов, отличающихся между собой по составу и рН, обеспечивает концентрирование исследуемых белков в узкой стартовой зоне. Это важно для чёткого разделения смеси белков.
Раствор, в котором мигрируют белки, удерживается сеткой полиакриламидного геля (ПААГ). ПААГ служит при электрофорезе поддерживающей средой и принимает активное участие в процессе разделения макромолекул благодаря эффекту молекулярного сита.
В качестве носителя при диск-электрофорезе используют ПААГ, который имеет структуру трехмерной сетки. Получают его сополимеризацией акриламида и сшивающего агента N,N¢- метиленбисакриламида. Подбирая соответствующую концентрацию акриламида получают гель с нужным размером пор. При работе с глобулярными белками пользуются соотношением между средней молекулярной массой белков (М) и концентрацией (С) акриламида, которую надо взять для полимеризации, например (см. табл.2):
Таблица 2. Выбор концентрации акриламида в зависимости от мол. массы белка
| М
| С, %
|
| 10000 - 30000
| 15,0 - 30,0
|
| 30000 - 100000
| 7,5 - 15,0
|
В качестве катализаторов при получении ПААГ - геля используют персульфат аммония и N,N,N¢,N¢-тетраметилэтилендиамин (ТЕМЕД). Варьируя концентрацией полимера можно получить гели с широким диапазоном пор.
Для удобства изложения используются следующие обозначения: Т - процентное отношение суммарной массы обоих мономеров к объему их раствора, С - процентное отношение массы метиленбисакриламида (Бис) к общей массе обоих мономеров.
На практике для исследования белков часто Т составляет 30 %, а С-2,6 %. Чтобы приготовить растворы используют следующий расчет:
Количество Бис → Т ´ С / 100 = 30´2,6/100=0,76г.
Количество акриламида → 30 г - 0,76 г =29,24 г.
Навески акриламида и бис-акриламида растворяют в 100 мл дН2О.
Характеристика миграции белков. Электрофоретическая подвижность биополимеров в геле (Rf′) пропорциональна их подвижности в свободной жидкости (RfO), которая определяется отношением суммарного заряда макромолекулы к её массе. Фактором, обуславливающим отличие Rf ′ от RfO, является сила трения о гель. Сила трения зависит от соотношения линейных размеров белков и пор геля, и, следовательно, от молекулярных масс белков. Молекулярные массы большинства белков не превышают 500000, поэтому использование гелей агарозы не целесообразно. Как правило, электрофорез белков проводят в ПААГ, содержащем от 5% до 20 % акриламида.
Как говорилось выше, белки являются цвиттер-ионами. Их суммарным зарядом, а, следовательно, и отношением заряда к массе можно управлять изменением рН буфера, в котором полимеризуется ПААГ и ведется электрофорез. Оптимальное значение рН рабочего буфера обуславливает не максимальный заряд, а максимальное различие зарядов разных белков, составляющих смесь. Таким образом, рН рабочего буфера не должно слишком отличаться от изоэлектрических точек всех белков смеси (при изоэлектрической точке все белки имеют нейтральный заряд). Для кислых белков оптимальные значения рН - нейтральное или слабощелочное. Белки мигрируют от катода (-) к аноду (+). Для щелочных белков (гистонов, белков рибосом и т.д.) целесообразно использовать слабокислые буферы (рН = 4 - 5). Эти белки различаются по величине суммарного положительного заряда и мигрируют в направлении от анода (+) к катоду (-). Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда.
Для однозначного определения молекулярной массы белка по скорости его миграции при электрофорезе полипептидную цепочку распрямляют (рис.1). Такой приём используется при электрофорезе белков, обработанных додецилсульфатом натрия (ДСН - C12H25OSO3Na).
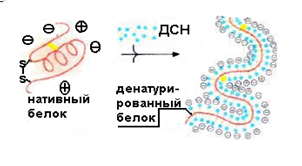
Рис. 1. Схема денатурации белка
Разделение белков по размеру с использованием додецилсульфата натрия (ДСН). Суть метода. Электрофорез в ПААГ-ДСН позволяет фракционировать белки только по молекулярной массе. Для этого белки обрабатывают трёхкратным избытком ДСН-Na (1,4 мг ДСН-Na на 1 мг белка). Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Постоянство соотношения детергент/белок делает постоянным отношение (-) заряда к массе любого белка. Благодаря электрическому отталкиванию остатков серной кислоты на поверхности белка полипептидная цепочка распрямляется и приобретает форму жёсткого эллипсоида вращения (рис.2).
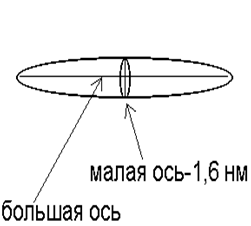
Рис. 2. Схематичное изображение полипептидной цепочки после добавления ДСН
Размер малой оси эллипсоида равен 1,6 нм, большой - линейно связан с числом аминокислотных остатков, т.е. с молекулярной массой.
Электрофоретическая подвижность (Rf′) связана с молекулярной массой белка (М) соотношением: Rf′ = A - B lg M, где А и В - коэффициенты пористости геля и др. условий.
Величину электрофоретической подвижности (Rf) определяют в относительных единицах, выражающих отношение пути миграции белка к миграции бромфенолового синего за время электрофореза.
Одновременно проводят электрофорез белков-"маркёров", молекулярные массы которых известны. [9]
Заключение по обзору литературы
Итак, многолетние исследования показывают, что ДНКазы представляют собой лабильную систему, чутко реагирующую на различные прямые и опосредованные воздействия.
ДНКазы важны не только в процессах нуклеинового обмена, но и для поддержания физиологической концентрации ДНК в организме человека. Например, повышение концентрации ДНК в крови может привести к накоплению ДНК-белковых комплексов, индукции наработки анти-ДНК антител и развитию различного рода патологий. Развитие аутоиммунных заболеваний также связывают с изменением активности нуклеаз иммунокомпетентных клеток.
Идентификация новых нуклеаз, в том числе апоптотических, должна проложить путь для дальнейших исследований по раскрытию новых функций нуклеаз и осветить скрытые связи между апоптотической деградацией ДНК и заболеваниями человека. [10]
Таким образом, объяснимо наше внимание к изучению свойств нуклеаз лимфоцитов, выделенных из периферической крови больных бронхиальной астмой.
Цели и задачи
В связи с изучением литературы по данному вопросу целью работы явилось освоение метода выделения секреторных гранул Т-лимфоцитов и характеристика их белкового состава методом электрофореза.
В соответствии с целью были поставлены следующие задачи:
. Освоить метод ультрацентрифугирования и работу на ультрацентрифуге Beckman Coulter OptimaTM L-series.
. Выделить фракцию Т-лимфоцитов низкоскоростным центрифугированием в градиенте плотности фиколла.
3. Выделить секреторные гранулы Т-лимфоцитов методом ультрацентрифугирования.
. Определить в секреторных гранулах наличие белковых фракций методом электрофореза.
Выводы
1. Освоен метод скоростного и равновесного центрифугирования.
. Освоена работа на ультрацентрифуге Beckman Optima TM L-series.
. Освоен метод выделения экстракта секреторных гранул Т-лимфоцитов.
. Освоен метод определения молекулярной массы белков и установлена молекулярная масса белков секреторных гранул Т-лимфоцитов: 66 069, 63 095, 50 108, 68 000, 60 255 Да.
Список литературы
1. Urboniene, D. Autoimmunity in pathogenesis of chronic obstructive pulmonary disease/ D. Urboniene, R. Sakalauskas, B. Sitkauskiene // Medicina (Kaunas). - 2005. - V.41, N.3. - P. 190-195.
. Kopinski, P. Apoptosis of alveolar lymphocytes in sarcoidosis and in control group is more frequentin smokers then in nonsmoking persons/ P. Kopinski, G. Przybylsk., B. Balicka-Slusarczyk et al // Przegl Lek. - 2006. - V.63. - P.841-847.
. vignola, a. m. Airway inflammation in mild intermittent and in persistent asthma/ a. m. vignola, p. chanez, a. m. campbell, et al. // am j respire crit care med. - 1998. - v.157. - p.403-409;
4. Ccылка на источник инет
5. Фармация Файн Кемиклз. Каталог продукции 1983. - С. - 71-76.
6. Ccылка на инет
. Остерман, Л.А. Методы изучения белков и нуклеиновых кислот: электрофорез и ультрацентрифугирование.
. Невзорова, Т.А. Физико-химические методы в биохимии. 2005 г
. Ссылка на зи
10. Parrish, J. Z. Cuts can kill: the roles of apoptotic nucleases in cell death and animal development / J. Z. Parrish, X. Deng // Chromosoma. - 2006. - V.115, № 2. - P.89-97.
11. Feucht, HE <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Feucht+HE%22%5BAuthor%5D>. Efficient separation of human T lymphocytes from venous blood using PVP-coated colloidal silica particles (percoll) /HE. Feucht <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Feucht+HE%22%5BAuthor%5D>, M. R. Hadam <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Hadam+MR%22%5BAuthor%5D>, F. Frank <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Frank+F%22%5BAuthor%5D>, G. Riethmuller <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Riethmuller+G%22%5BAuthor%5D>. // J Immunol Methods. <javascript:AL_get(this,%20'jour',%20'J%20Immunol%20Methods.');>. - 1980. - V.38. - P.43
. Boyum, A. Separation of leucocytes: improved cell purity by fine adjustments of gradient medium density and osmolality/ A. Boyum, D. Lovhaug, L. Trasland et al. // Scand. J. Immunol. - 1991. - V.34. - P.697-712.
13. Podack, E. R. Cytolytic T cell granules. Isolation, structural., biochemical and functional characterization/ E. R. Podack., P. J. Konigsberg // J. Exp. Med. - 1984. - V.1. - P.695-710
14. Kornberg, A. Supplement to DNA replication / A. Kornberg/ - San Francisco: W. H. Freeman & Co, 1982. - P.1-203.
. Pio, R. Granule associated DNase in T4 and T8 lymphocytes from patients with autoimmune diseases / R. Pio, A. Gonzalez, M. J. Lopez-Zabalza et al. // Biochimica et Biophysica Acta. - 1998. - V.1406. - P.51-61.
Содержание
Введение
Глава I. Обзор литературы
1.1 Лимфоциты
1.2 Дезоксирибонуклеазы секреторных гранул лимфоцитов периферической крови пациентов с АБА
1.3 Методы выделения и изучения лимфоцитов
1.4 Заключение по обзору литературы
1.5 Цели и задачи
Глава II. Материалы и методы
Глава III. Результаты и их обсуждение
Выводы
Список литературы
Введение
Недавние сообщения [1,2] подчеркивают роль апоптоза, аутоиммунитета и Т-лимфоцитов, как потенциально важных факторов в патогенезе хронических обструктивных заболеваниях легких и, в частности, Т-опосредованного иммунного ответа при астме.
Лимфоциты являются ключевым звеном иммунной системы и участвуют почти во всех иммунных и аутоиммунных реакциях, очень важна их роль при аллергических реакциях [3]. Обычно при изучении и оценке иммунного состояния организма, а также исследовании молекулярных механизмов, по которым протекают многие заболевания, главным объектом изучения являются лимфоциты.
Поэтому очень важным этапом в проведении таких исследований является получение чистых и жизнеспособных популяций лимфоцитов.
Глава I. Обзор литературы
Лимфоциты
Лимфоциты - клетки иммунной системы, представляющие собой разновидность лейкоцитов группы агранулоцитов, белых кровяных клеток. Лимфоциты - главные клетки иммунной системы, обеспечивают гуморальный иммунитет (выработка антител), клеточный иммунитет (контактное взаимодействие с клетками-жертвами), а также регулируют деятельность клеток других типов. В крови взрослого человека в норме содержится 20-35 % лимфоцитов (1000-3000 кл/мкл). В то же время кровь содержит только около 2 % лимфоцитов, находящихся в организме, остальные 98% находятся в тканях. Лимфоциты обладают уникальным свойством - способностью распознавать антигены. Лимфоциты образуются в лимфатических узлах, миндалинах, червеобразном отростке, селезенке, вилочковой железе (тимусе) и костном мозге. Большинство покоящихся лимфоцитов представляют собой малые лимфоциты - небольшие клетки с темным ядром, что обусловлено конденсацией хроматина и сравнительно небольшим количеством цитоплазмы, содержащей разрозненные митохондрии. По морфологическим признакам выделяют два типов лимфоцитов: большие гранулярные лимфоциты (чаще всего ими являются NK-клетки или, значительно реже, это активно делящиеся клетки лимфоидного ряда - лимфобласты и иммунобласты) и малые лимфоциты (T и B клетки) [4].
По функциональным признакам различают три типа лимфоцитов: B-клетки, T-клетки, NK-клетки.
· В-лимфоциты распознают чужеродные структуры (антигены) вырабатывая при этом специфические антитела (белковые молекулы, направленные против чужеродных структур).
секреторная гранула лимфоцит иммунная
· Т-лимфоциты выполняют функцию регуляции иммунитета. Т-помощники стимулируют выработку антител, а Т-супрессоры тормозят ее.
· NK-лимфоциты осуществляют контроль над качеством клеток организма. При этом NK-лимфоциты способны разрушать клетки, которые по своим свойствам отличаются от нормальных клеток, например, раковые клетки. Содержание Т-лимфоцитов в крови составляет 65-80 % от общего количества лимфоцитов, В-лимфоцитов - 8-20 %, NK-лимфоцитов - 5-20 %. В образовании антител центральная роль принадлежит B-лимфоцитам. При этом B-лимфоциты обеспечивают специфический приобретенный иммунитет совместно с другими малыми лимфоцитами - T-лимфоцитами, используя разнообразные механизмы, направленные в большинстве случаев на расширение пределов эффективности врожденного иммунитета.
Лимфоциты класса T образуются в зобной железе, или тимусе, откуда они и получили свое обозначение - "T": предшественники T-лимфоцитов поступают в тимус, где и происходит их созревание. T-лимфоциты подразделяются на ряд подклассов. Главные из них это две различные, неперекрывающиеся субпопуляции: клетки одной из них несут маркер CD4 и в основном "помогают" в осуществлении иммунного ответа или индуцируют его (T-хелперы), клетки другой несут маркер CD8 и обладают преимущественно цитотоксической активностью (цитотоксические T-лимфоциты (T-киллеры).
Дезоксирибонуклеазы секреторных гранул лимфоцитов периферической крови пациентов с АБА
Изучение нуклеазного состава гранул лимфоцитов связано с ролью этих нуклеаз в развитии заболеваний, характеризующихся нарушениями в иммунном ответе. Иммунная система атакует аутологические ткани, приводя к глубоким изменениям. В этом случае ткани инфильтрируются Т-лимфоцитами, некоторых из них с цитотоксической активностью (цитотоксические Т-лимфоциты; ЦТЛ), что приводит к Т-опосредованному аутоиммунному заболеванию.
Лимфоцит-опосредованный цитолиз связывают с работой специфической нуклеазной активностью цитотоксических клеток [7]. Это кислая ДНКаза с молекулярной массой 66 кДа активируется ионами Ca2+ и ингибируется Zn2+, специфична к ДНК. У больных рассеянным склерозом данная нуклеазная активность повышается и становится чувствительной к оксиду азота, но теряет чувствительность ионам цинка.
Некоторые моменты при развитии астмы и орган-специфических аутоиммунных заболеваний (например, инфильтрация лимфоцитов в очаге заболевания) подвели нас к поиску и изучению нуклеазной активности секреторных гранул лимфоцитов крови пациентов с АБА.







