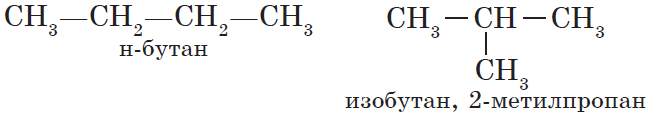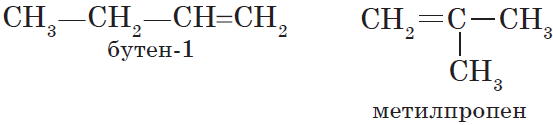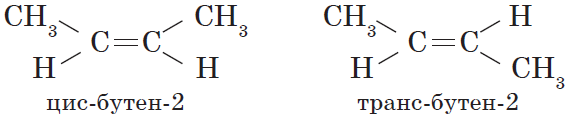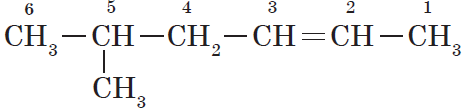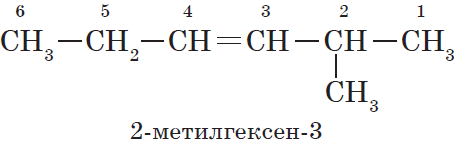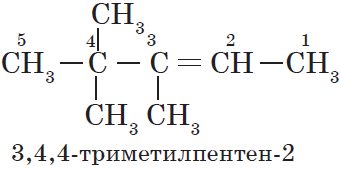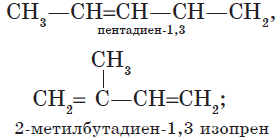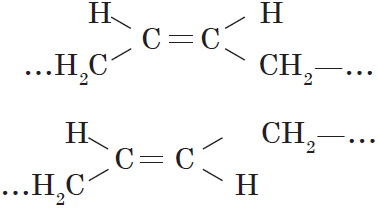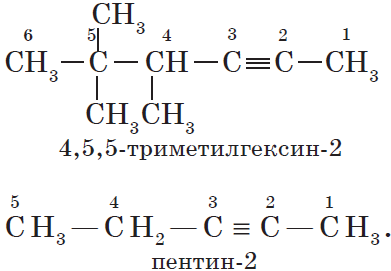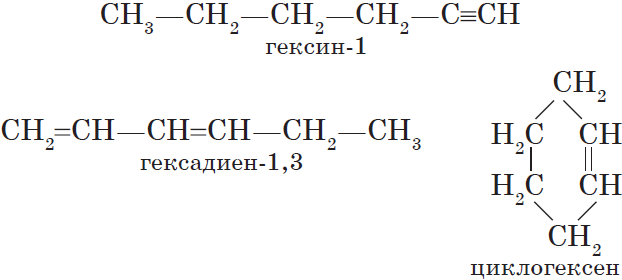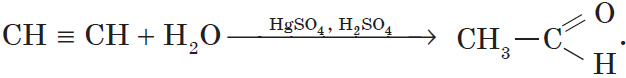Характерные химические свойства углеводородов. Механизмы реакций
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле СnН2n+2.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
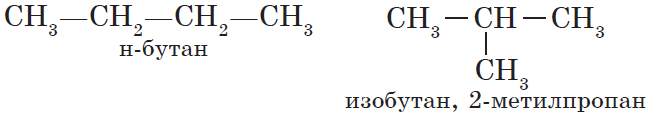
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—СН3), затем пропил (—СН2—СН2—СН3), этил (—СН2—СН3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2.2−). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
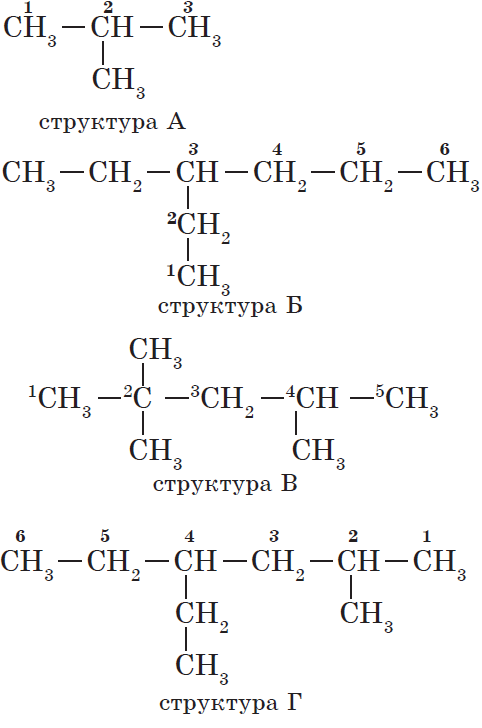
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: 2 -метилпропан;
— структура Б: 3 -этилгексан;
— структура В: 2,2,4 -триметилпентан;
— структура Г: 2 -метил 4 -этилгексан.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
CH4+Cl2→CH3Cl+HCl.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
CH3Cl+Cl2→HCl+
| CH2Cl2
|
| дихлорметан(хлористый метилен)
|
,
CH2Cl2+Cl2→HCl+
| CHСl3
|
| трихлорметан(хлороформ)
|
,
CHCl3+Cl2→HCl+
| CCl4
|
| тетрахлорметан(четыреххлористый углерод)
|
.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором (Pt,Ni,Al2O3,Cr2O3) при высокой температуре (400–600°С) происходит отщепление молекулы водорода и образование алкена:
CH3—CН3→СH2=CH2+Н2↑
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
СН4+2О2→СО2+2Н2O+880кДж.
В общем виде реакцию горения алканов можно записать следующим образом:
CnH2n+2+(
)O2→nCO2+(n+1)H2O
Термическое расщепление углеводородов:
CnH2n+2
Cn−kH2(n−k)+2+CkH2k
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
R—CH2CH2:CH2—R→R—CH2CH2·+·CH2—R.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
R—CH2CH2·+·CH2—R→R—CH=CH2+CH3—R.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры 1000°С начинается пиролиз метана — разложение на простые вещества:
CH4
C+2H2↑
При нагревании до температуры 1500°С возможно образование ацетилена:
2CH4
CH=CH+3H2↑
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:

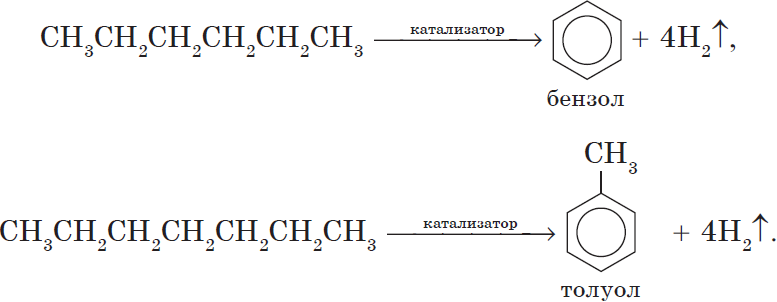
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н(углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленныеалкены составляют гомологический ряд этена (этилена):
С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
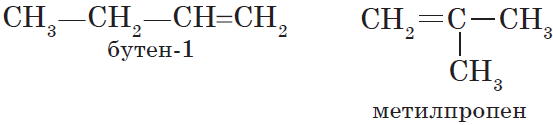
Особым видом структурной изомерии является изомерия положения двойной связи:
СН3—
—СН=СН2 СН3—
—СН3
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
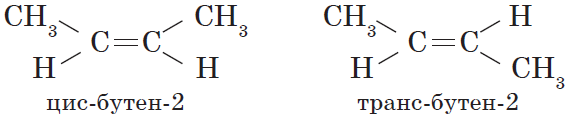
Цис- изомеры отличаются от транс- изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π-связи, а следовательно, и свойствами.
Алкеныизомерныциклоалканам (межклассовая изомерия), например:

Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
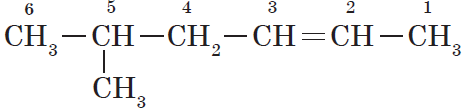
5-метилгексен-2, а не 2-метилгексен-4, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
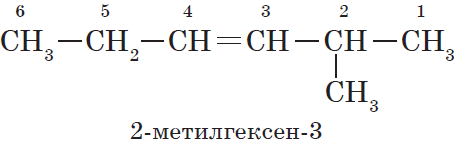
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
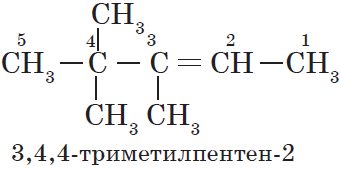
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
CH3—CH2—CH=CH2+H2
CH3—CH2—CH2—CH3.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (CCl4) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов:
СН2=СН2+Br2→CH2Br—CH2Br.
3. Гидрогалогенирование (присоединение галогеноводорода).
CH3−
=CH2+HBr→CH3−
−CH3
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
=CH2+H2O
CH3−
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.

Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
nCH2
CH2
(...
...)n
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
СН2=СН2+3О2→2СО2↑+2Н2О.
В общем виде:
CnH2n+
O2→nCO2↑+nH2O
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:

Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
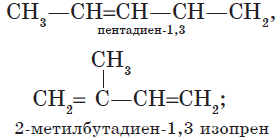
— изомерия положения кратных связей:
| CH2=CH—CH=CH2
|
| бутадиен−1,3
|
| CH2=C=CH—CH3
|
| бутадиен−1,2
|
Цис-, транс- изомерия (пространственная и геометрическая)
Например:

Алкадиеныизомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:

Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.

Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
nCH2=
→
| (...—CH2—CH=CH—CH2—...)n
|
| синтетический бутадиеновый каучук
|
.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс- конфигурацию.
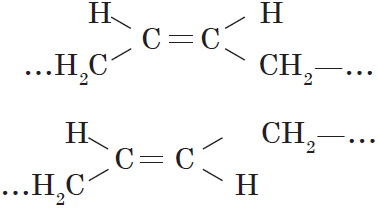
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СnН2n−2.
Гомологический ряд этина
Неразветвленныеалкины составляют гомологический ряд этина (ацетилена):
С2Н2 — этин, С3Н4 — пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейшийалкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
СН3—
—С≡СН СН3—
—СН3
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:

Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
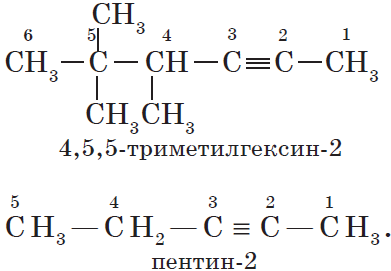
Алкинамизомерны соединения некоторых других классов. Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
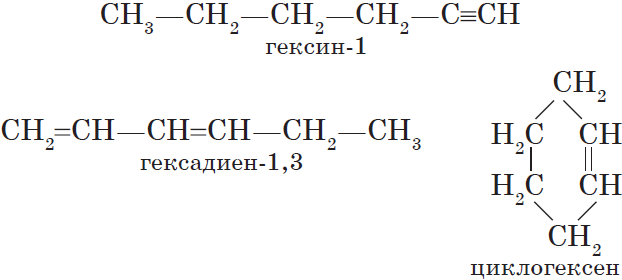
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкинспособен присоединить две молекулы галогена (хлора, брома):
CH≡CH+Br2→
,
CHBr=CHBr+Br2→
| CHBr2−CHBr2
|
| 1,1,2,2−тетрабромэтан
|
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
CH3−C≡CH+Br→
,
CH3−CBr=CH2+HBr→
| CH3−CHBr2−CH3
|
| 2,2−дибромпропан
|
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
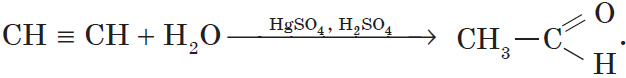
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов (Pt,Pd,Ni):
R−C≡C−R+H2
R−CH=CH−R,
R−CH=CH−R+H2
R−CH2−CH2−R
Так как тройная связь содержит две реакционноспособные π-связи, алканы присоединяют водород ступенчато:
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:

2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
2HC≡CH→
| HC≡C−CH=CH2
|
| бутен-1-ин-3(винилацетилен)
|
Это вещество используется для получения хлоропрена:
HC≡C−CH=CH2+HCl
H2C=
=CH2
полимеризацией которого получают хлоропреновый каучук:
nH2C=CCl−CH=CH2→(...−H2C−CCl=CH−CH2−...)n
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
2C2H2+5O2→4CO2↑+2H2O+2600кДж На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000°С), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Ионный (правило В. В. Марковникова) и радикальный механизмы реакции в органической химии
Реакции замещения
Реакции присоединения
Правило В. В. Марковникова
Отличительной чертой алкенов (непредельных углеводородов) является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
Гидрогалогенирование (присоединение галогеноводо рода):
СH3
CH2+HBr→CH3
Эта реакция подчиняется правилу В. В. Марковникова: при присоединении галогенводорода к алкену водород присоединяется к более гидрированномуатому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
·
·
·
·
·
Характерные химические свойства углеводородов. Механизмы реакций