Анионы II аналитической группы образуют с катионом Ag+ соли, нерастворимые в воде и разбавленной азотной кислоте. Групповым реагентом на анионы II группы является нитрат серебра AgNO3 в присутствии азотной кислоты. Хлорид бария с анионами II группы осадков не образует.
Реакции анионов С l -.
Реакция с нитратом серебра AgN O 3:
NaCl + AgNO3 = AgCl↓ + NaNO3 (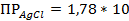 -10);
-10);
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + HCl = AgCl↓ + 2NH4Cl
Наблюдается образование белого творожистого осадка AgCl, который на свету постепенно темнеет вследствие фотохимического выделения микрокристаллов свободного Ag. Осадок AgCl не растворяется в кислотах, но легко растворим в избытке гидроксида аммония с образованием комплексного катиона [Ag(NH3)2]+. Полученный комплексный катион легко разрушается при подкислении с выделением осадка AgCl.
Действие окислителей:
10КСl + 2KMnO4 + 8H2SO4 = 5Сl2↑ + 2MnSO4 + 6K2SO4 + 8Н2O
Более сильные окислители по сравнению с Сl2 (например, КМnO4 и РbO2) окисляют хлориды до свободного хлора. Так, при действии КМnO4 на хлориды в кислой среде наблюдается обесцвечивание раствора КМnO4 и появление резкого запаха газообразного хлора. Для подтверждения выделения газообразного хлора используют иодид-крахмальную бумагу. В присутствии хлора она окрашивается в синий цвет (реакция йода с крахмалом).
Реакции анионов В r -.
Реакция с нитратом серебра AgN O 3:
KBr + AgNO3 = AgBr↓ + KNO3 (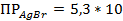 -13);
-13);
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
Наблюдается образование желтоватого творожистого осадка AgBr. Осадок не растворим в азотной кислоте, плохо растворим в аммиаке, хорошо растворим в тиосульфате натрия.
Действие окислителей:
2KBr + Сl2 = 2КСl + Вr2↑
Более сильные, чем Вr2, окислители: КМnO4, РbO2, КСlO3, МnO2, Сl2 окисляют бромиды до свободного брома. При действии хлорной воды на растворы, содержащие бромид-ион, наблюдается желтое окрашивание. Для увеличения чувствительности реакции добавить несколько капель несмешивающегося с водой растворителя (толуол, хлороформ и т.п.) и встряхнуть. В присутствии Вr2 слой растворителя окрашивается в желто-оранжевый цвет.
Реакции анионов I -.
Реакция с нитратом серебра AgN O 3:
NaI + AgNO3 = AgI↓ + NaNO3 ( -17).
-17).
Наблюдается образование желтого осадка AgI, не растворимого в HNO3, NH4OH и слабо растворимого в Na2S2O3.
Действие окислителей:
2KI + Сl2 = 2КСl + I2↓;
2KI + Br2 = 2KBr + I2↓;
10KI + 2KMnO4 + 8H2SO4 = 5I2↓ + 2MnSO4 + 6K2SO4 + 8H2O.
Выделяется свободный йод. Чувствительность реакции повышается при выполнении реакции в присутствии несмешивающихся с водой органических растворителей. В этом случае слой органического растворителя окрашивается в характерный фиолетовый цвет.
Реакция с нитратом свинца Pb(N O 3)2:
2NaI + Pb(NO3)2 = PbI2↓ + 2NaNO3
Наблюдается образование желтого осадка PbI2, который легко растворяется при нагревании. После медленного охлаждения этого раствора появляются крупные блестящие золотистые кристаллы.
Реакции анионов S2-.
Реакция с нитратом серебра AgN O 3:
Na2S + 2AgNO3 = Ag2S↓ + 2NaNO3
Образуется черный осадок Ag2S.
Действие кислот:
Na2S + H2SO4 = H2S↑ + Na2SO4
При подкислении сульфидов выделяется газообразный сероводород H2S с характерным резким запахом тухлых яиц. Если накрыть пробирку фильтровальной бумагой, смоченной раствором соли свинца, то при выделении сероводорода на бумаге появляется черное пятно PbS:
Pb(CH3COO)2 + H2S = PbS↓ + 2СН3СООН
Реакция с солями кадмия Cd(N O 3)2:
Na2S + Cd(NO3)2 = CdS↓ + 2NaNO3
Наблюдается образование канареечно-желтого осадка CdS.
Реакция с нитропруссидом натрия Na2[Fe(CN)5NO]:
Na2S + Na2[Fe(CN)5NO] = Na4[Fe(CN)5NOS]
Раствор окрашивается в характерный красно-фиолетовый цвет. В кислой среде окрашивание исчезает.
Реакция с окислителями:
5H2S + 2КМnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8H2O
Наблюдается обесцвечивание раствора КМnO4 и его помутнение вследствие образования свободной серы.
Реакции тиоцианат-иона (роданид-иона) SCN-.
Реакция с нитратом серебра AgN O 3:
SCN- + Ag+ = AgSCN↓
Образуется белый творожистый осадок тиоцианата серебра AgCSN, нерастворимый в минеральных кислотах и в растворе карбоната аммония. Растворяется в водном аммиаке, в растворах тиосульфата натрия, цианида калия, при избытке тиоцианат-ионов с образованием соответствующих растворимых комплексов серебра:
AgSCN + 2NH3 = [Ag(NH3)2]+ + SCN-
AgSCN + nS2O32- = [Ag(S2O3) n ]1-2 n + SCN- (n = 2 и 3)
AgSCN+ 2CN- = [Ag(CN)2]- +SCN-
AgSCN + (n -1)SCN- -= [Ag(SCN) n ]1- n (n = 3 и 4)
Реакция с солями кобальта(II):
4SCN- +Со2+ ⇄ [Co(SCN)4]2-
Образуются синие тетратиоцианатокобальтат(II)-ионы, окрашивающие раствор в синий цвет. Однако эти комплексы недостаточно прочны, при не очень большом избытке ионов SCN- равновесие смещено влево и раствор окрашивается не в синий, а в розовый цвет (окраска аквокомплексов кобальта(II)). Для смещения равновесия вправо реакцию проводят в водно-ацетоновой среде или же экстрагируют комплекс органическими растворителями, в которых он растворяется лучше, чем в воде (например, в смеси изоамилового спирта и диэтилового эфира).
Реакция с солями железа(III):
В кислой (для подавления гидролиза железа(III)) среде образуются тиоцианатные комплексы железа(III) красного цвета состава [Fe(SCN) n (H2O)6- n ]3- n, где n = 1, 2, …, 6. Все комплексы железа(III) с разным содержанием тиоцианатогрупп окрашены в красный цвет и в растворе находятся в равновесии друг с другом. При повышенных концентрациях ионов SCN- в растворе доминируют комплексы с большим значением n, при пониженных — с меньшим значением n. Образующиеся комплексы можно экстрагировать органическими растворителями — диэтиловым эфиром, амиловым спиртом и др.
Эту высокочувствительную реакцию можно проводить капельным методом на фильтровальной бумаге. Мешают различные анионы— S2-, SO32-, S2O32-, C2O42-, I-, NO2- и др.
Реакция с иодат-ионами:
5SCN- +6IO3- +Н+ +2H2O = 5SO42- +5HCN+3I2
В кислой среде тиоцианат-ионы окисляются иодат-ионами с выделением свободного иода.
Однако проведению этой реакции мешают анионы-восстановители, также реагирующие с иодат-ионами.



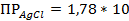 -10);
-10);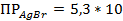 -13);
-13); -17).
-17).


