Групповым реагентом является хлорид бария в нейтральном или слабощелочном растворе. Анионы этой группы образуют малорастворимые в воде соли бария, но легко растворимые, за исключением сульфата бария, в минеральных кислотах. Соли серебра, за исключением сульфата серебра малорастворимы в воде, но растворимы в азотной кислоте.
Реакции анионов SO42-.
Реакция с хлоридом бария ВаС l 2:
Na2SO4 + ВаСl2 = BaSO4↓ + 2NaCl
Образуется белый кристаллический осадок BaSO4, не растворимый в кислотах и щелочах.
Реакция с солями кальция Ca(N O 3)2
Na2SO4 + Ca(NO3)2 = CaSO4↓ + 2NaNO3
проводится на предметном стекле микроскопа. В присутствии сульфат-иона образуются характерные кристаллы гипса CaSO4*2Н2O в виде игольчатых пучков.
Реакция с солями свинца, например Pb(N O 3)2:
Na2SO4 + Pb(NO3)2 = PbSO4↓ + 2NaNO3
Образуется белый осадок, растворимый в ацетате аммония.
Реакция с нитратом серебра AgNO 3:
Na2SO4 + 2AgNO3 = Ag2SO4↓ + 2NaNO3
В сильно концентрированных растворах образуется белый осадок сульфата серебра Ag2SO4, растворимый в азотной кислоте.
Реакции анионов SO 3 2-.
Реакция с хлоридом бария ВаС l 2:
Na2SO3 + ВаСl2 = BaSO3↓ + 2NaCl
Образуется белый осадок BaSO3, растворимый в кислотах.
Реакция с кислотами (на примере НС l):
Na2SO3 + 2НСl = H2SO3 + 2NaCl
H2SO3 = H2O + SO2↑
При действии кислот на сухие сульфиты появляется характерный резкий запах SO2 (горящей серы).
Реакция с окислителями:
а) с перманганатом калия
5Na2SO3 + 2КМnO4 + 8H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
Наблюдается обесцвечивание раствора перманганата калия;
б) с иодом
Na2SO3 + I2 + Н2O = Na2SO4 + 2HI
В присутствии ионов SO32- раствор иода обесцвечивается. Реакция становится более чувствительной, если ее проводить в присутствии крахмала.
Реакция с нитратом серебра AgNO 3:
Na2SO3 + 2AgNO3 = Ag2SO3↓ + 2NaNO3
Образуется белый осадок сульфита серебра Ag2SO3, растворимый в азотной кислоте.
Реакции анионов S2 O 3 2-.
Реакция с хлоридом бария ВаС l 2:
Na2S2O3 + ВаСl2 = BaS2O3↓ + 2NaCl
Образуется белый осадок BaS2O3. При проведении реакции возможно образование пересыщенных растворов. Поэтому для выпадения осадка необходимо потереть стенки пробирки стеклянной палочкой.
Реакция с кислотами (например, с НС l):
Na2S2O3 + 2НСl = Н2O + SO2↑ + Si + 2NaCl
В ходе реакции наблюдается помутнение раствора (выделение свободной серы) и образование сернистого газа с резким запахом. В разбавленных растворах реакция идет медленно: 2-10 мин.
Реакция с нитратом серебра AgN O 3:
Na2S2O3 + 2AgNO3 = Ag2S2O3↓ + 2NaNO3
Ag2S2O3 + H2O = Ag2S↓ + H2SO4
С избытком AgNO3 образуется белый осадок Ag2S2O3, постепенно желтеющий, а затем чернеющий в результате превращения тиосульфата серебра в сульфид Ag2S черного цвета.
Реакция с иодом:
Na2S2O3 + I2 = Na2S4O6 + 2NaI
Наблюдается обесцвечивание раствора иода. Для повышения чувствительности реакцию проводят в присутствии крахмала. Реакция применяется в количественном анализе.
Реакции анионов CO32-.
Реакция с хлоридом бария ВаС l 2:
Na2CO3 + ВаСl2 = ВаСО3↓ + 2NaCl
Образуется белый осадок ВаСО3, растворимый в кислотах.
Реакция с кислотами:
Na2CO3 + 2НСl = 2NaCl + Н2СО3;
Н2СО3 = Н2O + СO2↑;
СO2 + Са(ОН)2 = СаСO3 + Н2O.
Выделяются пузырьки СO2 (газ без цвета и запаха). Для обнаружения СO2 полученный газ пропускают через раствор известковой воды Са(ОН)2. При наличии СO2 наблюдается помутнение раствора. Следует иметь в виду, что помутнение может исчезнуть вследствие образования кислой соли:
СаСO3 + СO2 + Н2O = Са(НСO3)2
Реакция с нитратом серебра AgNO 3:
Na2CO3 + 2AgNO3 = Ag2CO3↓ + 2NaNO3
Образуется белый осадок карбоната серебра Ag2CO3, растворимый в кислотах.
Раздельное открытие карбонат-ионов и гидрокарбонат-ионов реакциями с катионами кальция и с аммиаком.
Если в растворе одновременно присутствуют карбонат-ионы СО32- и гидрокарбонат-ионы НСO3-, то каждый из этих анионов можно открыть раздельно. Для этого вначале к анализируемому раствору прибавляют избыток раствора хлорида кальция. При этом карбонат-анионы СО32- осаждаются в виде карбоната кальция СаСО3. Гидрокарбонат-анионы остаются в растворе, так как Са(НСO3)2 растворим в воде.
Осадок СаСO3 отделяют от раствора и к последнему прибавляют раствор аммиака. Гидрокарбонат-анионы с аммиаком и катионами кальция дают снова осадок карбоната кальция:
НСO3- + Са2+ + NH3 = СаСО3 + NH4+
Реакции анионов РО43-.
Реакция с хлоридом бария ВаС l 2:
Na2HPO4 + ВаСl2 = ВаНРO4↓ + 2NaCl
Образуется белый осадок гидрофосфата бария ВаНРO4, растворимый в кислотах (кроме серной).
Реакция с магнезиальной смесью:
Na2HPO4 + MgCl2 + NH4OH = MgNH4PO4↓ + 2NaCl + H2O
Наблюдается образование кристаллического белого осадка MgNH4PO4. Реакция используется для гравиметрического количественного определения фосфора.
Реакция с парамолибдатом аммония (N Н4)6Мо7 O 24:
7NaH2PO4 + 12(NH4)6Mo7O24 + 58HNO3 = 7(NH4)3[PMo12O40]↓ + 51NH4NO3 + 7NaNO3 + 36H2O
Образуется желтый мелкокристаллический осадок молибдофосфата аммония (NH4)3[PMo12O40]. Осадок растворяется в щелочах при нагревании. Аналогичные реакции дают анионы мышьяковой и кремниевой кислот. Анионы SO32-, S2- и др. могут восстановить шестивалентный молибден (МоO42-) до молибденовой сини (смесь соединений молибдена различных степеней окисления), раствор может окраситься в синий цвет. Поэтому реакционную смесь необходимо подкислить концентрированной азотной кислотой.
Реакции анионов С2 O 4 2-.
Реакция с хлоридом бария ВаС l 2:
С2O42- + Ва2+ = ВаС2O4↓
Образуется белый осадок оксалата бария, растворимый в минеральных кислотах, а при кипячении и в уксусной.
Реакция с нитратом серебра AgNO 3.
2Ag+ + С2O42- = Ag2C2O4
Образуется белый творожистый осадок оксалата серебра Ag2C2O4, растворимый в азотной кислоте, в концентрированном растворе аммиака. Действие раствора НСl на оксалат серебра приводит к образованию хлорида серебра:
Ag2C2O4 + 2НСl = 2AgCl + H2C2O4
Реакция с перманганатом калия КМ nO 4:
5С2O42- +2МnО4- +16Н+ = 10СO2 +2Мn2+ +8Н2O
Оксалат-ионы при взаимодействии с перманганатом калия КМnO4 в кислой среде при нагревании окисляются с выделением газообразного диоксида углерода СO2; раствор перманганата калия при этом обесцвечивается вследствие восстановления марганца(VII) до марганца(II).
Реакции борат-ионов В4 O 7 2- и BO2-:
Тетраборат-ион В4O72- — анион слабой двухосновной тетраборной кислоты Н2В4O7, которая в свободном (индивидуальном) состоянии неизвестна, но может существовать в растворах.
Метаборат-ион BO2- (часто называемый просто «борат-ионом») — анион (по составу) не существующей в растворах метаборной кислоты НВO2.
В водных растворах тетра-, орто- и метаборная кислоты находятся в равновесии:
Н2В4O7 +5Н2O ⇄ 4Н3ВO3 ⇄ 4НВO2 + 4Н2O
Реакция с хлоридом бария.
В4O72- + Ва2+ + ЗН2O = Ва(ВO2)2↓ + 2Н3ВO3
В водных растворах образуется белый кристаллический осадок метабората бария Ва(ВO2)2, растворимый в азотной и уксусной кислотах.
Окрашивание пламени горелки сложными эфирами борной кислоты (фармакопейный тест).
Борат-ионы или борная кислота образуют с этанолом С2Н5ОН в присутствии серной кислоты сложный этиловый эфир борной кислоты (С2Н5O)3В, который окрашивает пламя в зеленый цвет. Реакцию образования сложных эфиров борной кислоты можно описать схемой:
В4O72- +2Н+ +5Н2O = 4Н3ВO3
Н3ВO3 + 3С2Н5ОН = (C2HsO)3B +3Н2О
Аналогичные продукты реакции борная кислота и бораты дают с глицерином, метанолом и другими спиртами.
Реакция с куркумином (фармакопейная).
Борная кислота и бораты при взаимодействии с красителем куркумином в кислой среде образуют куркуминовый комплекс розового или темно-красного цвета (в зависимости от концентрации борной кислоты), который в щелочной или аммиачной среде изменяет окраску на зеленовато-черную или синевато-черную.
Краситель куркумин (желтого цвета) в растворах может существовать в двух таутомерных формах — кетонной и енольной, находящихся в равновесии:
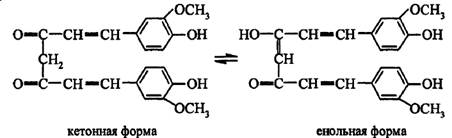
Щелочные растворы куркумина имеют красно-коричневый цвет, кислые — светло-желтый.
Некоторые исследователи полагают, что в реакции комплексообразования участвует енольная форма куркумина и образуется куркуминовый комплекс бора — розоцианин красного цвета:

Другие исследователи считают, что в реакцию образования красного куркуминового комплекса вступает кетонная таутомерная форма куркумина:

Реакцию проводят обычно с помощью куркумовой бумаги. Ее готовят, пропитывая белую плотную фильтровальную бумагу спиртовым раствором куркумина (спиртовой настойкой куркумы) и затем высушивая ее в защищенном от света месте в атмосфере, не содержащей паров кислот и аммиака.









