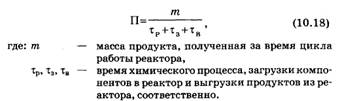Химико-технологический процесс – последовательные химические и химико-физические процессы переработки исходных веществ в продуктах производства.
ХТП состоит из нескольких стадий:
- Подготовка сырья и его хим.переработка для подготовки процесса
- Хим.превращение сырья в продукты реакции
- Выделение целевого продукта из реакционной смеси
Стадия 2 представляет собой чисто хим.процесс, 1 и 3 совокупность механических, физических и химических операций.
Для каждого из процессов есть свой технологический режим – это совокупность параметров, обеспечивающих устойчивое и мах эффективное протекание процесса.
Параметр тех.режима – величина, характеризующая устройство или режим работы аппарата и зависящее от типа процесса и конструкции аппарата.
Оптимальные условия достигаются сочетанием этих параметров, при которых достигается мах выход целевого продукта с высокой скоростью и низкой себестоимостью.
Стадии хим.превращений – это одна или несколько хим.реакции, сопротивление явлении масса и теплообмена. Процессы производства многостадийны, при этом каждая стадия требует своих параметров процесса, своего устройства и параметров оборудования, их совокупность дает технологическую схему хим.производства
Классификация ХТП
1) механические и гидромеханические – перемешивание материалов, изменение их формы и размеров, сжатие и расширение, смешение и разделение потоков; все они протекают без изменения химического и фазового состава обрабатываемого материала; для проведения этих процессов предназначены транспортеры, питатели, дробилки, диспергаторы, формователи, компрессоры, насосы, смесители, фильтры;
2) теплообменные – нагрев, охлаждение, изменение фазового состояния; химический состав веществ при этом не меняется; они протекают в теплообменниках, кипятильниках, конденсаторах, плавилках, сублиматорах;
3) массообменные – растворение, кристаллизация, сушка, дистилляция, ректификация, абсорбция, адсорбция, экстракция, десорбция; представляют собой перенос вещества внутри фазы или между фазами, вызванный градиентом его концентраций и протекающий без изменения химического состава; для данных процессов служат кристаллизаторы, сушилки, дистилляторы, ректификаторы, абсорберы, адсорберы, экстракторы, десорберы;
4) химические – процессы, связанные с изменением химического состава веществ; данные процессы проводятся в химических реакторах.
Кроме указанных основных процессов, в химико-технологическом процессе осуществляются также:
− энергетические процессы, которые заключаются во взаимном преобразовании различных видов энергии (тепловой, механической, электрической) в турбинах, генераторах, моторах;
− информационно-управляющие процессы, отвечающие за получение и передачу информации о состоянии потоков и веществ, выработку и передачу сигналов на пульт управления процессами; к информационно-управляющим устройствам относятся: датчики состояния потоков и оборудования (температуры, давления, состава, скорости вращения двигателей и т. д.), сигнальные и информационные системы, системы автоматического регулирования, включающие управляющие вычислительные машины и др.
Часто в каком-либо процессе имеют место одновременно два или более явления. В таких случаях процесс следует классифицировать по его основному назначению. Например, сжатие газа в компрессоре сопровождается его нагревом, но по основному назначению это процесс механический. В детандере сжатый газ совершает механическую работу, сильно охлаждаясь. По назначению это процесс теплообменный, предназначенный для выработки холода.
ХТП характеризуется технологическим режимом. Технологический режим – это совокупность параметров, определяющих условия работы аппарата, реактора или их систем и переработки сырья в продукты.
Оптимальный технологический режим – это совокупность значений параметров, позволяющих получить наибольший выход продукта при максимальной интенсивности процесса, производительности труда и низкой себестоимости.
Параметрами химико-технологического процесса, обеспечивающими его функционирование, являются измеримые величины, определяющие состояние реагентов и их реакционную способность, – температура, концентрация реагентов и их соотношение, давление, дисперсность и состав твердых реагентов, состав жидких и газообразных реагентов, способ и интенсивность перемешивания реагентов, линейная и объемная скорости реагентов, поступающих в систему.
Конечные продукты ХТП классифицируют следующим образом: целевые продукты, побочные продукты, отходы. Целевые продукты – это продукты целевого или многоцелевого назначения, получаемые при переработке сырья при заданных оптимальных условиях и соответствующие требованиям технических условий. Побочные продукты образуются параллельно с целевым продуктом в результате переработки сырья. Отходы – это побочные продукты, которые в настоящее время по техническим или экономическим причинам не находят применения и выводятся из ХТП в окружающую среду.
8. Скорость химико-технологических процессов и химическое равновесие
Химико-технологический процесс состоит из совокупности физических и химических явлений. Он складывается, как правило, из следующих взаимосвязанных элементарных стадий: 1) подвода реагирующих компонентов в зону реакции; 2) химических реакций; 3) отвода из зоны реакции полученных продуктов.
1. Подвод реагирующих компонентов в зону реакции совершается молекулярной диффузией или конвекцией. При сильном перемешивании реагирующих веществ конвективный перенос называют также турбулентной диффузией. В двух- или многофазных системах подвод реагирующих компонентов может совершаться абсорбцией или десорбцией газов, конденсацией паров, плавлением твердых веществ или растворением их в жидкости, испарением жидкостей или возгонкой твердых веществ. Межфазный переход — это сложный диффузионный процесс.
2. Химические реакции. В реагирующей системе обычно происходит несколько последовательных (а иногда и параллельных) химических реакций, приводящих к образованию основного продукта, а также ряд побочных реакций между основными исходными веществами и примесями, наличие которых в исходном сырье неизбежно. В результате кроме основного образуются побочные продукты (материалы, имеющие народнохозяйственное значение) или же отходы и отбросы производства, т. е. продукты реакций, не имеющиез начительной ценности и не находящие достаточного применения. Побочные продукты и отходы производства могут образоваться при основной реакции наряду с целевым продуктом, а также вследствие побочных реакций между основными исходными веществами и примесями. Обычно при анализе производственных процессов учитываются не все реакции, а лишь те из них, которые имеют определяющее влияние на количество и качество получаемых целевых продуктов.
3. Отвод из зоны реакции полученных продуктов может совершаться так же, как и подвод реагирующих компонентов диффузией, конвекцией и переходом вещества из одной фазы (газовой, жидкой, твердой) в другую.
Для ускорения таких процессов технологии изменяют те факторы, которые более всего влияют на скорость химической реакции, увеличивая, например, концентрацию исходных компонентов, температуру, давление, применяя катализаторы. Если общую скорость процесса лимитирует подвод реагирующих компонентов или отвод продуктов реакции, то процесс протекает в диффузионной области. Для ускорения таких процессов стремятся увеличить скорость диффузии усилением перемешивания (турбулизацией реагирующей системы), диспергированием фаз, повышением температуры и концентрации, гомогенизацией системы, т. е. переводом многофазной системы в однофазную и т. п. Если скорости всех стадий технологического процесса соизмеримы — процесс протекает в так называемой переходной области, то для увеличения скорости такого процесса необходимо, прежде всего, воздействовать на систему теми факторами, которые увеличивают как диффузию, так и скорость химической реакции, например повышением концентрации реагирующих веществ и температуры.
При изменении равновесных концентраций исходных веществ и продуктов реакции путем воздействия на систему происходит смещение химического равновесия. Если увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо. Если при внешнем воздействии увеличиваются концентрации исходных веществ, то говорят о смещении равновесия влево.
Характер смещения равновесия можно прогнозировать, применяя принцип французского ученого ЛеШателье:если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Принцип ЛеШателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия
9. Гомогенные и гетерогенные процессы в химической промышленности
Гомогенные процессы, т.е. процессы, протекающие в однородной среде (жидкие или газообразные смеси, не имеющие поверхностей раздела, отделяющих части системы друг от друга), сравнительно редко встречаются в промышленности.. В гомогенных системах реакции проходят быстрее, чем в гетерогенных.
Гетерогенные химические процессы основаны на реакциях между реагентами, находящимися в разных фазах. Большинство промышленных химико-технологических процессов относится к гетерогенным.. В соответствии с принятой классификацией некаталитические гетерогенные процессы делят по фазовому состоянию реагентов на процессы в системах Г-Ж, Ж-Т, Г-Т и т.д. Механизм гетерогенных процессов сложнее гомогенных, так как взаимодействию реагентов, находящихся в разных фазах, предшествует их доставка к поверхности раздела фаз и массообмен между фазами.
Химическое равновесие в гомогенных системах
При равенстве энтальпийного и энтропийного факторов ΔН = ТΔS ΔG = 0, что является термодинамическим условием химического равновесия. Химическое равновесие имеет динамический характер. Скорость реакции (число частиц образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В этот момент концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. Они обозначаются символом вещества в квадратных скобках.
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями.
При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе.
Как и для любого равновесия, условием гетерогенного химического равновесия является равенство энергии Гиббса нулю, ΔG = 0.
Мерой скорости химической реакции является количество вещества, вступившего в реакцию или образовавшегося при реакции за единицу времени в единице объема.(для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
Катализ – явление возбуждения хим.реакций веществами катализаторами. При этом катализатор многократно вступает в промежуточные взаимодействия с участниками процесса и восстанавливает свой состав после каждого цикла взаимодействия.
Типы катализа:
Гомогенный: 2СО2+О2à2CO2 (kat/ H2O(г))
Гетерогенный: N2+3H2«2NH3 (katPt(тв))
Адсорбционные процессы:в химизме гетерогенного катализа большую роль играет адсорбция – взаимодействие молекул с границей раздела фаз. При гетерогенном катализе благодаря адсорбции на поверхности катализатора создается увеличение концентрации реагирующих веществ, что само по себе должно ускорить химическую реакцию. И повышается химическая активность адсорбированных молекул.
Энергия активации: Еа минимальная энергия, которой должны обладать молекулы для эффективного столкновения, причем энергия активации должна быть больше средней энергии молекул. Реагируют те молекулы, которые обладают этой энергией, т.о. повышение температуры ведет к повышению числа активных молекул в гомогенном процессе, что и приводит к повышению скорости химической реакции.
Факторы, влияющие на скорость гомогенной реакции: температура, концентрация, природа регентов, катализатор.
Факторы, влияющие на скорость гетерогенной реакции: температура, концентрация, природа, катализатор, а также величина поверхности раздела между фаз, скорость доставки реагентов к межфазной поверхности.
РЕАКТОРЫ И ИХ КЛАССИФИКАЦИЯ
Химический реактор – устройство для проведения в нем превращений. Реактор сопряжен с аппаратом подготовки сырья и аппаратами разделение реакционной смеси и очистки целевого продукта.
В реакторе реакционная зона представляет собой несколько слоев катализатора. Исходная смесь попадает через штуцер (патрубок для соединения трубопровода, ёмкостей, вентилей и других деталей газовых и жидкостных передаточных и преобразующих систем.), распределяясь по поверхности теплообменника, в котором потоки могут снова смешиваться. Продукты выводятся через выводное устройство.
Реакционный процесс с участием катализатора, через неподвижный слой которого проходит потом газообразных реактивов.
Реагенты диффундируют на поверхности катализатора, проникают в его поры, на внутренней поверхности происходит химический процесс. Выделяющаяся при этом теплота уносится во внешнюю среду. С поверхности катализатора ресорбируются продукты и переносятся дальше по потоку.
Процессы в слое жидкости, через которую барбатируется газ.
Между пузырями газа и жидкости происходит газообмен. Динамика жидкости складывается из движения около пузырей газа и собственного движения в масштабах слоя. Следовательно, хим. превращение происходит внутри слоя и внутри пузырей газа.
Классификация хим. реакторов. В основе организационно-технической структуры реакторы делятся на периодического и непрерывного действия. Для реакторов периодического действия характерно падение движущей силы процесса во времени, вызванной уменьшением концентрации реагентов в ходе процесса. Режим работы таких реакторов непостоянен и требует изменений для поддержания скорости процесса. В реакторах непрерывного действия движущая сила постоянна вследствие постоянства концентраций. Режим работы постоянен.
Основной показатель работы реактора – интенсивность – время, затраченное на производство.
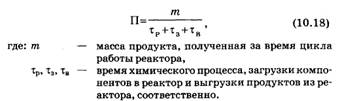
Для непрерывного процесса t3=tв=0.
По тепловому режиму:
1) с адиабатическим режимом: отсутствует теплообмен с окружающей средой, и тепловой эффект затрачивается на изменение температуры в реакторе.
2) с изотермическим режимом: постоянство температуры в реакторе за счет подвода или отвода тепла.
3) политропические реакторы: подвод или отвод тепла, за счет которого происходит изменение температуры.
Для реакторов непрерывного действия по режиму движущихся компонентов:
1) реакторы идеального вытеснения. Поток реагентов движется в одном направлении по длине реактора без перемешивания, движущие силы и скорость по длине изменяются, причем отклонение средней движущей силы от постоянного значения максимальное.
2) Реакторы идеального смешивания: потоки реагентов смешиваются друг с другом, а также и с продуктами реакции, движущая сила процесса и скорость постоянна по длине.
Движущая сила – разность между предельным значением данного параметра процесса и его действующим значением в данный момент времени.
1 и 2 зоны химических реакторов – подвод вещества в зону реакции и вывод продуктов реакции.
В этих зонах процессы подчиняются законам массы – передачи, они ускоряются физическим путем (перемещение, распыление, изменение скорости потоков). 2 зона – зона химических реакций. Где параллельно или последовательно идет ряд химических реакций, характеризуются скоростью (кинетический фактор) и состояние равновесия в системе (термодинамический фактор).