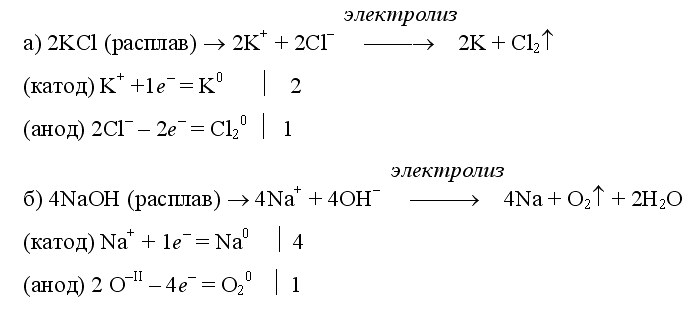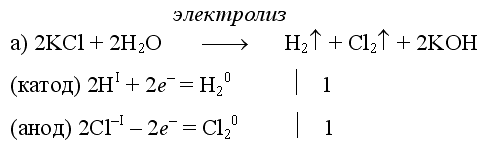| 1. Восстановление металлов из оксидов углем или угарным газом
MxOy + C = CO2 + Me или MxOy + CO = CO2 + Me
|
| 2. Обжиг сульфидов с последующим восстановлением
1 стадия – MxSy+O2=MxOy+SO2
2 стадия - MxOy + C = CO2 + Me или MxOy + CO = CO2 + Me
|
| 3. Алюминотермия (восстановление более активным металлом)
MxOy + Al = Al2O3 + Me
|
| 4. Водородотермия
MxOy + H2 = H2O + Me
|
Неметаллы
Неметаллы – это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов. Это 22 элемента Переодической системы: бор B, углерод C, кремний Si, азот N, фосфор P, мышьяк As, кислород O, сера S, селен Se, теллур Te, водород H, фтор F, хлор Cl, бром Br, йод I, астат At; а так же благородные газы: гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn.
Физические свойства
Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях: газы (благородные газы:He, Ne, Ar, Kr, Xe, Rn;водород H2, кислород O2, азот N2, фтор F2, хлор Cl2.), жидкость (бром Br2), твердые вещества(йод I2, углерод C, кремний Si, сера S, фосфор P и др.). Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
Химические свойства
1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами
4Al + 3C = Al4C3
2. Неметаллы играют роль окислителя при взаимодействии с водородом
H2 + F2 = 2HF
3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО
2P + 5S = P2S5
4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
CH4 + 2O2 = CO2 + 2H2O
5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3
6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5
7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
8. Наиболее сильные восстановительные свойства имеют углерод и водород
ZnO + C = Zn + CO;
CuO + H2 = Cu + H2O
9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования)
Cl2 + H2O =HCl + HClO
Атомно - молекулярное учение.
1. Все вещества состоят из молекул.
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов.
Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 110 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Химическая формула - это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс - цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества- молекулы, состоят из атомов одного и того же элемента.
Cложные вещества - молекулы, состоят из атомов различных химических элементов.
Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопа природного углерода.
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м. Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения - моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро ди Кваренья (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность - моль-1).
Молярная масса показывает массу 1 моля вещества (обозначается M).
M = m / n
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
Молярная масса вещества численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая - безразмерная.
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
В начале 20 века формулировка закона сохранения массы подверглась пересмотру в связи с появлением теории относительности (А.Эйнштейн, 1905 г.), согласно которой масса тела зависит от его скорости и, следовательно, характеризует не только количество материи, но и ее движение. Полученная телом энергия DE связана с увеличением его массы Dmсоотношением DE = Dm • c2, где с - скорость света. Это соотношение не используется в химических реакциях, т.к. 1 кДж энергии соответствует изменению массы на ~10-11 г и Dmпрактически не может быть измерено. В ядерных реакциях, где DЕ в ~106 раз больше, чем в химических реакциях, Dm следует учитывать.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Пример.
CuS - сульфид меди. m(Cu): m(S) = Ar(Cu): Ar(S) = 64: 32 = 2: 1
Чтобы получить сульфид меди (CuS) необходимо смешать порошки меди и серы в массовых отношениях 2: 1.
Если взятые количества исходных веществ не соответствуют их соотношению в химической формуле соединения, одно из них останется в избытке.
Например, если взять 3 г меди и 1 г серы, то после реакции останется 1 г меди, который не вступил в химическую реакцию. Вещества немолекулярного строения не обладают строго постоянным составом. Их состав зависит от условий получения.
Массовая доля элемента w (Э) показывает, какую часть составляет масса данного элемента от всей массы вещества: где n - число атомов; Ar(Э) - относительная атомная масса элемента; Mr - относительная молекулярная масса вещества.
Закон кратных отношений
(Д.Дальтон, 1803 г.)
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
N2O N2O3 NO2(N2O4) N2O5
Число атомов кислорода в молекулах этих соединений, приходящиеся на два атома азота, относятся между собой как 1: 3: 4: 5.
Закон объемных отношений
(Гей-Люссак, 1808 г.)
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
a) 2CO + O2 ® 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
b) При синтезе аммиака из элементов:
n2 + 3h2 ® 2nh3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака - объем исходной газообразной реакционной массы уменьшится в 2 раза.
Закон Авогадро ди Кваренья
(1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул.
Закон справедлив только для газообразных веществ.
Следствия.
1 Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2.При нормальных условиях (0°C = 273°К, 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Пример 1.
Какой объем водорода при н.у. выделится при растворении 4,8 г магния в избытке соляной кислоты?
Решение.
Mg + 2HCl ® MgCl2 + H2
При растворении 24 г (1 моль) магния в HCl выделилось 22,4 л (1 моль) водорода; при растворении 4,8 г магния –– Х л водорода.
X = (4,8 • 22,4) / 24 = 4,48 л водорода
Водные растворы, гидролиз и электролиз
Водные растворы
К водным растворам относятся малоконцентрированные насыщенные растворы неорганических веществ, а также ароматные воды, не содержащие спирта.
Жидкость Бурова. Представляет собой водный раствор основного ацетата алюминия концентрацией 7,6—9,2% и плотностью 1,044—1,048. Раньше жидкость Бурова получали с помощью реакции образования гидрата окиси алюминия с его последующим растворением в уксусной кислоте. В последние годы ее производят методом электролиза, разработанным А. И. Коноваловой. В основе его лежит процесс анодного растворения металлического алюминия в 8% растворе уксусной кислоты при пропускании через него электрического тока. В результате протекает реакция образования основного ацетата алюминия.
Раствор ацетата свинца основного. Свинцовый уксус. Представляет собой водный раствор ацетата свинца основного с содержанием металлического свинца 16,7—17,4% и плотностью 1,225—1,230. При стоянии на воздухе раствор мутнеет вследствие интенсивного поглощения углекислоты воздуха. Препарат получают взаимодействием ацетата свинца и окиси свинца при нагревании. 3. П. Беридзе предложил получать раствор основного ацетата свинца из окиси свинца и уксусной кислоты.
Сам по себе раствор основного ацетата свинца не применяется. Из него готовят в аптеках свинцовую примочку по прописи: 2 части ацетата свинца основного и 98 частей воды. Свинцовая примочка, как и жидкость Бурова, является вяжущим и противовоспалительным средством.
Известковая вода. Раствор гидроокисикальция. Известковая вода — это насыщенный водный раствор гидроокиси кальция концентрацией 0,15—0,17%. Получают реакцией гашения жженой извести (кальция окиси) с последующим насыщением раствора гидроокиси кальция на холоду. Готовый препарат представляет собой прозрачную бесцветную жидкость сильно щелочной реакции. Его применяют внутрь в смеси с молоком в детской практике при повышенной кислотности желудочного сока и поносе.
Раствор калия арсенита. Фаулеров раствор мышьяка. Официальный раствор, представляющий собой водный раствор мышьяковистого ангидрида (которого в препарате должно быть 0,97—1,03%) в смеси с калия карбонатом.
Для получения раствора калия арсенита 10 частей калия карбоната растворяют в 10 частях кипящей воды, прибавляют 10 частей мышьяковистого ангидрида и жидкость нагревают до кипения (до полного растворения). Далее раствор разбавляют 500 г воды и при перемешивании постепенно добавляют разведенной соляной кислоты до нейтральной реакции раствора, что необходимо для предупреждения образования других солей мышьяка. После нейтрализации к раствору добавляют 90 частей спирта (по объему) и 10 частей камфорного спирта (по объему). Раствор калия арсенита — препарат списка А. Камфорный спирт добавляют в него с целью быстрого и легкого органолептического опознания.
Сохраняют препарат под замком (шкаф А), в хорошо закупоренных склянках темного стекла. Его назначают при малокровии, неврастении, истощении и хроническом лейкозе.
Ароматные воды. Представляют собой слабоконцентрированные растворы эфирных масел в воде. Это прозрачные или слабо опалесцирующие жидкости, обладающие запахом растворенного вещества. За редким исключением (укропная и горькоминдальная вода), они не имеют самостоятельного лекарственного назначения и применяются как корригирующие средства (для исправления запаха).
В зависимости от способа получения различают простые и перегнанные ароматные воды.
Простые ароматные воды получают непосредственным растворением соответствующего эфирного масла в воде в соотношении 1:1000 (за исключением розовой воды, которую вследствие сильной пахучести розового масла готовят в соотношении 1:4000). Перед растворением эфирное масло растирают с тальком и растворяют в теплой (до 60°) воде. Обе операции необходимы для улучшения процесса растворения. Избыток масла в растворе отфильтровывают через влажный фильтр.
Для повышения стабильности простых ароматных вод к ним рекомендуется добавлять ПАВ, играющие роль солюбилизаторов: твины, спены, этилстеараты и другие вещества, улучшающие растворимость.
Перегнанные ароматные воды готовят методом перегонки, заключающимся в пропускании «острого» водяного пара через эфирномасличное сырье. Процесс перегонки с водяным паром основан на законе Дальтона, в соответствии с которым две несмешивающиеся жидкости перегоняются при более низкой температуре, чем каждая в отдельности, поскольку образование пара таких смесей протекает при равенстве суммы парциальных давлений компонентов смеси и атмосферного давления.
Для получения ароматных вод в перегонный куб помещают эфирномасличное сырье, через которое пропускают водяной пар, увлекающий вместе с собой в конденсатор эфирное масло. В конденсаторе, охлаждаемом холодной водой, пары воды и эфирного масла конденсируются и стекают в приемник в виде готовой ароматной воды. В случае, если при перегонке образуется излишек эфирного масла, не растворяющийся в воде, его сливают в отдельные приемники.
Из перегнанных ароматных вод в фармацевтической практике более или менее широкое применение находят горько-миндальная вода и укропная вода, применяемые внутрь с целью улучшения функций кишечника.
Ароматные воды готовят и на спирте. В этом случае концентрация эфирного масла в них может быть увеличена.
Гидролиз
Гидролиз - это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита. (В общем случае обменное взаимодействие растворённого вещества с растворителем носит название - сольволиз).
В большинстве случаев гидролиз сопровождается изменением pH раствора.
Большинство реакций гидролиза - обратимы:
Pb(NO3)2 + H2O «Pb(OH)(NO3) + HNO3
Na2HPO4 + H2O «NaH2PO4 + NaOH
Некоторые реакции гидролиза протекают необратимо:
Al2S3 + 6H2O «2Al(OH)3¯ + 3H2S
Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной оболочки с образованием малодиссоциированных соединений или ионов.
Способность солей подвергаться гидролизу зависит от двух факторов:
1) свойств ионов, образующих соль;
2) внешних факторов.
Отсутствие гидролиза в растворах
Соли, образованные катионом сильного основания и анионом сильной кислоты (например, LiBr, K2SO4, NaClO4, BaCl, Ca(NO3)2 и др.) гидролизу не подвергаются, т.к. ни катион, ни анион соли не могут при взаимодействии с водой образовать молекулы слабых электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (pH = 7). Практически не гидролизуются также и труднорастворимые соли (CaCO3, Mg3(PO4)2 и др.) из-за очень низкой концентрации ионов в водных растворах этих солей.
Гидролиз по катиону
Соли слабого основания и сильной кислоты гидролизуются по катиону:
NH4Cl + H2O «NH4OH + HCl
В ионной форме:
NH4+ + H2O «NH4OH + H+
Гидролиз солей, образованных многовалентным катионом протекает ступенчато, через стадии образования основных солей:
1 ступень:
Al(NO3)3 + H2O «Al(OH)(NO3)2 + HNO3
Al3+ + H2O «[Al(OH)]2+ + H+
2 ступень:
Al(OH)(NO3)2 + H2O «Al(OH)2(NO3) + HNO3
[Al(OH)]2+ + H2O «[Al(OH)2]+ + H+
3 ступень:
Al(OH)2(NO3) + H2O «Al(OH)3 + HNO3
[Al(OH)2]+ + H2O «Al(OH)3 + H+
Гидролиз протекает достаточно сильно по первой ступени, слабо - по второй ступени и совсем слабо - по третьей ступени (ввиду накопления ионов водорода, процесс смещается в сторону исходных веществ). Более полному гидролизу способствует разбавление раствора и повышение температуры. (В этом случае можно учитывать гидролиз и по третьей ступени.)
При гидролизе по катиону реакция раствора кислая pH < 7.
Гидролиз по аниону
Соли, образованные сильным основанием и слабой (ассоциированной) кислотой гидролизуются по аниону:
CH3COOK + H2O «CH3COOH + KOH
В ионной форме:
CH3COO- + H2O «CH3COOH +OH-
Соли многоосновных кислот гидролизуются ступенчато (с образованием кислых солей):
1 ступень:
K2CO3 + H2O «KHCO3 + KOH
CO2-3 + H2O «HCO3- + OH-
2 ступень:
KHCO3 + H2O «H2CO3+ KOH
HCO3- + H2O «H2CO3 + OH-
Первая ступень гидролиза протекает достаточно сильно, а вторая - слабо, о чём свидетельствует pH раствора карбоната и гидрокарбоната калия. (Лишь при сильном разбавлении и нагревании следует учитывать гидролиз образующейся кислой соли). Поскольку при взаимодействии с водой анионов слабых кислот образуются ионы OH-, водные растворы таких солей имеют щелочную реакцию (pH > 7).
Гидролиз по катиону и аниону
Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по аниону:
CH3COONH4 + H2O «CH3COOH + NH4OH
или в ионной форме:
CH3COO- + NH4+ + H2O «CH3COOH + NH4OH
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота.
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т.е. от их констант диссоциации (KD).
Если KD(основания) > KD(кислоты), то pH > 7;
если KD(основания) < KD(кислоты), то pH < 7.
В случае гидролиза CH3COONH4:
KD(NH4OH) = 6,3 • 10-5; KD(CH3COOH)=1,8 • 10-5
поэтому реакция водного раствора этой соли будет слабощелочной, почти нейтральной (pH = 7–8).
Если основание и кислота, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то в этом случае гидролиз соли протекает необратимо:
Al2S3 + 6H2O «2Al(OH)3¯ + 3H2S
Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например, из элементов при высокой температуре:
2Al + 3S –t°® Al2S3
и должен храниться в герметических сосудах, исключающих попадание влаги.Реакции обмена, сопровождаемые гидролизом
К числу таких реакций относятся взаимодействия солей двухвалентных катионов (кроме Ca2+,
Sr2+, Ba2+) с водными растворами карбонатов натрия или калия, сопровождающиеся образованием осадков менее растворимых основных карбонатов
2Cu(NO3)2 + 2Na2CO3 + H2O ® Cu2(OH)2CO3¯ + 4NaNO3 + CO2
А также реакции взаимодействия солей Al3+, Cr3+ и Fe3+ (*При взаимодействии водных растворов солей трёхвалентного железа с сульфидами щелочных металлов протекает окислительно-восстановительная реакция: 2Fe3+ + S2- ® 2Fe2+ + S0) с водными растворами карбонатов и сульфидов щелочных металлов:
2AlCl + 3Na2CO3 + 3H2O ® 2Al(OH)3¯ + 3CO2 + 6NaCl
Cr2(SO4)3 + 3Na2S + 6H2O ® 2Cr(OH)3¯ + 3H2S + 3Na2SO4
Количественные характеристики реакции гидролиза
Степень гидролиза (aгидр.) - отношение числа гидролизованных молекул к общему числу растворённых молекул (выражается в процентах):
aгидр. = ([C]гидр. / [C]раств.) • 100%
Степень гидролиза зависит от химической природы образующейся при гидролизе кислоты (основания) и будет тем больше, чем слабее кислота (основание) (в определённых равных условиях).
Электролиз
Этот окислительно-восстановительный процесс протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов.
На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
Примеры электролиза расплавов:
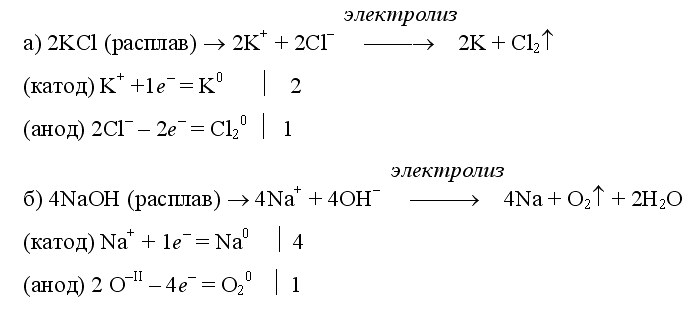
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):

В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода
. Примеры электролиза растворов солей:
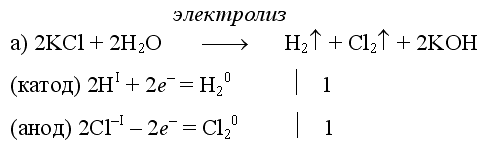
(на аноде окисляются анионы Сl−, а не кислород O−II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород)

(на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде).
Таким образом, электролиз - это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.