Химическая связь
Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия).
Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь.
Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Ионная связь - химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается. Ионная связь ненаправленная и не насыщаемая.
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
| а)
| H· + ·H 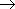 H:H H:H
| H-H
| H2
| (одна общая пара электронов; H одновалентен);
|
| б)
| 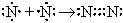
| N  N N
| N2
| (три общие пары электронов; N трехвалентен);
|
| в)
| 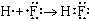
| H-F
| HF
| (одна общая пара электронов; H и F одновалентны);
|
| г)
| 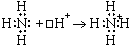
| 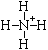
| NH4+
| (четыре общих пары электронов; N четырехвалентен)
|
По числу общих электронных пар ковалентные связи делятся на
- простые (одинарные) - одна пара электронов,
- двойные - две пары электронов,
- тройные - три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную. Неполярная связь образуется между одинаковыми атомами, полярная - между разными.
Электроотрицательность - мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются  + и
+ и  -, например:
-, например: 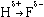 .
.
По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на  -связь и
-связь и  -связь.
-связь.
Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов),  -связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
-связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков - предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей.
Чаще всего встречается три типа гибридизации: sp -, sp 2 и sp 3-гибридизация. Например:
sp -гибридизация - в молекулах C2H2, BeH2, CO2 (линейное строение);
sp 2-гибридизация - в молекулах C2H4, C6H6, BF3 (плоская треугольная форма);
sp 3-гибридизация - в молекулах CCl4, SiH4, CH4 (тетраэдрическая форма); NH3(пирамидальная форма); H2O (уголковая форма).
Металлическая связь - химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов.
Металлическая связь образуется в том случае, когда связываемые атомы большие и потому склонны отдавать электроны. Простые вещества с металлической связью - металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества - интерметаллические соединения (AlCr2, Ca2Cu, Cu5Zn8 и др.).
Металлическая связь не обладает направленностью насыщаемостью. Она сохраняется и в расплавах металлов.
Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей:
H—O—H ··· OH2, H—O—H ··· NH3, H—O—H ··· F—H, H—F ··· H—F.
Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др.
Мерой прочности любой связи является энергия связи.
Энергия связи - энергия необходимая для разрыва данной химической связи в 1 моле вещества. Единица измерений - 1 кДж/моль.
Энергии ионной и ковалентной связи - одного порядка, энергия водородной связи - на порядок меньше.
Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия.
Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
Строение вещества
По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na+)2(SO42-), (K+)3(PO43-), (NH4+)(NO3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): Na+ + 1e = Na0
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
Точно так же
3) Неактивные металлы
Точно так же
Растворы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): 2H2O + 2e = H2 + 2OH−
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2.Соль активного металла и кислородсодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → 2H2 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2H2O (электролиз) → 2H2 + O2
2) Менее активные металлы
1.Соль менее активного металла и бескислородной кислоты
ZnCl2 ↔ Zn2+ + 2Cl−
K"катод"(-): Zn2+ + 2e = Zn0
A"анод"(+): 2Cl− — 2e = 2Cl0
Вывод: ZnCl2 (электролиз) → Zn + Cl2
2.Соль менее активного металла и кислородсодержащей кислоты
ZnSO4 ↔ Zn2++SO42−
K(-): Zn2+ + 2e = Zn0
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2ZnSO4 + 2H2O(электролиз) → 2Zn + 2H2SO4 + O2
3. Гидроксид: невозможно (нерастворим)
3) Неактивные металлы
Точно так же
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
§ У анода анионы окисляются.
§ На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
§ КАТод — КАТионы (ионы у катода)
§ АНод — АНионы (ионы у анода)
Реакции в кислой среде.
5K2S+4O3 + 2KMn+7O4 + 3H2SO4 ® 6K2S+6O4 + 2Mn+2SO4 + 3H2O
электронный баланс
| Mn+7 + 5ē ® Mn+2
| 2
|
| S+4 – 2ē ® S+6
| 5
|
метод полуреакций
| MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O
| 2
|
| SO32- + H2O – 2ē ® SO42- + 2H+
| 5
|
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 16H+ + 5SO32- + 5H2O ® 2Mn2+ + 8H2O + 5SO42- + 10H+
или 2MnO4- + 6H+ + 5SO32- ® 2Mn2+ + 3H2O + 5SO42-
Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора K2SO3.
Реакции в нейтральной среде
3K2S+4O3 + 2KMn+7O4 + H2O ® 3K2S+6O4 +2Mn+4O2¯ + 2KOH
электронный баланс
| S+4 – 2ē ® S+6
| 3
|
| Mn+7 + 3ē ® Mn+4
| 2
|
метод полуреакций:
| MnO41- + 2H2O + 3ē ® MnO2 + 4OH-
| 2
|
| SO32- + 2OH- - 2ē ® SO42- + H2O
| 3
|
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 4H2O + 3SO32- + 6OH- ® 2MnO2 + 8OH- + 3SO42- + 3H2O
или 2MnO4- + H2O + 3SO32- ® 2MnO2 + 2OH- + 3SO42-
Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
Реакции в щелочной среде.
K2S+4O3 + 2KMn+7O4 + 2KOH ® K2S+6O4 +2K2Mn+6O4 + H2O
электронный баланс
| S+4 – 2ē ® S+6
| 1
|
| Mn+7 + 1ē ® Mn+6
| 2
|
метод полуреакций:
| SO32- + 2OH- - 2ē ® SO42- + H2O
| 1
|
| MnO41- + ē ® MnO42-
| 2
|
–––––––––––––––––––––––––––––––––––––
SO32- + 2OH- + 2MnO4- ® SO42- + H2O + 2MnO42-
Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4.
Таким образом,
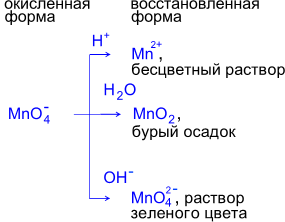
Реакции с дихроматом калия в качестве окислителя
Степень окисления хрома понижается с +6 до +3. Наблюдается изменение окраски реакционной массы с желто-оранжевого цвета до зеленого или фиолетового.
1) K2Cr2+6O7 + 3H2S-2 + 4H2SO4 ® K2SO4 + Cr2+3(SO4)3 + 3S0¯ + 7H2O
электронный баланс:
| 2Cr+6 + 6ē ® 2Cr+3
| 1
|
| S-2 - 2ē ® S0
| 3
|
метод полуреакций:
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O
| 1
|
| H2S0 - 2ē ® S0 + 2H+
| 3
|
––––––––––––––––––––––––––––––––––
Cr2O72- + 8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S0
2) K2Cr2+6O7 + 6Fe+2SO4 + 7H2SO4 ® 3Fe2+3(SO4)3 + K2SO4 + Cr2+3(SO4)3 + 7H2O
электронный баланс:
| 2Cr+6 + 6ē ® 2Cr+3
| 1
|
| Fe+2 – ē ® Fe+3
| 6
|
метод полуреакций:
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O
| 1
|
| Fe2+ - ē ® Fe3+
| 6
|
–––––––––––––––––––––––––––––––––––––
6Fe2+ + Cr2O72- + 14H+ ® 2Cr3+ + 6Fe3+ + 7H2O
3) K2Cr2+6O7 + 14HCl-1 ® 3Cl20 + 2KCl + 2Cr+3Cl3 + 7H2O
электронный баланс:
| 2Cr+6 + 6ē ® 2Cr+3
| 1
|
| 2Cl-1 – 2ē ® Cl20
| 3
|
метод полуреакций:
| Cr2O72- + 14H+ + 6ē ® 2Cr3+ + 7H2O
| 1
|
| 2Cl1- - 2ē ® Cl20
| 3
|
–––––––––––––––––––––––––––––––––––
Cr2O72- + 6Cl- + 14H+ ® 2Cr3+ + 3Cl20 + 7H2O
Способы получения металлов
Природные соединения металлов
Металлы могут встречаться в природе или в виде простого вещества или в виде сложного вещества.
Металлы в природе встречаются в трёх формах:
1. Активные – в виде солей (сульфаты, нитраты, хлориды, карбонаты)
2. Средней активности – в виде оксидов, сульфидов (Fe3O4, FeS2)
3. Благородные – в свободном виде (Au, Pt, Ag)
Чаще всего металлы в природе встречаются в виде солей неорганических кислот или оксидов:
- хлоридов – сильвинит КСl • NaCl, каменная соль NaCl;
- нитратов – чилийская селитра NaNO3;
- сульфатов – глауберова соль Na2SO4 · 10 H2O, гипс CaSO4 • 2Н2О;
- карбонатов – мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 • MgCO3;
- сульфидов – серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
- фосфатов – фосфориты, апатиты Ca 3(PO4)2;
- оксидов – магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 • Н2О.
Ещё в середине II тысячелетия до н. э. в Египте было освоено получение железа из железных руд. Это положило начало железному веку в истории человечества, который пришёл на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией. Так же называется и наука о промышленных способах получения металлов из руд.
Металлургия – это наука о промышленных способах получения металлов.
Получение металлов
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления.
Ме+n + ne- → Me0
Химическая связь
Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия).
Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь.
Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Ионная связь - химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается. Ионная связь ненаправленная и не насыщаемая.
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
| а)
| H· + ·H 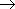 H:H H:H
| H-H
| H2
| (одна общая пара электронов; H одновалентен);
|
| б)
| 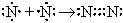
| N  N N
| N2
| (три общие пары электронов; N трехвалентен);
|
| в)
| 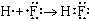
| H-F
| HF
| (одна общая пара электронов; H и F одновалентны);
|
| г)
| 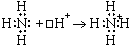
| 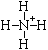
| NH4+
| (четыре общих пары электронов; N четырехвалентен)
|
По числу общих электронных пар ковалентные связи делятся на
- простые (одинарные) - одна пара электронов,
- двойные - две пары электронов,
- тройные - три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную. Неполярная связь образуется между одинаковыми атомами, полярная - между разными.
Электроотрицательность - мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются  + и
+ и  -, например:
-, например: 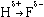 .
.
По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на  -связь и
-связь и  -связь.
-связь.
Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов),  -связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
-связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков - предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей.
Чаще всего встречается три типа гибридизации: sp -, sp 2 и sp 3-гибридизация. Например:
sp -гибридизация - в молекулах C2H2, BeH2, CO2 (линейное строение);
sp 2-гибридизация - в молекулах C2H4, C6H6, BF3 (плоская треугольная форма);
sp 3-гибридизация - в молекулах CCl4, SiH4, CH4 (тетраэдрическая форма); NH3(пирамидальная форма); H2O (уголковая форма).
Металлическая связь - химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов.
Металлическая связь образуется в том случае, когда связываемые атомы большие и потому склонны отдавать электроны. Простые вещества с металлической связью - металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества - интерметаллические соединения (AlCr2, Ca2Cu, Cu5Zn8 и др.).
Металлическая связь не обладает направленностью насыщаемостью. Она сохраняется и в расплавах металлов.
Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей:
H—O—H ··· OH2, H—O—H ··· NH3, H—O—H ··· F—H, H—F ··· H—F.
Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др.
Мерой прочности любой связи является энергия связи.
Энергия связи - энергия необходимая для разрыва данной химической связи в 1 моле вещества. Единица измерений - 1 кДж/моль.
Энергии ионной и ковалентной связи - одного порядка, энергия водородной связи - на порядок меньше.
Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия.
Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
Строение вещества
По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na+)2(SO42-), (K+)3(PO43-), (NH4+)(NO3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
Электролитическая диссоциация веществ в водных растворах
Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
С особенностями растворения веществ можно познакомиться экспериментально исследуя электропроводность растворов этих веществ с помощью прибора.
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы –
2. положительно (катионы) и отрицательно (анионы) заряженные частицы.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na +, Mg 2+, А l 3+ и т.д.) - или из нескольких атомов - это сложные ионы (N О3-, SO 2- 4, РОЗ-4 и т.д.).
2. В растворах и расплавах электролиты проводят электрический ток.
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
| ВЕЩЕСТВА
|
| ЭЛЕКТРОЛИТЫ
| НЕЭЛЕКТРОЛИТЫ
|
| Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток
| Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
|
| Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания
| Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью
|
| В растворах и расплавах образуются ионы
| В растворах и расплавах не образуются ионы
|
3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита К A на катион К+ и анион А- в общем виде записывается так: КА ↔ K+ + A-



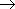 H:H
H:H
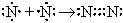
 N
N
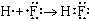
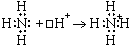
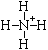
 + и
+ и 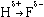 .
. -связь и
-связь и  -связь.
-связь.



