1. Определение массовой доли элемента Помните:
1) массовая доля химического элемента – это отношение массы элемента к массе всего соединения;
2) массовая доля вещества в смеси – это отношение массы вещества к массе смеси;
3) массовая доля вычисляется в долях от единицы или в процентах.
Порядок действий:
Алгоритм определения массовой доли элемента в соединении.
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
| 1.Прочитайте текст задачи.
| Вычислите массовую долю кислорода в перманганате калия
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|  2.Дано:
KMnO4 2.Дано:
KMnO4
  ω (О)=?
ω (О)=?
|
| 3.Найдите молекулярную массу перманганата калия KMnO4
| 3.Решение:
Mr(KMnO4) = Ar(K) + Ar(Mn) + 4Ar(O) = 39 + 55 + 4 · 16 = 158
|
4. По формуле 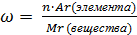 рассчитайте массовую долю кислорода в соединении рассчитайте массовую долю кислорода в соединении
| 4. 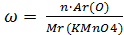

|
| 5.Запишите ответ.
| Ответ: 
|
Задания для решения
1)Найдите массовые части серы и кислорода в оксиде серы (VI).
2)Определите массовую долю алюминия в нитрате алюминия
3). Используя таблицу физических величин, выберите нужную формулу для расчета и найдите объем 0,5 моль газа (при н. у.)
Б. Расчеты по химическим уравнениям Примеры сложных задач:
Алгоритм вычисления объёма вещества по известной массе вещества
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
| 1.Прочитайте текст задачи.
| Вычислить, какой объём (при н.у.) занимают 42 г азота N2
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|  2.Дано:
m (N2) = 42 г 2.Дано:
m (N2) = 42 г
  Vгаза (н.у.) =?
Vгаза (н.у.) =?
|
| 3. Вычислить молярную массу азота
| 3.Решение:
Mr (N2) = 2Ar(N) = 2 · 14 = 28
М (N2) = 28 г/моль
|
| 4. Вычислить количество азота
| 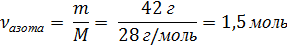
|
| 5. Рассчитать объём азота по формуле, зная, что Vm - величина постоянная для любого газа (н.у.) 22,4 л/моль
| V = ν · Vm
V = 1,5 моль · 22,4 л/моль = 33,6 л
|
| Запишите ответ
| Ответ: V = 33,6 л
|
Алгоритм вычисления массы (объёма) продукта реакции по известной массе или объёму исходного вещества, содержащего примеси
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
|
Количественный метод
| 1.Прочитайте текст задачи.
| 1.Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей?
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|  2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2) 2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)
  m(CаO)=?
m(CаO)=?
|
| 3.Составьте уравнение химической реакции.
| 3.Решение:
CаСO3 = CаО + СO2
|
| 4.Массу чистого вещества (как и объём) можно вычислить двумя способами
1 способ:
ω (чист.вещ-ва)= 100% - ω прим.
ω (чист.вещ-ва) = m (чист.вещества) / m (смеси)
Отсюда:
m (чист.вещ-ва) = m (смеси) · ω (чист.вещ-ва)
2 способ:
m (примеси) = m (смеси) · ω (примеси)
m (чист.вещества) = m (смеси) - m (примеси)
| 4.Решение:
1 способ:
ω (чист.вещества) CаСO3= 100% - 20% = 80% или 0,8
m (чист.вещества) CаСO3= 400г · 0,8 = 320 г
2 способ:
m (примеси) = 400 г · 0,2 = 80 г
m (чист.вещества) CаСO3= 400 г – 80 г = 320 г
Выбирай понятный для тебя способ решения!
|
| 5.В уравнении одной чертой подчеркните формулы веществ, о которых идёт речь в задаче.
| 5. CаСO 3 = CаО + СO2
|
| 6.Вычислите молярные массы этих веществ.
| 6.
М(CаСO3) = 40 + 12 + 16·3 = 100 г/моль
М(СaO) = 40 + 16 = 56 г/моль
|
| 7.Массу чистого вещества, полученную в пункте 4, переведите в количество вещества по формуле ν= m/М
| 7. ν (CаСO3)= 320 г/100 г/моль = 3,2 моль
|
| 8.Над подчёркнутой формулой известного вещества укажите величину, полученную в пункте 7, - показывает количество взятого реагента по условию задачи, над формулой вещества, массу которого надо найти, поставим Х моль.
| 8. 3,2 моль Х моль
CаСO 3 = CаО + СO2
|
| 9. Под подчёркнутыми формулами исходного и образующегося веществ укажите количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед формулами веществ в уравнении реакции) - показывают необходимые количества исходного и образующегося веществ.
|
9. 3,2 моль Х моль
CаСO 3 = CаО + СO2
1моль 1моль
|
| 10.Составить и решить пропорцию.
| 10.
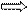 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль
      1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль. 1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
|
| 11.Вычислите массу продукта реакции
m(вещества)= ν(вещества) · М(вещества)
| 11.
m(СаО) =3,2 моль · 56 г/моль = 179,2 г
|
| 12.Запишите ответ.
| 12.Ответ:
m(CаО) = 179,2 г.
|
|
Метод пропорций
|
| 1. Повторить действия пунктов 1 – 6 количественного метода
|
|
| 2. По формуле m = М · ν (где ν – коэффициент перед соответствующей формулой вещества в уравнении реакции) найдите массу вещества
| m = М · ν
m(CаСO3) = 100 г/моль · 1 моль = 100 г
m(СaO) = 56 г/моль · 1 моль = 56 г
|
| 3. Над подчёркнутой формулой известного вещества укажите массу, полученную в пункте 4 количественного метода, над формулой вещества, массу которого надо найти, поставим Х г
| 3.
320 г Х г
CаСO 3 = CаО + СO2
|
| 4. Под соответствующей формулой записать массу, полученную в пункте 3
| 4.
320 г Х г
CаСO 3 = CаО + СO2
100 г 56 г
|
| 5. Составить и решить пропорцию
| 5.
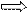 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г
|
| 6.Запишите ответ.
| 6.Ответ:
m(CаО) = 179,2 г.
|
| | | |
Задания для решения
1).Рассчитайте массу металла, полученного из 160г оксида меди (II).В качестве восстановителя используйте уголь.
2). Сколько кг хрома можно получить из 167,2кг оксида хрома (III), содержащего 10% примесей алюминотермическим способом.
6. Контроль знаний по теме. Итоговое задание по теме «Расчеты по химическим формулам и уравнениям». Каждый ученик получает карточку с задачами, которые он должен решить.
7. Домашнее задание. ОИ 1. С. 12-22, СРО 5
8. Источники и литература.



 2.Дано:
KMnO4
2.Дано:
KMnO4

 ω (О)=?
ω (О)=?
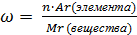 рассчитайте массовую долю кислорода в соединении
рассчитайте массовую долю кислорода в соединении
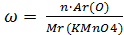


 2.Дано:
m (N2) = 42 г
2.Дано:
m (N2) = 42 г

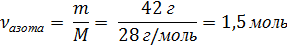
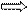 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль
3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль



 1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
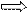 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г
320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г



