БПОУ ВО «БОРИСОГЛЕБСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
УЧЕБНО-МЕТОДИЧЕСКАЯ КАРТА
Специальность 33.02.01 «Фармация»; ОУД. 11 Химия
Тип занятия: Совершенствование знаний, умений; Выработка первичных практических умений
Форма проведения: Практическое занятие
Тема « Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией ».
Цели.
Учебная: познакомиться со способами разделения смесей: фильтрованием и дистилляцией, научиться разделять смеси с помощью фильтров, а также с помощью выпаривания.
Развивающая: организовывать собственную деятельность; развивать умение работать в коллективе и команде, общаться в группе; развивать умения поиска и использование информации.
Воспитательная: продолжить работу по развитию логического мышления учащихся, по формированию умения строить индуктивные выводы, способствовать совершенствованию навыков сотрудничества в ходе работы, формированию уважительного отношения к мнению других.
В результате изучения темы обучающийся должен уметь:
· разделять смеси веществ, используя различия в свойствах веществ.
· разделять смеси с помощью фильтров, а также с помощью выпаривания.
· рассчитывать массовую долю компонентов смеси
Межпредметные связи. ОУД.04 Математика, ОУД.08 Информатика, ОУД. 12 Биология
Оснащение занятия: лабораторный штатив, спиртовка, химический стакан, колба, стеклянная палочка, воронка, фильтровальная бумага, фарфоровая чашка, щипцы, смесь речного песка и поваренной соли, вода, медный купорос, раствор нитрата серебра.
СТРУКТУРА ЗАНЯТИЯ
Организационная часть.
2.Начальная мотивация учебной деятельности. Внимательно слушают инструктаж преподавателя по технике безопасности. Отвечают на вопросы
3. Актуализация знаний и умений по теме. Фронтальный опрос по теме
4. Самостоятельная работа. Выполнение практической части. Проведение опытов по очистке смеси речного песка с поваренной солью, дистилляции воды, перекристаллизации сульфата меди.
Опыт 1. «Очистка загрязненной поваренной соли (соль загрязнена речным песком)».
Выделение поваренной соли из ее смеси с речным песком:
План работы:
1. Ознакомьтесь с инструкцией по технике безопасности.
2. В тетради для практических работ запишите дату выполнения и тему работы.
| Исходные вещества
| Что делал(а)
| Наблюдения и выводы
|
|
| 3. Растворить загрязненную соль в небольшом объеме воды. 4. Дать раствору отстояться. 5. Очистить полученный раствор с помощью фильтрования: слить жидкость с отстоявшегося осадка в стакан по палочке. При этом примесь песка остается на фильтре (сделайте фильтр из подручного материала), а в стакан проходит прозрачный фильтрат (раствор соли в воде).
 6. Полученный фильтрат вылейте в фарфоровую чашечку (возьмите подручный материал) и нагрейте до полного испарения воды (рис. 2). На стенках чашечки образуются кристаллики очищенной поваренной соли
6. Полученный фильтрат вылейте в фарфоровую чашечку (возьмите подручный материал) и нагрейте до полного испарения воды (рис. 2). На стенках чашечки образуются кристаллики очищенной поваренной соли
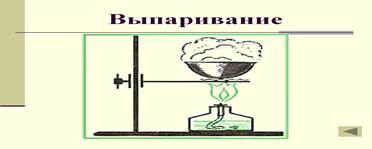
| 7. В заключение сделайте выводы об использованных метода разделения. (Метод фильтрования применим для разделения неоднородных смесей, в которых один из компонентов растворимое вещество, а другой нет. Метод выпаривания применим для отделения летучих компонентов смесей от менее летучих (или ‚ нелетучих).
|
Контроль знаний по теме «Способы разделения смесей».
БПОУ ВО «БОРИСОГЛЕБСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
УЧЕБНО-МЕТОДИЧЕСКАЯ КАРТА
Специальность 33.02.01 «Фармация» ОУД 11. Химия
Тип занятия: Совершенствование знаний, умений; Выработка первичных практических умений
Форма проведения: Практическое занятие
Цели.
а) Учебная: систематизировать знания о первоначальных химических понятиях, основных законах в химии, умения производить расчёты по химическим формулам и уравнениям.
б) Развивающая: развивать умения обучающихся составлять схему анализа формул, алгоритма решения задачи с использованием вещества, содержащего примеси, или раствора с опреде ленной массовой долей растворённого вещества, выхода продукта реакции.
в) Воспитательная: развивать логическое мышление, формировать культуру общения через умение слушать, вести дискуссию, работу в парах.
Таблица физических величин
| Наименование
| Символ
| Формула
| Единица СИ
| Внесистемные единицы
|
| Число структурных частиц
| N
| N = NA * n
| Частицы (атомы, молекулы, ионы)
| -
|
| Количество вещества
| n
| n = N / NA
n = m /M
n =Vm /V
| моль
| Кмоль, ммоль
|
| Масса молекулы в кг
| m м
| m м = Mr * 1,66*10 -27
| кг
| г, т
|
| Относительная атомная масса
| Ar
| Ar = m /1,66 *10-27
| разы
| -
|
| Относительная молекулярная масса
| Mr
| Mr = Ar *индекс в формуле вещества
| разы
| -
|
| Молярная масса
| M
| M = m / n
M = [ Mr ]
M (газа или пара) =22, 4* p
| г/моль
| кг/кмоль
|
| Масса вещества
| m
| m = M * n
| кг
| г
|
| Объём
| V
| V= Vm*n
| л
| м3
|
| Молярный объём
| Vm
| Vm = V/n
| м3/кмоль
| л/моль
|
| Массовая доля компонента
| W
| W= m к /m всего
W= (m к /m всего)*100%
| Доли единицы или %
| -
|
| Объёмная доля компонента
| ῳ
| ῳ= V к /V всего
| Доли единицы или %
| -
|
| Плотность
| P
| p =m /V
| г/мл, кг/ м3
| г/мл
|
| Относительная плотность газов или паров
| D2
| D= Mr1 / Mr2
D возд.= Mr газа / 29
DH 2 = Mr газа / 2
| разы
| -
|
Справочные значения: NA =6,02*1023 частиц/моль; Vm (н.у.) = 22,4 л/моль;
Задания для решения
1)Найдите массовые части серы и кислорода в оксиде серы (VI).
2)Определите массовую долю алюминия в нитрате алюминия
3). Используятаблицу физических величин, выберите нужную формулу для расчета и найдите объем 0,5 моль газа (при н. у.)
Б. Расчеты по химическим уравнениям Примеры сложных задач:
Количественный метод
| 1.Прочитайте текст задачи.
| 1.Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей?
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|  2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2) 2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)
  m(CаO)=?
m(CаO)=?
|
| 3.Составьте уравнение химической реакции.
| 3.Решение:
CаСO3 = CаО + СO2
|
| 4.Массу чистого вещества (как и объём) можно вычислить двумя способами
1 способ:
ω (чист.вещ-ва)= 100% - ω прим.
ω (чист.вещ-ва) = m (чист.вещества) / m (смеси)
Отсюда:
m (чист.вещ-ва) = m (смеси) · ω (чист.вещ-ва)
2 способ:
m (примеси) = m (смеси) · ω (примеси)
m (чист.вещества) = m (смеси) - m (примеси)
| 4.Решение:
1 способ:
ω (чист.вещества) CаСO3= 100% - 20% = 80% или 0,8
m (чист.вещества) CаСO3= 400г · 0,8 = 320 г
2 способ:
m (примеси) = 400 г · 0,2 = 80 г
m (чист.вещества) CаСO3= 400 г – 80 г = 320 г
Выбирай понятный для тебя способ решения!
|
| 5.В уравнении одной чертой подчеркните формулы веществ, о которых идёт речь в задаче.
| 5. CаСO 3 = CаО + СO2
|
| 6.Вычислите молярные массы этих веществ.
| 6.
М(CаСO3) = 40 + 12 + 16·3 = 100 г/моль
М(СaO) = 40 + 16 = 56 г/моль
|
| 7.Массу чистого вещества, полученную в пункте 4, переведите в количество вещества по формуле ν= m/М
| 7. ν (CаСO3)= 320 г/100 г/моль = 3,2 моль
|
| 8.Над подчёркнутой формулой известного вещества укажите величину, полученную в пункте 7, - показывает количество взятого реагента по условию задачи, над формулой вещества, массу которого надо найти, поставим Х моль.
| 8. 3,2 моль Х моль
CаСO 3 = CаО + СO2
|
| 9. Под подчёркнутыми формулами исходного и образующегося веществ укажите количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед формулами веществ в уравнении реакции) - показывают необходимые количества исходного и образующегося веществ.
|
9. 3,2 моль Х моль
CаСO 3 = CаО + СO2
1моль 1моль
|
| 10.Составить и решить пропорцию.
| 10.
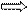 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль
      1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль. 1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
|
| 11.Вычислите массу продукта реакции
m(вещества)= ν(вещества) · М(вещества)
| 11.
m(СаО) =3,2 моль · 56 г/моль = 179,2 г
|
| 12.Запишите ответ.
| 12.Ответ:
m(CаО) = 179,2 г.
|
|
Метод пропорций
|
| 1. Повторить действия пунктов 1 – 6 количественного метода
|
|
| 2. По формуле m = М · ν (где ν – коэффициент перед соответствующей формулой вещества в уравнении реакции) найдите массу вещества
| m = М · ν
m(CаСO3) = 100 г/моль · 1 моль = 100 г
m(СaO) = 56 г/моль · 1 моль = 56 г
|
| 3. Над подчёркнутой формулой известного вещества укажите массу, полученную в пункте 4 количественного метода, над формулой вещества, массу которого надо найти, поставим Х г
| 3.
320 г Х г
CаСO 3 = CаО + СO2
|
| 4. Под соответствующей формулой записать массу, полученную в пункте 3
| 4.
320 г Х г
CаСO 3 = CаО + СO2
100 г 56 г
|
| 5. Составить и решить пропорцию
| 5.
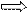 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г
|
| 6.Запишите ответ.
| 6.Ответ:
m(CаО) = 179,2 г.
|
| | | |
Задания для решения
1).Рассчитайте массу металла, полученного из 160г оксида меди (II).В качестве восстановителя используйте уголь.
2). Сколько кг хрома можно получить из 167,2кг оксида хрома (III), содержащего 10% примесей алюминотермическим способом.
6. Контроль знаний по теме. Итоговое задание по теме «Расчеты по химическим формулам и уравнениям». Каждый ученик получает карточку с задачами, которые он должен решить.
7. Домашнее задание. ОИ 1. С. 12-22, СРО 5
8. Источники и литература.
БПОУ ВО «БОРИСОГЛЕБСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
УЧЕБНО-МЕТОДИЧЕСКАЯ КАРТА
Специальность 33.02.01 «Фармация»; ОУД. 11 Химия
Тип занятия: Совершенствование знаний, умений; Выработка первичных практических умений
Форма проведения: Практическое занятие
Тема « Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией ».
Цели.
Учебная: познакомиться со способами разделения смесей: фильтрованием и дистилляцией, научиться разделять смеси с помощью фильтров, а также с помощью выпаривания.



 6. Полученный фильтрат вылейте в фарфоровую чашечку (возьмите подручный материал) и нагрейте до полного испарения воды (рис. 2). На стенках чашечки образуются кристаллики очищенной поваренной соли
6. Полученный фильтрат вылейте в фарфоровую чашечку (возьмите подручный материал) и нагрейте до полного испарения воды (рис. 2). На стенках чашечки образуются кристаллики очищенной поваренной соли

 2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)
2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)

 m(CаO)=?
m(CаO)=?
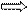 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль
3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль



 1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г
320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г



