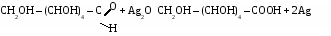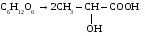Лабораторная работа№
Тема: Отношение жиров к воде и органическим растворителям. Доказательство непредельного характера жиров.
Цель работы: с помощью химического эксперимента закрепить свойства жиров
Оборудование: пробирки, подсолнечное масло, перманганат калия, р-р мыла, р-р порошка
Ход выполнения лабораторной работы
1. В три пробирки налейте по 1 мл дистиллированной воды, спирта и бензина и добавьте в них по 2-3 капли подсолнечного масла. Встряхните содержимое пробирок. В какой жидкости жиры растворяются лучше?
2. Несколько капель раствора жира в этиловом спирте и бензине нанесите на фильтровальную бумагу. Что наблюдаете после испарения растворителя?
3. Практически докажите, что в состав выданного вам растительного жира входят остатки непредельных кислот. Объясните свои действия.
1. После добавления подсолнечного масла в пробирки с жидкостями наблюдаем следующее:
в воде жидкости не смешались и смесь расслоилась. В спирте масло растворилось только лишь частично. В бензоле масло растворилось полностью, образовался однородный раствор.
2. После испарения растворителя на фильтровальной бумаге остались масляные пятна
3. В пробирку наливаем 2 мл растительного жира и добавляем несколько капель бромной воды. При этом произойдет обесцвечивание раствора (это событие является качественной реакцией на непредельные углеводороды)
Сравнение свойств растворов мыла и стирального порошка.
.
1. К 1-2 мл растворов мыла и стирального порошка в отдельных пробирках добавьте по 2-3 капли раствора фенолфталеина. Отметьте окраску раствора. Сделайте вывод, какое из моющих средств лучше использовать для стирки тканей, чувствительных к щелочи (например, шерстяных). 2. В две пробирки налейте по 3-4 мл жесткой воды (раствора солей кальция, например хлорида кальция CaCC12). В одну пробирку добавьте по каплям раствор мыла, а в другую-раствор стирального порошка. После внесения каждой капли содержимое пробирок взбалтывайте. В каком случае приходится прибавлять больше раствора для образования устойчивой пены? Какой препарат не утрачивает своей моющей способности в жесткой воде? Почему?
1. В обеих пробирках окрас раствора будет малиновым. Но пробирка с раствором стирального порошка имеет более интенсивный цвет, что говорит о более щелочной реакции среды. Поэтому ткани, чувствительные к щелочи, нужно стирать с мылом.
2. При взбалтывании пробирки с порошком образуется устойчивая пена. При взбалтывании пробирки с раствором мыла выпадают хлопья осадка. Т.е. для получения устойчивой пены требуется добавление большего количества мыльного раствора. Моющая способность не утрачивается даже в жесткой воде у раствора стирального порошка, потому что при этом не образуются нерастворимые соли кальция, в отличие от мыльного раствора
Контрольные вопросы:
1Какие вещества называются многоатомными спиртами? Приведите примеры спиртов.
2. Какие вещества называются карбоновыми кислотами? Приведите примеры высших карбоновых кислот (предельных и непредельных).
3. Какие вещества называются сложными эфирами и жирами?
4. Какие свойства характерны для сложных эфиров?
5. Что такое реакция этерификации?
Лекция Углеводы
План:
1. Значение углеводов. Общая характеристика.
2. Классификация углеводов.
3. Строение углеводов.
4. Синтез, распад и превращение углеводов в растении.
5. Динамика углеводов при созревании ПОВ.
Классификация углеводов.
Все углеводы разделяют на две группы – Монозы (моносахариды) и Полиозы (полисахариды)
Несколько молекул моносахаридов, соединяясь между собой с выделением воды, образуют молекулу полисахарида.
Моносахариды: Их можно рассматривать, как производные многоатомных спиртов.
Представители: глюкоза, фруктоза, галактоза, манноза.
Дисахариды: сахароза (тростниковый сахар), мальтоза (солодовый сахар) и целлобиоза.
Трисахариды: Рафиноза и др.
Тетрасахариды: стахиоза и др.
Ди-, три - и тетрасахариды (до 10 остатков моноз) составляют группу Полисахаридов первого порядка. Все представители этой группы легко растворимы в воде и в чистом виде являются кристаллическими веществами (олигосахариды).
Олигосахара (олигосахариды) могут быть гомо - и гетеросахара. Сахароза состоит из глюкозы и фруктозы – фуран (гетеросахар). Лактоза – галактоза + глюкоза. Мальтоза, трегалоза, целлобиоза – Глюкоза + глюкоза (гомосахара), отличаются расположением атомов углерода, участвующих в связи между молекулами моносахаров.
Более сложные углеводы – Полисахариды второго порядка. Сложные вещества с очень большой молекулярной массой. В воде либо не растворяются совсем, либо дают вязкие, коллоидные растворы.
Представители: слизи, крахмал, декстрины, гликоген, клетчатка, гемицеллюлозы, пектиновые вещества, инулин, каллоза и др.
Строение углеводов.
Моносахариды, содержащие по три углеродных атома, принадлежат к группе Триоз, с четырьмя – Тетроз, с пятью – Пентоз, шестью – Гексоз и семью – Гептоз.
Наиболее важными и распространенными в природе являются пентозы и гексозы.
Моносахариды, производные многоатомных спиртов – содержат в своей молекуле наряду со спиртовыми группами –ОН альдегидную или кетогруппу.
Триозы:
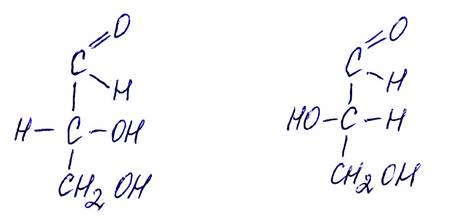
Правовращающийся Левовращающийся
D-глицериновый альдегид L-глицериновый альдегид
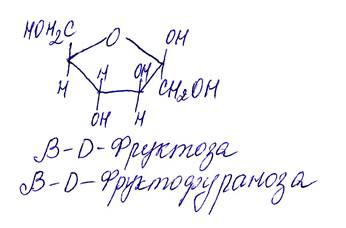
Фруктоза относится к пентозам, глюкоза к гексозам.
Установлено, что в растворах D-глюкоза существует в трех взаимопревращающихся формах, две из которых циклические.
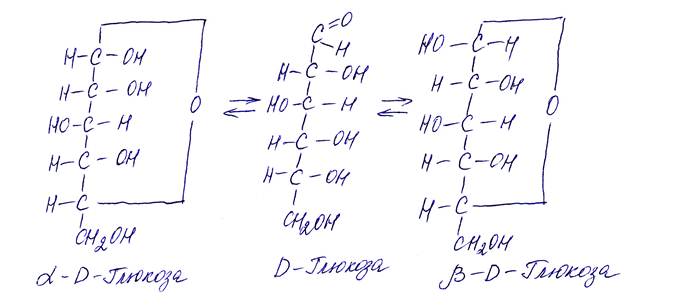

Аналогичные взаимопревращения трех форм установлены также и для других моносахаридов.
Дисахариды:
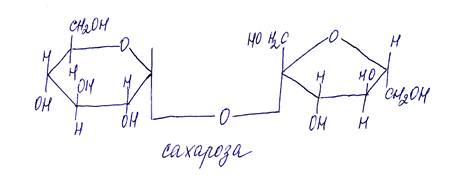
Полисахариды:
Имеют линейную или разветвленную структуру, полимерные молекулы их состоят из мономеров (моносахаридов), соединенных между собой в длинные цепочки.
ГЛЮКОЗА
1. Физические свойства.
Твердое, белое f кристаллическое вещество, вкус сладкий, растворима в воде.
2. Строение молекулы.

Глюкоза - альдегидоспирт.

3. Химические свойства.
3.1 Глюкоза как многоатомный спирт реагирует без нагревания с гидроксидом меди, при этом образуется темно-синий раствор глюконата меди.
3.2 Реакции по альдегидной группе.
а) реакция «серебряного зеркала»
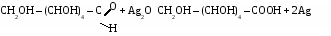
б) с гидроксидом меди

-
3. Брожение глюкозы.
а) спиртовое
С6Н12О6 → 2С2Н5ОН + 2СО2↑
б)молочнокислое
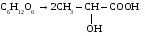
в) маслянокислое
С6Н12О6 → С3Н7СООН + 2СО2↑ + 2Н2↑
3.4 Полное окисление глюкозы.
С6Н12О6 + 6О2 → 2СО2 + 6Н2О
4. Получение и применение глюкозы.
(С6Н10О5)n + nН2О → nС6Н12О6
крахмал
Глюкоза используется в медицине, для получения этанола, при изготовлении зеркал.
ФРУКТОЗА.
Фруктоза является изомером глюкозы.

Фруктоза - кетоноспирт. Вместе с глюкозой входит в состав меда, имеет более сладкий вкус, чем глюкоза.
Задача. Сколько литров раствора этанола (плотность 0,79) с массовой долей С2Н5OH 95 %получится при спиртовом брожении 36 кг глюкозы?
САХАРОЗА.
Физические свойства.
Сахароза - твердое, белое, кристаллическое вещество, растворима в воде, вкус сладкий.
Сахароза в природе.
Сахароза входит в состав сока многих растении. Например, в соке сахарного тростника ее 14-16 %, а в соке сахарной свеклы 16-21 %.
Химические свойства.
1. Гидролиз.
С12Н22О11 + Н2О С6Н12О6 + С6Н12О6
глюкоза фруктоза
- Сахароза как многоатомный спирт реагирует с гидроксидом меди, при этом образуется: ярко-синий раствор сахарата меди.
- Сахароза реагирует с гидооксидом калция. Это свойство лежит в основе получения сахара их свеклы и его дальнейшей очистки.
С12Н22О11 + 2СА(ОН)2 → С12Н22О11 · 2СаО + Н2О
сахарат кальция
С12Н22О11 · 2СаО + 2СО2 → С12Н22О11 + 2 СаСО3↓
Применение сахарозы.
Сахароза используется в кондитерском производстве и для получения, этилового спирта.
КРАХМАЛ.
Крахмал - природный полимер, макромолекулы которого состоит из остатков α-глюкозы и имеют в основном разветвленное строение.
Физические свойства.
Крахмал - твердое, белое, аморфное вещество без вкуса и запаха. Крахмал нерастворим в холодной воде, в горячей воле образует коллоидный раствор (клейстер).
Крахмал в природе.
Крахмал является одним из продуктов фотосинтеза и поэтому широко распространена в природе. Зерна риса содержат до 86 %крахмала, пшеницы до 75 %, кукурузы - до 72 %. Вклубнях картофеля содержание крахмала достигает 24 %.
Химические свойства.
1. Гидролиз
(С6Н10О5)n + nН2О nС6Н12О6
2. Качественная реакция на крахмал.
Реактивом на крахмал является раствор йода. Результат реакции - синее окрашивание.
Применение крахмала.
Крахмал является одним из важнейших компонентов пищи. Значительное количество крахмала перерабатывается на патоку, глюкозу, пищевой спирт, молочную кислоту. Крахмал используют в текстильной промышленности дляотделки тканей.
Задача. Какую массу кукурузных зерен надо взять для получения спирта массой 115 кг, с массовой долей C2H5OH 96 %, если массовая доля крахмала в кукурузных зернах составляет 70 %?
ЦЕЛЛЮЛОЗА (КЛЕТЧАТКА).
Целлюлоза - природный полимер, макромолекулы которого состоят из остатков /3 -глюкозы и имеют линейное строение.
Физические свойства.
Целлюлоза - твердое, белое, аморфное вещество без вкуса и запаха. Она нерастворима в воде и органических растворителях, но растворима в аммиачном растворе сульфата меди.
Химические свойства.
1. Гидролиз
(С6Н10О5)n + nН2О nС6Н12О6
2. Образование сложных эфиров.
[С6Н7О2(OH)3]n + 3nНNО3 [С6Н7О2(ONO2)3]n + 3nН2О
тринитрат целлюлозы
[С6Н7О2(OH)3]n + 3nСН3СООН → [С6Н7О2(OСОСН3)3]n + 3nН2О
триацетат целлюлозы
Целлюлоза в природе.
Целлюлоза является основной частью стенок растений, Относительно чистой целлюлозой являются волокна хлопчатника. Древесина содержит от 40 до 50 %целлюлозы.
Применение целлюлозы.
Из целлюлозы изготавливают искусственные волокна, полимерные пленки, пластмассы, бездымный порох, бумагу.
Образование крахмала и клетчатки в зеленых растениях.
6СО2 + 6Н2О С6Н12О6 + 6О2
nС6Н12О6 → (С6Н10О5)n + nН2О
Образование глюкозы и фруктозы из сорбита.
Наряду с моносахаридами в листьях на свету чрезвычайно быстро образуются также сахароза (дисахарид) и крахмал (полисахарид), однако это вторичный процесс ферментативных превращений ранее образовавшихся моносахаридов (может происходить в полной темноте). Сахароза синтезируется из глюкозы и фруктозы, а также из других гексоз. Из пентоз (арабиноза, ксилоза) сахароза не синтезируется.
Распад.
Большинство моносахаридов сбраживаются дрожжами.
Олигосахара распадаются под действием соответствующих ферментов и при гидролизе (нагревании в присутствии кислот).
Полисахариды второго порядка:
Крахмал (состоит из амилозы и амилопектина, их соотношение в крахмале разных растений различно) – распадается под действием фермента Глюкозоамилазы и при гидролизе на молекулы глюкозы; Гликоген (аналогично).
Клетчатка (целлюлоза) – переваривается только у жвачных животных бактериями, содержащими фермент Целлюлазу.
Гемицеллюлозы гидролизуются кислотами легче, чем клетчатка.
Взаимопревращения.
В растениях сахариды чрезвычайно легко превращаются друг в друга.
Взаимопревращения моносахаридов происходят в результате действия соответствующих ферментов, катализирующих реакции фосфорилирования и образования фосфорных эфиров сахаров.
Под действием изомераз происходят превращения моносахаров друг в друга.
В растительных организмах обнаружены также ферменты, катализирующие образование фосфорных эфиров сахаров и их взаимные превращения.
Крахмал, накапливающийся в листьях при фотосинтезе, может очень быстро превращаться в сахарозу (важнейшая транспортная форма углеводов), перетекать в виде сахарозы в семена, плоды, клубни, корнеплоды и луковицы, где сахароза снова превращается в крахмал и инулин. В этих процессах амилаза не принимает никакого участия (работают другие ферменты и гидролиз).
Лабораторная работа№24
Тема:Свойства глюкозы.
Цель работы: с помощью химического эксперимента закрепить свойства углеводов
Оборудование: пробирки, р-р глюкозы, гидроксид натрия, сульфат меди, нитрат серебра, водный р-р аммиака.
Порядок выполнения
1. В пробирку к 3-4 каплям раствора сульфата меди (II) прилейте 2-3 мл раствора гидроксида натрия. К полученному осадку прилейте равный объем раствора глюкозы и смесь взболтайте. Как изменилась окраска раствора? Почему?
2. Нагрейте содержимое пробирки. Какие изменения наблюдаются? О наличии какой функциональной группы в молекуле глюкозы говорит этот опыт? Составьте уравнение реакции окисления глюкозы гидроксидом меди (II).
3. К аммиачному раствору оксида серебра (I), налитому в чистую пробирку, добавьте в два раза меньше раствора глюкозы. Нагрейте смесь осторожно над пламенем спиртовки (нагрев должен быть равномерным и медленным). Объясните наблюдаемое явление.
Контрольные вопросы
.Какой класс веществ содержит карбоксильную группу?
3.Какой класс веществ содержит гидроксильную группу?
4.Какой класс веществ содержит альдегидную группу?
5.Какой класс веществ содержит карбонильную группу?
6.В каких классах веществ радикалы соединяются через кислород?
7.При помощи какого реактива можно определить альдегидную группу
Лабораторная работа№
Тема: Отношение жиров к воде и органическим растворителям. Доказательство непредельного характера жиров.