Незаменимые жирные кислоты
· α-линоленовая кислота (омега-3 жирная кислота с кратчайшей цепочкой),
· линолевая кислота (омега-6 жирная кислота с кратчайшей цепочкой).
История открытия и изучения витаминов. Классификация витаминов. Функции витаминов.
Важность некоторых видов еды для предотвращения определённых болезней была известна ещё в древности. Так, древние египтяне знали, что печень помогает от куриной слепоты. Ныне известно, что куриная слепота может вызываться недостатком витамина A.
В 1330 году в Пекине монгол Ху Сыхуэй опубликовал трёхтомный труд «Важные принципы пищи и напитков», систематизировавший знания о терапевтической роли питания и утверждавший необходимость для здоровья комбинировать разнообразные продукты.
В 1747 году шотландский врач Джеймс Линд (James Lind) открыл свойство цитрусовых предотвращать цингу. В 1753 году он опубликовал трактат «Лечение цинги». Однако эти взгляды получили признание не сразу. Тем не менее Джеймс Кук на практике доказал роль растительной пищи в предотвращении цинги, введя в корабельный рацион кислую капусту. В результате он не потерял от цинги ни одного матроса — неслыханное достижение для того времени.
В 1795 лимоны и другие цитрусовые стали стандартной добавкой к рациону британских моряков. Это послужило появлением крайне обидной клички для матросов — лимонник. Известны т. н. лимонные бунты: матросы выбрасывали за борт бочки с лимонным соком.
В 1880 году русский биолог Николай Лунин из Тартуского университета скармливал подопытным мышам по отдельности все известные элементы, из которых состоит коровье молоко: сахар, белки, жиры, углеводы, соли. Мыши погибли. В то же время мыши, которых кормили молоком, нормально развивались. В своей диссертационной (дипломной) работе Лунин сделал вывод о существовании какого-то неизвестного вещества, необходимого для жизни в небольших количествах. Вывод Лунина был принят в штыки научным сообществом. Другие учёные не смогли воспроизвести его результаты. Одна из причин была в том, что Лунин использовал тростниковый сахар, в то время как другие исследователи использовали молочный сахар, плохо очищенный и содержащий некоторое количество витамина B.
В последующие годы накапливались данные, свидетельствующие о существовании витаминов. Так, в 1889 году голландский врач Христиан Эйкман обнаружил, что куры при питании варёным белым рисом заболевают бери-бери, а при добавлении в пищу рисовых отрубей — излечиваются.
Роль неочищенного риса в предотвращении бери-бери у людей открыта в 1905 году Уильямом Флетчером. В 1906 году Фредерик Хопкинс предположил, что помимо белков, жиров, углеводов и т. д. пища содержит ещё какие-то вещества, необходимые для человеческого организма, которые он назвал «accessory factors». Последний шаг был сделан в 1911 году польским учёным Казимиром Функом(Casimir Funk), работавшим в Лондоне. Он выделил кристаллический препарат, небольшое количество которого излечивало бери-бери. Препарат был назван «Витамайн» (Vitamine), от латинского vita — жизнь и английского amine — амин, азотсодержащее соединение. Функ высказал предположение, что и другие болезни — цинга, пеллагра,рахит — тоже могут вызываться недостатком каких-то веществ.
В 1920 году Джек Сесиль Драммонд предложил убрать «e» из слова «vitamine», потому что недавно открытый витамин C не содержал аминового компонента. Так витамайны стали витаминами.
В 1929 году Хопкинс и Эйкман за открытие витаминов получили Нобелевскую премию, а Лунин и Функ — не получили. Лунин стал педиатром, и его роль в открытии витаминов была надолго забыта. В 1934 году в Ленинграде состоялась Первая всесоюзная конференция по витаминам, на которую Лунин (ленинградец) не был приглашён.
В 1910-е, 1920-е и 1930 годы были открыты и другие витамины. В 1940 годы была расшифрована химическая структура витаминов.
По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы.
Водорастворимые
· Витамин В1 (тиамин);
· Витамин В2 (рибофлавин);
· Витамин РР (никотиновая кислота, никотинамид, витамин В3);
· Пантотеновая кислота (витамин В5);
· Витамин В6 (пиридоксин);
· Биотин (витамин Н);
· Фолиевая кислота (витамин Вс, В9);
· Витамин В12 (кобаламин);
· Витамин С (аскорбиновая кислота);
· Витамин Р (биофлавоноиды).
Жирорастворимые
· Витамин А (ретинол);
· Витамин D (холекальциферол);
· Витамин Е (токоферол);
· Витамин К (филлохинон).
Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма.
Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство обиена веществ, называемое гипервитаминозом, и даже гибель организма.
Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организм наступают характерные и опасные патологические изменения. Большинство витаминов не синтезируются в организме человека. Поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз.
ЗЗ. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы. Примеры.
С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина — гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз.
Алиментарный авитаминоз - заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины.
Вторичный авитаминоз (эндогенный) – заболевание, связанное с нарушением процессов пищеварения или нарушением работы органов, связанных непосредственно с пищеварением, поступлением в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови, особенностями обмена веществ в пожилом и детском возрасте.
Гиповитаминоз - болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; то же, что витаминная недостаточность. Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно: появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит, нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность, сказывается на состоянии отдельных органов и тканей (кожа, слизистые, мышцы, костная ткань) и важнейших функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода, защитные силы организма.
Гипервитаминоз — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих лекарствах). Чаще всего, гипервитаминозы вызываются приёмом резко повышенных доз жирорастворимых витаминов.
Примеры авитаминозов:
· Авитаминоз С (Цинга) - недостаток витамина C приводит к нарушению синтеза коллагена, соединительная ткань теряет свою прочность. Симптомы — вялость, быстрая утомляемость, ослабление мышечного тонуса, ревматоидные боли в крестце и конечностях (особенно нижних), расшатывание и выпадение зубов; хрупкость кровеносных сосудов приводит к кровоточивости дёсен, кровоизлияниям в виде тёмно-красных пятен на коже. При полном прекращении поступления аскорбиновой кислоты в организм цинга развивается примерно через 4–12 недель; при гиповитаминозе С клинические проявления менее выражены и появляются в более поздние сроки, обычно через 4–6 месяцев.
· Авитаминоз В1(Бери-бери) - Витамин В1, называемый также тиамином, способствует нормальному протеканию процессов углеводного и жирового обмена. Его дефицит приводит к накоплению в крови человека пировиноградной кислоты и её повышенной концентрации в нервной системе. Последствием такого биохимического нарушения обмена веществ является энцефалопатия Вернике (острое поражение среднего мозга) или полиневрит (поражения нервной системы). Поражения локализуются в периферических нервах и характеризуются развитием в них дегенеративных явлений типа паренхиматозного неврита.
· Авитаминоз D (Рахит) - специфическая функция витамина D заключается в регуляции процессов всасывания кальция, фосфора в кишечнике и отложения их в костную ткань, а также реабсорбции кальция и фосфатов в почечных канальцах. При дефиците витамина D происходит нарушение фосфорно-кальцивого обмена, в результате чего происходит нарушение образования костей и недостаточность их минерализации. Нарушения фосфорно-кальциевого обмена приводят к снижению окислительных процессов, развитию ацидоза в кости, углубляющего изменения клеточного метаболизма и нарушающего нормальный процесс обызвествления хрящевой и остеоидной ткани.
Примеры гипервитаминозов:
· Гипервитаминоз А - протекает в виде двух форм: Острый - при однократном приеме в пищу большого количества продуктов, содержащих витамин А (печень белого медведя, кита, моржа). Протекает по типу интоксикации (острого отравления). Хронический - развивается, преимущественно у детей, при длительном приеме внутрь витамина А в максимально допустимых суточных дозах. Проявляется в виде каротинемии. В отличие от желтухи при каротинемии отмечается желтушность кожных покровов и ладонных поверхностей кисти. В крови повышается уровень холестерина и ретинола. Наблюдаются органические изменения в печени.
· Гипервитаминоз D - при гипервитаминозе D активная форма витамина стимулирует остеокласты, усиливает всасывания кальция в кишечнике, стимулирует реабсорбцию, что вызывает гиперкальциемию, а также остеопороз. Избыток 1,25-дигидроксихолекальциферола приводит к повреждению мембран клеток и органелл. При разрушении лизосом высвобождаются и поступают в цитоплазму их ферменты. В первую очередь изменения возникают в почках и печени. Гиперкальциемия ведёт к кальцинозу крупных сосудов и клапанов сердца.
Уровни структурной организации живого. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская биохимия).
Жизнь имеет следующие уровни организации:
1. Молекулярный уровень - отражает особенности химизма живого вещества, а также механизмы и процессы передачи генной информации
2. Клеточный и субклеточный уровни - отражают особенности специализации клеток, а также внутриклеточные структуры. На этом уровне происходят процессы жизнедеятельности (обмен веществ, питание, дыхание, раздражимость и т. д.)
3. Организменный и органно - тканевый уровни - отражают признаки отдельных особей, их строение, физиологию, поведение, а также строение и функции органов и тканей живых существ
4. Популяционно - видовой уровень - образуется свободно скрещивающимися между собой особями одного и того же вида, совокупность особей одного вида
5. Уровень биогеоценозов - структуры, состоящие из участков Земли с определенным составом живых и неживых компонентов, представляющих единый природный комплекс – экосистему
6. Биосферный - вся совокупность живых организмов Земли вместе с окружающей их природной средой
Молекулярный уровень выступает основой для всей жизнедеятельности любого организма на планете, это уровень функционирования биологических макромолекул - биополимеров: нуклеиновых кислот, белков, полисахаридов, липидов, стероидов. На молекулярном уровне происходят различные процессы жизнедеятельности живых организмов: обмен веществ, превращение энергии, формирование биопотенциалов клетки. С помощью молекулярного уровня осуществляется передача наследственной информации, образуются отдельные органоиды, происходят ферментативные процессы. Понимание химических процессов, происходящих в организме – является одной из ключевых задач биологической химии, поэтому она выступает на молекулярном уровне организации живого.
Биохимия оказывает все более глубокое воздействие на медицину. Так, например, определение активности ферментов играет в настоящее время важную роль в клинической диагностике. Содержание определенных ферментов в сыворотке крови может служить ценным критерием при диагностике недавно перенесенного инфаркта миокарда. Кроме того, биохимия постепенно создает основу для рационального назначения лекарственных препаратов. Исключительную важность представляет выяснение молекулярных механизмов некоторых заболеваний, например серповидно-клеточной анемии или большого числа врожденных нарушений метаболизма, исследованных к настоящему времени. Быстрое развитие биохимии в последние годы позволило исследователям приступить к изучению самых острых, коренных проблем биологии и медицины.
5. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология.
Биохимия включает в себя:
1) Биоорганическая химия - изучает вещества, лежащие в основе процессов жизнедеятельности, в непосредственной связи с познанием их биологической функции. Основные объекты БОХ — биополимеры, превращения которых составляют химическую сущность биологических процессов, и биорегуляторы, которые химически регулируют обмен веществ. БОХ занимается получением этих веществ в химически чистом состоянии, установлением строения, синтезом, выяснением зависимостей между строением и биологическими свойствами, изучением химических аспектов механизма биологического действия биополимеров, а также природных и синтетических биорегуляторов. Характерная особенность БОХ. — использование всего комплекса химических и физических методов индивидуализации веществ и выяснение их строения.
2) Динамическая биохимия - раздел биохимии, изучающий обмен веществ в организме от момента поступления в него питательных веществ до образования конечных продуктов обмена, механизмы нейтрализации токсических продуктов, выведения их из организма и регуляции скорости соответствующих превращений.
3) Функциональная биохимия - раздел биохимии, изучающий химические превращения, лежащие в основе функций органов, тканей и организма в целом.
4) Молекулярная биология - наука, ставящая своей задачей познание природы явлений жизнедеятельности путём изучения биологических объектов и систем на уровне, приближающемся к молекулярному, а в ряде случаев и достигающем этого предела. Конечной целью при этом является выяснение того, каким образом и в какой мере характерные проявления жизни, такие, как наследственность, воспроизведение себе подобного, биосинтез белков, возбудимость, рост и развитие, хранение и передача информации, превращения энергии, подвижность и т. д., обусловлены структурой, свойствами и взаимодействием молекул биологически важных веществ, в первую очередь двух главных классов высокомолекулярных биополимеров.
6. История изучения белков. Представление о белках как важнейшем классе органических веществ и структурно-функциональном компоненте организма человека.
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы.
Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу.
Термин «протеин» для обозначения подобных молекул был предложен в 1838 году шведским химиком Якобом Берцелиусом. Мульдер также определил продукты разрушения белков — аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу — 131 дальтон.
В 1836 Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа «протеин», а теория — «теорией протеина». По мере накопления новых данных о белках теория стала неоднократно подвергаться критике, но до конца 1850-х несмотря на критику ещё считалась общепризнанной.
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков.
В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза. Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий.
В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы.
Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов.
Белки́(протеи́ны,полипепти́ды ] ) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью α-аминокислот. Для живых организмов характерны широкое разнообразие белковых структур и их высокая упорядоченность; последняя существует во времени и пространстве. Удивительная способность живых организмов к воспроизведению себе подобных также связана с белками. Сократимость, движение – непременные атрибуты живых систем – имеют прямое отношение к белковым структурам мышечного аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т.е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков – ферментов.
Таким образом, белки (белковые вещества) составляют основу и структуры, и функции живых организмов. Подсчитано, что в природе примерно 1010–1012 различных белков, обеспечивающих существование около 106 видов живых организмов различной сложности организации начиная от вирусов и кончая человеком. Каждый организм характеризуется уникальным набором белков. Фенотипические признаки и многообразие функций обусловлены специфичностью объединения этих белков, во многих случаях в виде над- и мультимолекулярных структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
20.История открытия и изучения ферментов. Особенности ферментативного катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации фермента и субстрата.
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках. Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено еще несколько ферментов, и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila.Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК.
Важнейшие особенности ферментативного катализа - эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость превращения субстрата по сравнению с неферментативной реакцией в 109-1012 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активационный барьер. Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или несколько близких по структуре веществ. Специфичность определяется топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, которы катализируют идентичные реакции, но отличаются строением и каталитическими свойствами), а также условиями среды (рН, температура, ионная сила раствора) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты реакции, а также конечные продукты в цепи последовательных превращений вещества Ферментативные реакции чувствительны к внешним условиям, в частности к ионной силе раствора и рН среды. Влияние температуры на скорость ферментативной реакции описывается кривой с максимумом, восходящая ветвь которой отражает обычную для химической реакций зависимость, выраженную уравнением Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента.
Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться". В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя фермент-субстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением:
Е + S ↔ ES ↔ ЕР ↔ Е + Р,
где Е - фермент (энзим), S - субстрат, Р - продукт.
Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра. Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
1. абсолютную субстратную специфичность;
2. групповую субстратную специфичность;
3. стереоспецифичность.
Абсолютная субстратная специфичность. Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало.
Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов.
Стереоспецифичность При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них.
Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата.
Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, рН раствора, присутствие регуляторных молекул (активаторов и ингибиторов).
Зависимость скорости ферментативной реакции от количества ферментов. При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.  .
.
Количество единиц активности nME определяют по формуле:
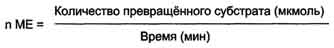
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с.
Международная единица ферментативной активности ME связана с каталом следующими равенствами:
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани.
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.
Зависимость скорости ферментативной реакции от температуры среды. Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы.
Зависимость скорости ферментативной реакции от рН среды Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
Зависимость скорости ферментативной реакции от количества субстрата. Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Ферментативный процесс можно выразить следующим уравнением:

где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
29.Обмен веществ: питание, метаболизм и выделение продуктов метаболизма. Органические и минеральные компоненты пищи. Основные и минорные компоненты.
Условно процесс обмена веществ можно разделить на три этапа:
Первый этап — ферментативное расщепление белков, жиров и углеводов до растворимых в воде аминокислот, моно- и дисахаридов, глицерина, жирных кислот и других соединений, происходящее в различных отделах желудочно-кишечного тракта, и всасывание их в кровь и лимфу.
Второй этап — транспорт питательных веществ кровью к тканям и клеточный метаболизм, результатом которого является их ферментативное расщепление до конечных продуктов. Часть этих продуктов используется для построения составных частей мембран, цитоплазмы, для синтеза биологически активных веществ и воспроизведения клеток итканей. Расщепление веществ сопровождается выделением энергии, которая используется для процесса синтеза и обеспечения работы каждого органа и организма в целом.
Третий этап — выведение конечных продуктов метаболизма в составе мочи, кала, пота, через легкие в виде CO2 и т. д
Для обеспечения всех этапов метаболизма организму необходимо питаться.
Современные исследования подтверждают жизненную важность минеральных элементов. Выявлены новые стороны их биологического действия, что позволило выделить большую группу биологически активных веществ - биомикроэлементов. Изучение минеральных веществ как необходимой составной части питания тесно связано c предупреждением распространения и ликвидацией ряда эндемических заболеваний: эндемического зоба, флюороза, кариеса, стронциевого рахита и др. Значительный вклад в развитие учения o биологическом значении минеральных элементов внесли исследования акад, B. И. Вернадского, который является основоположником учения о связи и сочетанности эволюционных процессов в химическом составе, происходящих в земной коре и организмах. B изучении роли минеральных элементов в возникновении некоторых эндемических заболеваний видное место занимают исследования акад. A. П. Виноградова, который создал учение о "биогеохимических провинциях", т. e. территориях c повышенным или недостаточным содержанием микроэлементов. Физиологическое значение минеральных элементов в основном определяется их участием в:
1. структуре и функции большинства ферментных систем и процессов, протекающих в организме;
2. пластических процессах и построении тканей организма, особенно костной ткани, где фосфор и кальций являются основными структурными компонентами;
3. поддержании кислотно-щелочного сост



 .
.



