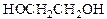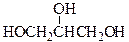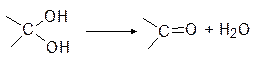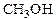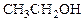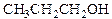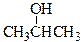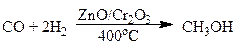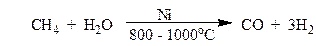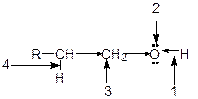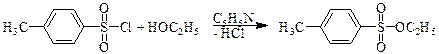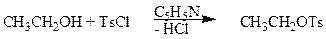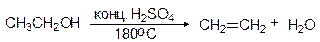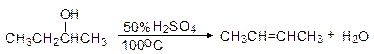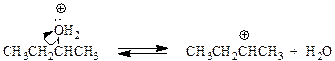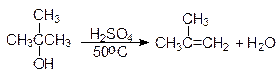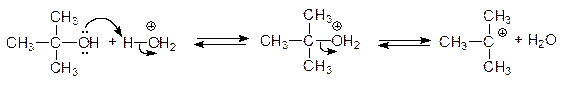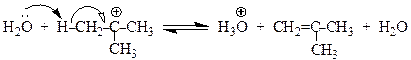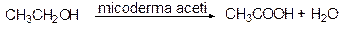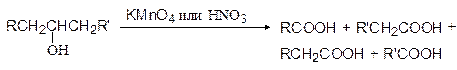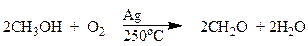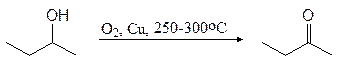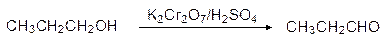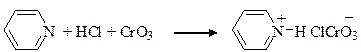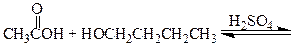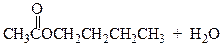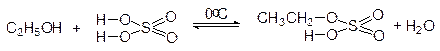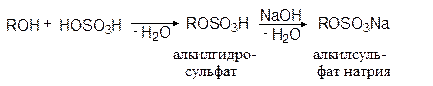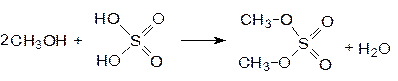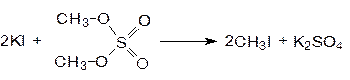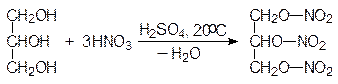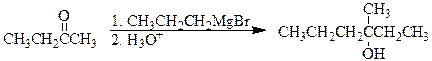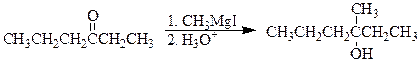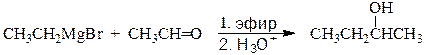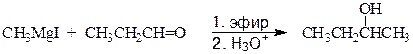20.03.12
Оглавление
Введение 2
1. Источники спиртов 3
А. Синтез спиртов из алкенов 4
Б. Синтез спиртов из металлоорганических соединений 4
В. Синтез спиртов из галогеноуглеводородов 6
Г. Восстановление альдегидов, кетонов и эфиров кислот 6
2. Реакции спиртов 7
2.1. Кислотно-основные свойства спиртов 8
2.2. Реакции замещения гидроксильной группы 8
А. Реакции с галогеноводородами 8
Б. Действием галогенидов фосфора 10
Г. Действием тионилхлорида 11
Д. Образование алкилтозилатов 11
2.3. Дегидратация спиртов 11
3. Окисление спиртов 13
4. Реакции спиртов с кислотами 14
ВВЕДЕНИЕ
Спирты представляют собой соединения общей формулы ROH, в которых гидроксильная группа присоединена к насыщенному атому углерода. По номенклатуре ИЮПАК насыщенные спирты называют алканолами, нумерация в которых определяется гидроксильной группой. Гидроксильная группа при наличии двойной и тройной связей является старшей.При нумерации атомов главной цепи спиртов гидроксильная группа имеет преимущество перед алкильными группами, атомами галогенов и кратной связью.
В зависимости от того, является ли атом углерода, к которому присоединена гидроксильная группа, первичным 1о, вторичным 2о или третичным 3о спирты бывают 1о (RCH2OH), 2о (R2CHOH) или 3о (R3COH). Например, из четырех возможных бутиловых спиртов два – н-бутиловый и изобутиловый являются первичными 1о, втор -бутиловый - вторичным 2о и трет -бутиловый – третичным 3о.
Число гидроксильных групп в молекуле определяет так называемую атомность спирта. По числу гидроксильных групп в молекуле спирты подразделяются на одноатомные, двухатомные, трехатомные и т.д. спирты. Например, этанол является одноатомным спиртом, этиленгликоль _ двухатомным, а глицерин _ трехатомным.
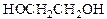
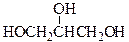
этиленгликоль глицерин
Гидроксильные группы могут находиться лишь у разных атомов углерода (правило Эрленмеера). Если две гидроксильные группы оказываются у одного атома углерода, то они немедленно отщепляют воду:
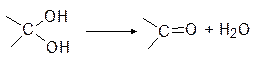
Если гидроксильная группа оказывается присоединенной к атому углерода соединенному с другим атомом углерода кратной связью, ее атом водорода немедленно перемещается к атому углерода:

Спирты находят широкое практическое применение. Они производятся в значительных количествах и используются в качестве полупродуктов для синтеза различных органических соединений. Диолы и глицерин применяются в производстве лекарственных препаратов, полимеров (полиэфиры, полиуретаны, полиамиды), взрывчатых веществ, пластификаторов. Спирты используются как растворители красок и полимеров, являются главными компонентами антифризов, гидравлических жидкостей, эмульгаторов, смазок, входят в состав парфюмерных изделий и медицинских препаратов. Глицерин является структурным компонентом животных и растительных жиров и масел, а также липидов животных тканей. Он играет важную роль в обмене веществ животного организма.
Некоторые спирты являются компонентами природных душистых веществ, например, фенэтиловый спирт является главным летучим компонентом розового масла. Хорошо известны такие природные спирты как гераниол, ментол и ретинол (витамин А).
Физические свойства низших спиртов в значительной степени определяются полярностью гидроксильной группы и ее способностью участвовать в образовании водородной связи, что приводит к их относительно высокой температуре кипения и к хорошей растворимости в воде.
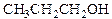
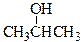
Т. кип., oC 64,7 78,3 97,2 82,3
Спирты кипят при значительно более высокой температуре, чем, например, алканы с близкой или даже большей молекулярной массой (М): например, бутан С4H10 (М = 58) кипит при 4оС, а метиловый спирт СН3ОН (М = 32) - при 64оС. Это объясняется тем, что молекулы спиртов ассоциированы за счет образования водородных связей. Образование ассоциатов с водой объясняет высокую растворимость низших спиртов в воде. Ассоциаты спиртов имеют следующее строение:

В способности спиртов к ассоциации одновременно проявляются их кислотные и основные свойства.
Источники спиртов
Основные способы получения спиртов уже рассматривались при обсуждении реакционной способности алкенов и алкилгалогенидов. Особенно следует выделить получение метанола и этанола.
Метиловый спирт, он же метанол, он же древесный спирт, обнаруженный впервые в середине ХVII века, выделенный в чистом виде в 1834 г., синтезированный в 1857 г., - один из старейших продуктов химической индустрии. Поначалу его получали сухой перегонкой древесины, а в 1923 г. начала работать первая заводская установка, на которой метанол синтезировали из водорода и окиси углерода. По объему производства метанол стоит на первом месте среди вторичных нефтехимических продуктов.
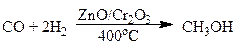
окись углерода метанол
Смесь моноксида углерода с водородом называют синтез газом. Его получают из природного газа.
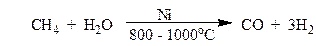
Метанол токсичен: его употребление, вдыхание паров или нахождение на коже в течение длительного времени вызывает слепоту или приводит к смертельному исходу.
Еще в древности было обнаружено, что при брожении многих растительных продуктов образуются алкогольные напитки, но лишь сравнительно недавно стало известно, что активным началом в них является этиловый спирт.

В дрожжах имеются энзимы, вызывающие превращение сахаров в спирты. Ферментацией кроме этилового спирта можно получать спирты С3, C4 и С5.
Реакции спиртов
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. В молекуле спиртов можно выделить следующие реакционные центры:
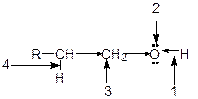
- ОН-кислотный центр, обусловливающий возможность отщепления протона вследствие высокой полярности связи О-Н;
- нуклеофильный и n -основный центр - атом кислорода, имеющий неподеленные пары электронов;
- электрофилный центр - a-атом углерода, на котором дефицит электронов вызван - I -эффектом соседней гидроксильной группы;
- b-С-кислотный центр, в котором поляризация связи. С-Н также обусловлена электроноакцепторным влиянием гидроксильной группы.
Д. Образование алкилтозилатов
Еще один путь превращения гидроксильной группы спиртов в хорошую уходящую группу - превращение их в тозилаты. Спирты реагируют с п -толуолсульфонилхлоридом (тозилхлоридом Тs¾Cl) превращаясь в алкилтозилаты.
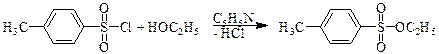
п -толуолсульфонилхлорид этил- п -толуолсульфонат
или
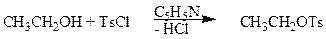
тозилхлорид этилтозилат
Алкилтозилаты вступают во все реакции нуклеофильного замещения. Из них, например, могут быть получены различные галогензамещенные углеводороды. Для этого спирты сначала превращают в алкилтозилаты, которые легко могут быть выделены и очищены. Далее тозилатную группу замещают на другую функциональную группу.
Дегидратация спиртов
Спирты могут быть превращены в алкены путем дегидратации (отщепления или элиминирования воды) от соседних атомов углерода. В лаборатории дегидратацию проводят путем нагревания спиртов с концентрированной серной или 85% фосфорной кислотой.
Условия проведения реакции зависят от строения спирта. Наиболее трудно дегидратируются первичные спирты, наиболее легко - третичные
Первичные спирты дегидратируются по механизму E2 в довольно жестких условиях - 170 - 200оС с использованием концентрированной серной кислоты.
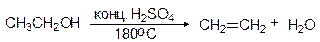
Механизм Е2


Дегидратация вторичных спиртов происходит по механизму Е 1 при температуре 100 - 150оС с менее концентрированными кислотами. Отщепление воды протекает согласно эмпирическому правилу Зайцева: протон отщепляется предпочтительно от наименее гидрогенизированного b-атома углерода. Иными словами, двойная связь образуется у наиболее замещенного атома углерода:
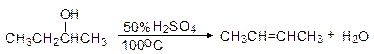

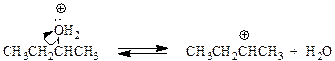

Еще легче отщепляют воду третичные спирты - 50 - 100оС в присутствии более мягких дегидратирующих агентов (разбавленная серная кислота, щавелевая или п -толуолсульфоновая кислота):
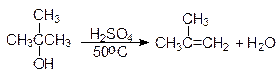
Дегидратация третичных спиртов проходит по механизму Е1.
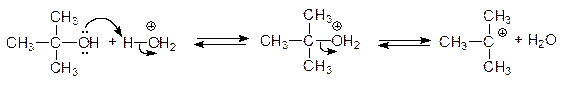
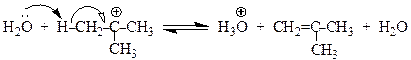
Образующиеся в качестве промежуточных частиц карбокатионы склонны к перегруппировкам, при которых менее стабильные катионы превращаются в более стабильные
Окисление спиртов
Этанол в виде разбавленных растворов, например, в вине окисляется воздухом под действием микроорганизмов в уксусную кислоту (столовый уксус):
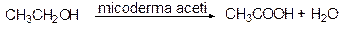
Сильные окислители, такие как щелочной раствор перманганата калия или концентрированная азотная кислота, окисляют спирты до кислот, причем вторичные спирты с разрывом связи С-С с обеих сторон от гидроксильной группы:
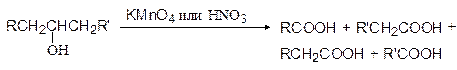
В этой реакции муравьиная кислота (R или R'=H) не образуется, т.к. она легко окисляется далее до СО2. Третичные спирты окисляются сильными окислителями с расщеплением углеродного скелета. Промышленное значение имеет окисление циклогексанола в адипиновую кислоту. Сам же циклогексанол получают гидрированием фенола.

адипиновая кислота
Окисление первичных спиртов до альдегидов представляет определенные трудности, т.к. альдегиды легко окисляются до кислот. Чтобы остановить окисление спиртов на стадии образования альдегидов используют два основных приема – дегидрирование и действие мягких окислителей. Окислением метанола кислородом воздуха получают формальдегид.
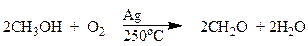

Важный растворитель 2-бутанон (метилэтилкетон) получают в промышленности окислением 2-бутанола.
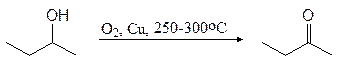
2-бутанол 2-бутанон
Для окисления первичных и вторичных спиртов соответственно до альдегидов и кетонов применяют хромовую кислоту в виде смеси дихроматов натрия (смесь Килиани) или калия (смесь Бекмана) с серной кислотой. Окисление обычно ведут в ацетоне или уксусной кислоте.

Вторичные спирты окисляются с хорошим выходом. С первичными спиртами дело обстоит труднее, т.к. образующиеся альдегиды далее легче, чем спирты окисляются до кислот. Практически альдегид можно получить лишь в том случае, когда его немедленно удается удалить из зоны реакции:
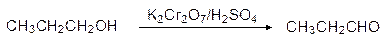
1-пропанол пропаналь
Для окисления первичных спиртов в альдегиды в лабораторной практике широко используется оксид хрома (VI) в виде пиридинийхлорхромата, получаемого растворением СrO3 в соляной кислоте с последующим прибавлением пиридина.
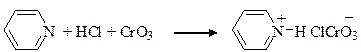
пиридин пиридинийхлорхромат (ПХХ)
или Py.HClCrO3
Окисление пиридинийхлорхроматом (ПХХ) ведут в метиленхлориде.

1-нонанол нонаналь
Используется также смесь оксида хрома (VI) с пиридином (реагент Саррета-Коллинза).
Реакции спиртов с кислотами
Спирты реагируют с карбоновыми кислотами с образованием сложных эфиров (эстеров) по реакции конденсации получившей название этерификация.
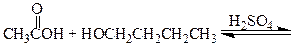
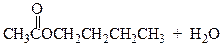
уксусная кислота 1-бутанол бутилацетат
Этерификация катализируется кислотами. Без добавления кислоты равновесие достигается очень медленно, но если же смесь спирта и кислоты нагревать в присутствии небольшого количества концентрированной серной кислоты или хлороводорода равновесие устанавливается достаточно быстро.
С неорганическими кислотами без осложнений реагируют только первичные спирты, в результате чего образуются сложные эфиры (кислые или средние):
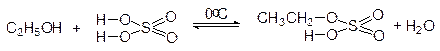
этилгидросульфат
Эта реакция имеет промышленное значение, т.к. с ее помощью из высших спиртов получают синтетические моющие средства:
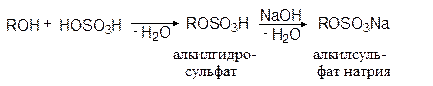
При использовании избытка спирта можно получать диалкилсульфаты. Так при нагревании метанола с олеумом получают диметилсульфат.
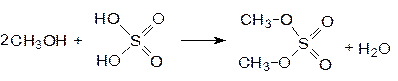
Диметилсульфат используют для получения метилиодида.
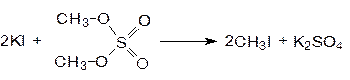
Вторичные и третичные спирты при нагревании с серной кислотой подвергаются дегидратации. При действии на спирты азотной кислоты образуются нитраты.
Нитрованием глицерина получают тринитрат глицерина, неправильно называемый тринитроглицерином. Он является взрывчатым веществом, однако он очень чувствителен к удару, поэтому его применяют в виде динамита, представляющего собой опилки, пропитанные тринитроглицерином. Взрывчатыми веществами являются нитраты и других полиолов.
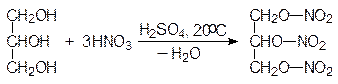
глицерин тринитрат глицерина
20.03.12
Оглавление
Введение 2
1. Источники спиртов 3
А. Синтез спиртов из алкенов 4
Б. Синтез спиртов из металлоорганических соединений 4
В. Синтез спиртов из галогеноуглеводородов 6
Г. Восстановление альдегидов, кетонов и эфиров кислот 6
2. Реакции спиртов 7
2.1. Кислотно-основные свойства спиртов 8
2.2. Реакции замещения гидроксильной группы 8
А. Реакции с галогеноводородами 8
Б. Действием галогенидов фосфора 10
Г. Действием тионилхлорида 11
Д. Образование алкилтозилатов 11
2.3. Дегидратация спиртов 11
3. Окисление спиртов 13
4. Реакции спиртов с кислотами 14
ВВЕДЕНИЕ
Спирты представляют собой соединения общей формулы ROH, в которых гидроксильная группа присоединена к насыщенному атому углерода. По номенклатуре ИЮПАК насыщенные спирты называют алканолами, нумерация в которых определяется гидроксильной группой. Гидроксильная группа при наличии двойной и тройной связей является старшей.При нумерации атомов главной цепи спиртов гидроксильная группа имеет преимущество перед алкильными группами, атомами галогенов и кратной связью.
В зависимости от того, является ли атом углерода, к которому присоединена гидроксильная группа, первичным 1о, вторичным 2о или третичным 3о спирты бывают 1о (RCH2OH), 2о (R2CHOH) или 3о (R3COH). Например, из четырех возможных бутиловых спиртов два – н-бутиловый и изобутиловый являются первичными 1о, втор -бутиловый - вторичным 2о и трет -бутиловый – третичным 3о.
Число гидроксильных групп в молекуле определяет так называемую атомность спирта. По числу гидроксильных групп в молекуле спирты подразделяются на одноатомные, двухатомные, трехатомные и т.д. спирты. Например, этанол является одноатомным спиртом, этиленгликоль _ двухатомным, а глицерин _ трехатомным.
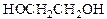
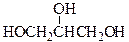
этиленгликоль глицерин
Гидроксильные группы могут находиться лишь у разных атомов углерода (правило Эрленмеера). Если две гидроксильные группы оказываются у одного атома углерода, то они немедленно отщепляют воду:
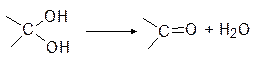
Если гидроксильная группа оказывается присоединенной к атому углерода соединенному с другим атомом углерода кратной связью, ее атом водорода немедленно перемещается к атому углерода:

Спирты находят широкое практическое применение. Они производятся в значительных количествах и используются в качестве полупродуктов для синтеза различных органических соединений. Диолы и глицерин применяются в производстве лекарственных препаратов, полимеров (полиэфиры, полиуретаны, полиамиды), взрывчатых веществ, пластификаторов. Спирты используются как растворители красок и полимеров, являются главными компонентами антифризов, гидравлических жидкостей, эмульгаторов, смазок, входят в состав парфюмерных изделий и медицинских препаратов. Глицерин является структурным компонентом животных и растительных жиров и масел, а также липидов животных тканей. Он играет важную роль в обмене веществ животного организма.
Некоторые спирты являются компонентами природных душистых веществ, например, фенэтиловый спирт является главным летучим компонентом розового масла. Хорошо известны такие природные спирты как гераниол, ментол и ретинол (витамин А).
Физические свойства низших спиртов в значительной степени определяются полярностью гидроксильной группы и ее способностью участвовать в образовании водородной связи, что приводит к их относительно высокой температуре кипения и к хорошей растворимости в воде.
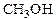
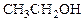
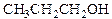
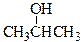
Т. кип., oC 64,7 78,3 97,2 82,3
Спирты кипят при значительно более высокой температуре, чем, например, алканы с близкой или даже большей молекулярной массой (М): например, бутан С4H10 (М = 58) кипит при 4оС, а метиловый спирт СН3ОН (М = 32) - при 64оС. Это объясняется тем, что молекулы спиртов ассоциированы за счет образования водородных связей. Образование ассоциатов с водой объясняет высокую растворимость низших спиртов в воде. Ассоциаты спиртов имеют следующее строение:

В способности спиртов к ассоциации одновременно проявляются их кислотные и основные свойства.
Источники спиртов
Основные способы получения спиртов уже рассматривались при обсуждении реакционной способности алкенов и алкилгалогенидов. Особенно следует выделить получение метанола и этанола.
Метиловый спирт, он же метанол, он же древесный спирт, обнаруженный впервые в середине ХVII века, выделенный в чистом виде в 1834 г., синтезированный в 1857 г., - один из старейших продуктов химической индустрии. Поначалу его получали сухой перегонкой древесины, а в 1923 г. начала работать первая заводская установка, на которой метанол синтезировали из водорода и окиси углерода. По объему производства метанол стоит на первом месте среди вторичных нефтехимических продуктов.
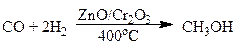
окись углерода метанол
Смесь моноксида углерода с водородом называют синтез газом. Его получают из природного газа.
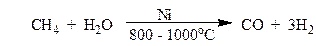
Метанол токсичен: его употребление, вдыхание паров или нахождение на коже в течение длительного времени вызывает слепоту или приводит к смертельному исходу.
Еще в древности было обнаружено, что при брожении многих растительных продуктов образуются алкогольные напитки, но лишь сравнительно недавно стало известно, что активным началом в них является этиловый спирт.

В дрожжах имеются энзимы, вызывающие превращение сахаров в спирты. Ферментацией кроме этилового спирта можно получать спирты С3, C4 и С5.
А. Синтез спиртов из алкенов
Реакция присоединения воды к алкенам, называемая гидратацией, используется в промышленности для получения спиртов из продуктов нефтепереработки.
Присоединение протекает по правилу Марковникова. Условия проведения реакции зависят от природы алкена. Скорость гидратации возрастает с увеличением разветвленности алкена:
Кислотно-катализируемая гидратация алкенов лежит в основе промышленного способа получения этанола из этилена и 2-пропанола из пропилена.

этилен этанол

пропилен 2-пропанол
Для получения других спиртов этот метод имеет весьма ограниченную область применения, поскольку гидратация алкенов часто сопровождается изомеризацией углеродного скелета за счет перегруппировок промежуточно образующихся карбокатионов, что сильно снижает синтетические возможности этого, на первый взгляд очень простого, способа получения вторичных и третичных спиртов.
Б. Синтез спиртов из металлоорганических соединений. Ретросинтетический анализ
Одной из главнейших задач решаемых органической химией является синтез соединений заданного строения. Для получения спиртов заданного строения реактивами Гриньяра действуют на альдегиды, кетоны, сложные эфиры и окись этилена.


формальдегид бензиловый спирт

бензальдегид 1-фенил-1-пропанол
Третичные спирты могут быть получены из кетонов тремя комбинациями реактивов Гриньяра и альдегида.
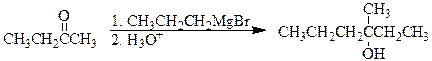
2-бутанон 3-метил-3-гексанол

2-пентанон 3-метил-3-гексанол
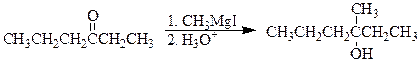
3-гексанон 3-метил-3-гексанол
2-Бутанол может быть получен двумя путями.
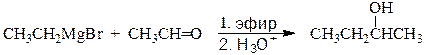
этилмагнийбромид этаналь 2-бутанол
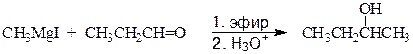
метилмагнийиодид пропаналь