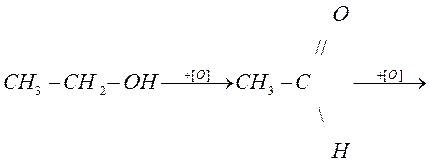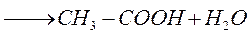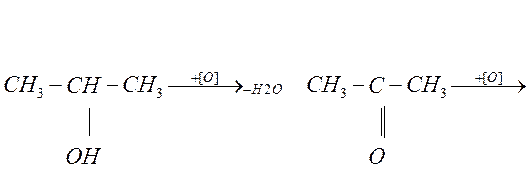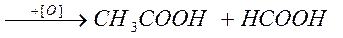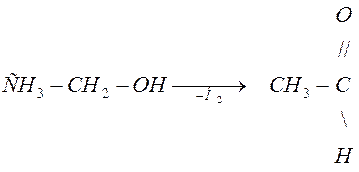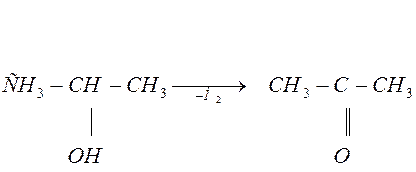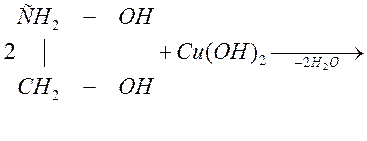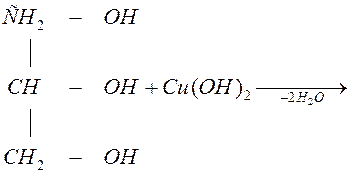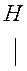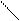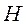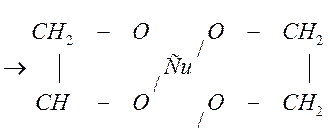1) Замещение гидроксила на галоген с образованием галогенопроизводных. Происходит при взаимодействии спиртов с реактивами, содержащими галоген, например, PCl5, PCl3, SOCl2:
С2Н5ОН + SOCl2 →C2H5Cl + HCl + SO2
этанол тионилхлорид хлорэтан
Эта реакция протекает по SN механизму (реакция нуклеофильного замещения). Атакующий реагент предоставляет свою электронную пару на образовании связи.
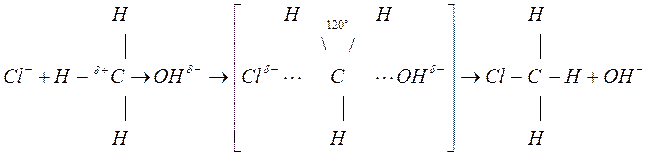
Переходное состояние
(активированный комплекс)
В переходном состоянии углерод и три атома водорода находятся в одной плоскости, перпендикулярно линии связи НО—С—Cl. Валентный угол между связями в радикале СН3 равен 120°. Атом углерода находится в состоянии sp2-гибридизации атомных орбиталей. Затем гидроксильная группа удаляется, а атом хлора соединяется с СH3-радикалом. Атом углерода переходит в состояние sp3-гибридизации атомных орбиталей.
2) Дегидратация спиртов (отщепление воды)
а) Внутримолекулярная дегидратация приводит к образованию этиленовых углеводородов, её проводят в присутствии водоотнимающих средств (Н2SO4, Н3PO4, силикагель). Водород (в соответствии с правилом Зайцева) отщепляется от наименее гидрогенизированного атома углерода:
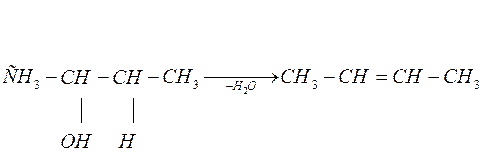
бутанол-2 бутен-2
Правило Зайцева: в реакциях дегидратации и дегидрогалогенирования водород отщепляется от наименее гидрогенизированного атома углерода соседнего с углеродом, содержащим галоген или гидроксил.
Такое отщепление водорода связано с тем, что энергия разрыва связи С—Н для третичного углеродного атома 370 кДж/моль, для вторичного 390 кДж/моль, для первичного 420 кДж/моль. Легче всего происходит дегидратация третичных спиртов, затем вторичных.
б) Межмолекулярная дегидратация.
Происходит отщепление воды от двух молекул спирта, при этом образуются простые эфиры. Реакция протекает в присутствии водоотнимающих средств в качестве катализаторов, например, концентрированной H2SO4:
СН3—СН2—ОН + НО—СН2—СН3 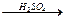 СН3—СН2—О—СН2—СН3 + Н2О
СН3—СН2—О—СН2—СН3 + Н2О
этиловый спирт диэтиловый эфир
Реакции окисления
При окислении первичных спиртов образуется альдегиды, вторичных спиртов - кетоны. Окислители KMnO4 в кислой среде или хромовая смесь.
Альдегиды подвергаются дальнейшему окислению с образованием карбоновых кислот.
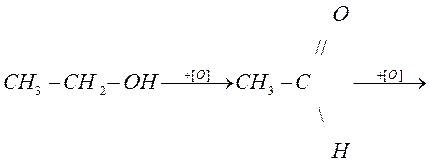
этиловый спирт уксусный альдегид
уксусная кислота
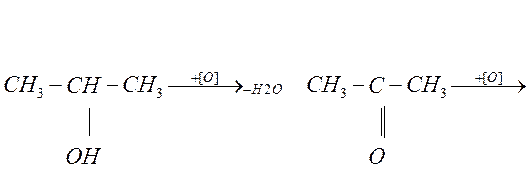
изопропиловый ацетон
спирт (вторичный)
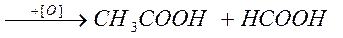
уксусная кислота муравьиная кислота
Окисление кетонов сопровождается разрывом цепи. Третичные спирты наиболее стойки к действию окислителей. Это объясняется тем, что углеродный атом третичного спирта не содержит атомов водорода и окисление такого спирта при действии энергичных окислителей и высокой температуре приводит к разрушению молекулы с образованием смеси карбоновых кислот.
При окислении первичных спиртов образуются альдегиды, вторичных – кетоны, третичных – смесь карбоновых кислот. Образование различных продуктов при окислении первичных, вторичных и третичных спиртов дает возможность использовать эту реакцию для установления строения спирта.
Дегидрирование спиртов
При пропускании паров спирта над катализатором дегидрирования (раскаленная медь, железо, никель) при t =250 ° C первичные и вторичные спирты отщепляют по два атома водорода. При этом первичные спирты превращаются в альдегиды, а вторичные спирты в кетоны.
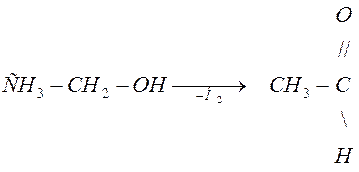
этиловый спирт уксусный альдегид
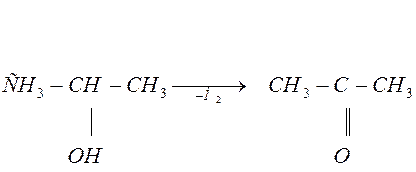
изопропиловый спирт ацетон
Многоатомные спирты
Двухатомные и трех атомные спирты в отличие от одноатомных легко вступают в реакции не только со щелочными металлами, но и с гидроксидами тяжелых металлов, например:
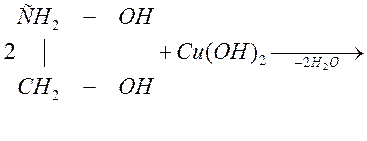
этиленгликоль







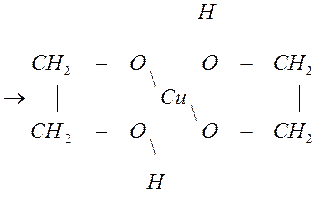
гликолят меди
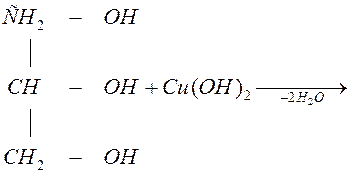
глицерин





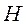
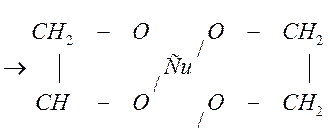
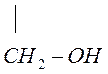
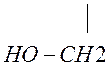
глицерат меди (комплексное соединение)
Гликолят и глицерат меди – это комплексные соединения. Комплексообразователь Cu2+ образует две обычных связи с атомом кислорода, а две – по донорно-акцепторному механизму.
Кислород является донором, а ион Cu2+ акцептором общей электронной пары. Образование соединения с гидроксидом меди – качественная реакция на многоатомные спирты.
ЛАБОРАТОРНАЯ РАБОТА
«СПИРТЫ И ЭФИРЫ»



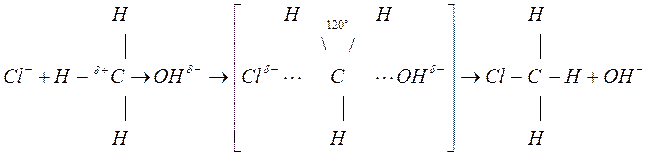
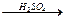 СН3—СН2—О—СН2—СН3 + Н2О
СН3—СН2—О—СН2—СН3 + Н2О