

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Интересное:
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Окисление соединениями хрома. В лабораторной практике для окисления спиртов чаще всего пользуются шестивалентными соединениями хрома: дихроматом натрия с серной кислотой или оксидом хрома(VI)
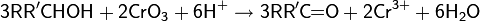
Обычно, для проведения реакции используют так называемый реагент Джонса — раствор оксида хрома(VI) в разбавленной серной кислоте и ацетоне. Реагент также может быть получен из дихромата натрия или калия. Окисление по Джонсу применяют для селективного окисления вторичных спиртов до кетонов и первичных спиртов до карбоновых кислот и в некоторых случаях до альдегидов
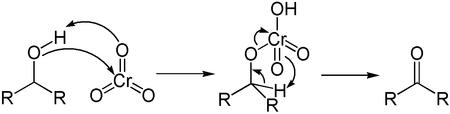
Третичные спирты под действием триоксида хрома окисляются с разрушением углеводородного скелета, например, циклоалканолы трансформируются с раскрытием кольца в кетоны и карбоновые кислоты.
Альтернативой реагенту Джонсу является комплекс триоксида хрома с пиридином CrO3•2C5H5N, носящий имя реагент Саррета. Этот реагент позволяет проводить селективное окисление самых различных первичных спиртов до альдегидов в неводных условиях, однако его высокая пожароопасность и гигроскопичность, а также основные свойства пиридина ограничивают возможности применения. Раствор реагента Саррета в метиленхлориде называется реагентом Коллинза. Эта модификация окислителя является более удобной и безопасной, а также может быть использована (в отличие от двух предыдущих реагентов) для окисления субстратов, чувствительных к действию кислот или щелочей.
В 1975 г. для окисления спиртов в карбонильные соединения был предложен новый стабильный и удобный реагент на основе шестивалентного хрома — хлорохоромат пиридиния C5H5NHCrO3Cl
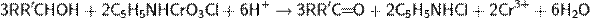
Схематичный механизм реакции
|
|
Важным достоинством реагента является его инертность по отношению к ненасыщенным связям, что позволяет получать непредельные альдегиды и кетоны. Среди других комплексных соединений хрома используются: дихромат пиридиния, фторохромат пиридиния, хлорохромат дипиридиния, а также хлорохроматы различных гетероциклических соединений — хинолина, пиразина, имидазола и др.
Окисление соединениями марганца. Для окисления спиртов из соединений марганца чаще всего используют MnO2 и KMnO4. Варьируя условия проведения реакции (температура, pH среды и пр.) продуктами окисления могут стать альдегиды, кетоны или карбоновые кислоты.Непредельные спирты при действии оксида марганца(IV) при комнатной температуре в зависимости от строения превращаются в альдегиды или кетоны, сохраняя двойную связь
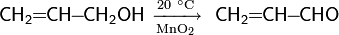
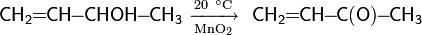
Аналогично реагируют и ацетиленовые спирты.
Раствор перманганата в кислой среде действует как сильный окислитель, который превращает первичные алифатические спирты в карбоновые кислоты, а вторичные — в кетоны
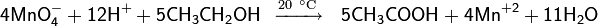
В щелочной среде на холоду растворы перманганата со спиртами не реагируют.
Осторожное окисление бензилового спирта кристаллическим перманганатом калия в неводной среде в присутствии краун-эфира в качестве катализатора фазового перехода селективно приводит к бензальдегиду.
Каталитическое окисление кислородом. Окисление спиртов кислородом воздуха в присутствии катализаторов — распространённый способ получения карбонильных соединений (как правило — кетонов) в промышленности. Одним из общих способов является использование в качестве катализатора порошкообразного серебра
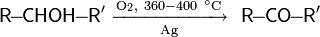
Метанол окисляется кислородом воздуха до формальдегида в присутствии оксидов переходных металлов (например: Fe2O3) с выходом до 95 % (реакция Адкинса — Питерсона)
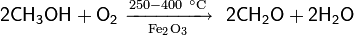
Каталитическое окисление этанола кислородом воздуха в присутствии оксида хрома(III) или оксида меди(II) — популярный демонстрационный опыт для учебных целей
|
|
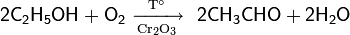
Использование смешанного литий-серебро-алюминиевого катализатора даёт возможность осуществить прямое окисление этанола в окись этилена
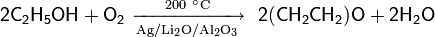
Для окисления спиртов могут использоваться самые различные катализаторы, например оксид ванадия(V), оксид рутения(IV), ацетат палладия(II) и ряд других.
Окисление прочими неорганическими окислителями. Существует большое количество неорганических соединений, которые могут быть использованы для окисления спиртов в те или иные производные. В табл. 13. приведены примеры использования некоторых реагентов.
Примеры неорганических реагентов, используемых для окисления спиртов
| Окислитель | Исходное соединение | Конечное соединение | Условия реакции |
| ацетат свинца(IV): Pb(CH3COO)4 | Ar−CH2OH | Ar−CHO | раствор в пиридине, комнатная температура |
| R−CR'OH−CR'OH—R | (RR')C=O | уксуснокислый раствор, количественный выход | |
| тетраоксид диазота: N2O4 | R−CH2OH | R−COOH | хлороформ, 0 °С |
| гипохлориты: Ca(OCl)2, NaOCl, KOCl | R−CH2OH / R−CHOH−R | R−C(O)−OCH2R / R−CO−R | уксусная кислота, 0 °С |
| нитрат диаммония-церия(IV): (NH4)2Ce(NO3)6 | Ar−CH2OH | Ar−CHO | уксусная кислота, 50—100 °С |
| феррат калия: K2FeO4 | Ar−CH2OH + CH3OH | Ar−COOCH3 | дихлорметан, CuSO4, выход более 70 % |
| реагент Фетизона: Ag2CO3/кизельгур | R−CH(OH)−R / R−CH(OH)-CH2-CH(OH)−R | R−C(O)−R / R−C(O)-CH2-CH(OH)−R | карбонат серебра, нанесённый на твёрдый носитель кизельгур (англ. celite) |
Окисление с использованием активированного диметилсульфоксида. Окисление Пфицнера— Моффатта. В 1963 г. К. Пфицнером и Дж. Моффаттом была совершена публикация, в которой сообщалось об открытии нового метода окисления спиртов. Учёные растворяли исходные компоненты в смеси безводного диметилсульфоксида и дициклогексилкарбодиимида в присутствии слабой кислоты. В результате реакции в зависимости от строения спирта получался соответствующий альдегид или кетон, при этом даже для чувствительных первичных спиртов в продуктах окисления практически не 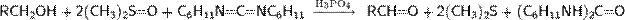 наблюдались следов карбоновых кислот
наблюдались следов карбоновых кислот
Спустя два года был предложен механизм превращения
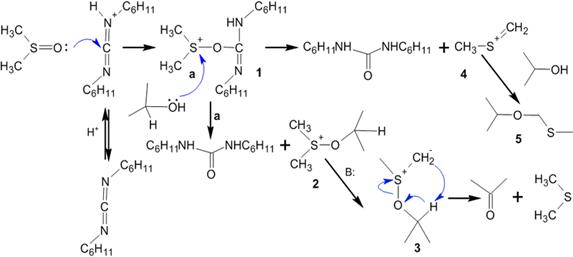
В соответствии с механизмом реакции протонированный дициклогексилкарбодиимид (ДЦК) на первом этапе вступает в реакцию с диметисульфоксидом (ДМСО) с образованием сульфониевого интермедиата (1), так называемого «активированного ДМСО», содержащего легко-уходящую группу, связанную с положительно заряженным атомом серы. Спирт быстро замещает эту группу, образуя алкоксидиметилсульфониевую соль (2), которая в свою очередь, теряя протон, превращается в тиоилид (3). В финальной стадии процесса происходит внутримолекулярное расщепление илида, проводящее к образованию конечного карбонильного соединения и диметилсульфида. Отмечается, что «Активированный ДМСО» (1) способен распадаться с образованием высокореакционной частицы (4), которая вступая в реакцию со спиртом, образует побочный продукт — метилтиометиловый эфир(5). Вместе с тем, учитывая, что элиминирование протекает при более высокой температуре, чем основной процесс, можно использовать температурный контроль хода реакции для минимизации доли побочных продуктов. Согласно механизму окисления, для протонирования ДЦК необходимо присутствие кислоты, однако сильные минеральные кислоты (HCl, HClO4, H2SO4 и т. п.) для реакции непригодны — они предотвращают образование илида (3). Проведённые эксперименты показали, что оптимальным является использование фосфорной или дихлоруксусной кислоты, а также трифторацетата пиридиния.
|
|
Данный метод стал основой для многочисленных научных исследований в области окисления спиртов активированным диметилсульфоксидом, что привело впоследствии к многочисленным модификациям и практическим разработкам новых способов окисления.
Окисление Олбрайта— Голдмана и Олбрайта— Онодера. В 1965 г. (спустя два года после сообщения Пфицнера и Моффатта) Олбрайтом и Голдманом был предложен способ окисления спиртов при комнатной температуре смесью ДМСО и уксусного ангидрида. Предложенная модификация уступает методу Пфицнера— Моффатта из-за большего количества побочных продуктов, однако доступность уксусного ангидрида делает окисление Олбрайта— Голдмана полезным для лабораторной практики.В том же сообщении 1965 г. Олбрайт и Голдман упомянули, что ДМСО можно активировать оксидом фосфора(V). Спустя несколько месяцев Онодера с сотрудниками сделал подробный доклад о новом методе окисления спиртов смесью ДМСО и P2O5 (метод получил название окисление Олбрайта— Онодера. Наконец, в 1987 г. данный способ окисления был улучшен: в качестве растворителя был использован дихлорметан в присутствии триэтиламина.
|
|
Окисление Париха— Деринга. Ещё одним методом окисления спиртов с использованием активированного диметилсульфоксида является окисление Париха— Деринга, где в качестве активирующего реагента используется раствор триоксида серы в пиридине (пиридиновый комплекс SO3•C5H5N) в присутствии триэтиламина. Реакция проходит при охлаждении (около 0 °С) или комнатной температуре. Метод, открытый Парихом и Дерингом в 1967 г., несмотря на его практическую доступность, отличается повышенным содержанием в целевых продуктах побочного компонента — метилтиометилового эфира. Механизм окисления Париха— Деринга аналогичен механизму окисления Пфицнера— Моффатта
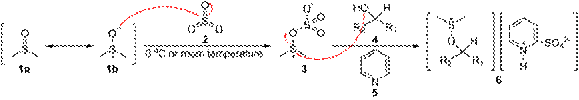
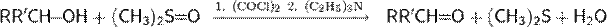 Окисление Сверна. Одним из лучших методов, использующих активированный ДМСО, стал процесс с использованием оксалилхлорида, открытый в 1978 г. Сверном
Окисление Сверна. Одним из лучших методов, использующих активированный ДМСО, стал процесс с использованием оксалилхлорида, открытый в 1978 г. Сверном
Окисление спиртов по Сверну может быть выполнено в очень мягких условиях. С помощью этой реакции можно получать альдегиды и кетоны из первичных и вторичных спиртов соответственно. Главным недостатком метода является выделение токсичных и зловонных побочных продуктов— диметилсульфида и оксида углерода(II)
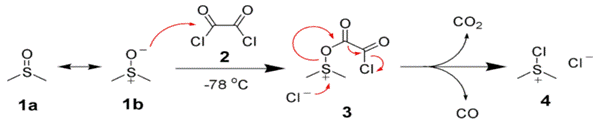
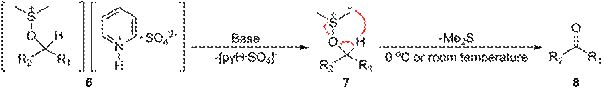
Первый этап реакции Сверна заключается в низкотемпературном взаимодействии диметилсульфоксида (1a и 1b) с оксалихлоридом (2). Промежуточный интермедиат (3) быстро разлагается с выделением CO и CO2 и образованием хлорида диметилхлорсульфония (4), который в свою очередь вступает в реакцию со спиртом (5), образуя ион алкоксисульфония (6). Далее в реакцию вступает триэтиламин, который депротонирует интермедиат, давая илид (7). Переходный пятичленный цикл (7) разлагается, образуя диметилсульфид и конечный кетон или альдегид (8).
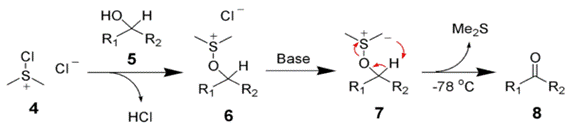
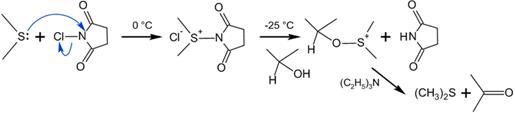
Окисление Кори— Кима. В отличие от окисления по Пфицнеру— Моффатту и ему подобных, где «активированный ДМСО» образуется в реакции ДМСО с электрофильным агентом, метод Кори— Кима использует в качестве исходного реагента диметилсульфид 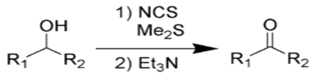
Сущность метода заключалась в образовании хлорида хлордиметилсульфония — представлявшего собой по сути «активированный ДМСО» Сверна— действием хлора на ДМС
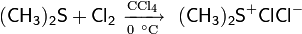
На практике, однако учёные предложили использовать вместо хлора N-хлор-сукцинимид (NCS), который вступая в реакцию с диметисульфидом, образует ион хлордиметилсульфония, а он в свою очередь реагирует со спиртом по аналогии с процессом Сверна
Окисление с использованием алкоголятов металлов.Окисление по Оппенауэру. В начале 20-го века независимо Меервейном, Пондорфом и Верлеем была открыта реакция восстановления карбонильных соединений в спирты (восстановление по Меервейну — Пондорфу — Верлею) в присутствии алкоголята алюминия (в качестве донора протонов выступал изопропанол) 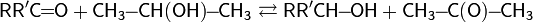
|
|
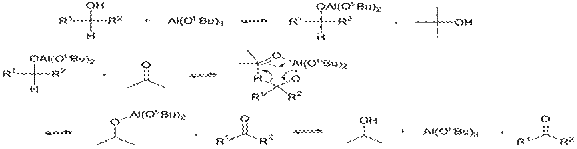 В 1937 г. Оппенауэром была осуществлена обратная реакция: используя в качестве окислителя избыток ацетона в присутствии трет -бутилата алюминия, ему удалось, по сути, сдвинуть равновесие и перенести процесс восстановления в обратную сторону
В 1937 г. Оппенауэром была осуществлена обратная реакция: используя в качестве окислителя избыток ацетона в присутствии трет -бутилата алюминия, ему удалось, по сути, сдвинуть равновесие и перенести процесс восстановления в обратную сторону
Окисление Мукаямы. В 1977 г. Мукаяма с сотрудниками опубликовал работу, в которой сообщал, что алкоголяты магния, образующиеся в результате взаимодействия спирта с пропилмагнийбромидом или трет -бутоксимагнийбромидом в присутствии
1,1’-(азодикарбонил)дипиперидина (выступает в роли акцептора водорода) при комнатной температуре окисляют исходный спирт до альдегида или кетона
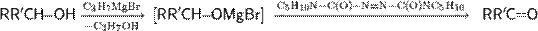
Хотя реакция Мукаямы и не принадлежит к числу распространённых методов окисления спиртов, она представляет препаративный интерес из-за более мягких условий протекания (по сравнению с окислением Оппенауэра) и сопровождается меньшим количеством побочных продуктов.
Прочие методы окисления. Окисление соединениями гипервалентного иода. Соединения пятивалентного иода — сильные окислители, однако из-за своей нестабильности и плохой растворимости в органических растворителях они практически не использовались в лабораторной органической практике. Однако, в 1983 г. Десс и Мартин опубликовали информацию о новом стабильном и хорошо растворимом в дихлорметане органическом соединении гипервалентного иода, являющегося эффективным и очень мягким окислителем для первичных и вторичных спиртов

Метод, получивший название окисления Десса— Мартина, оказался очень эффективным и получил свое развитие во многих последующих работах. Помимо периодинана Десса— Мартина существуют и другие соединения гипервалентного иода, используемые как окислители для спиртов: 2-иодоксибензойная кислота, дихлорид иодбензола, иодозобензол и др..
Окисление стабильными нитроксидными радикалами
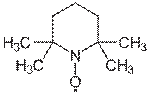
TEMPO — стабильный нитроксидный радикал. В 1987 г. Анелли с сотрудниками опубликовал исследование, в котором сообщалось об использовании свободного нитроксидного радикала (4-метокси-2,2,6,6-тетраметилпиперидин-1-оксил или англ. 4-метокси-TEMPO) в качестве катализатора для быстрого селективного окисления первичных и вторичных спиртов. Реакция проводилась при 0 °С в двухфазной среде CH2Cl2—вода в присутствии вторичного окислителя (NaOCl), а также небольших количеств NaHCO3 (стабилизирует pH раствора) и KBr (ускоряет реакцию вследствие образования HOBr — более сильного окислителя по сравнению с HOCl)
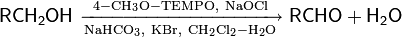
Механизм реакции окисления с использованием TEMPO выглядит следующим образом
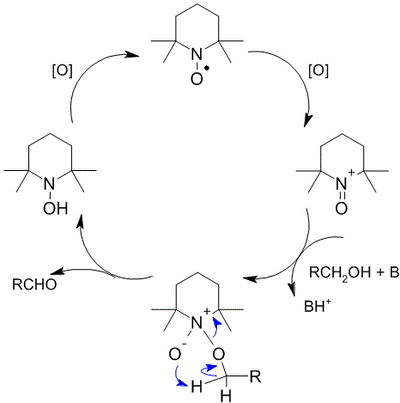
В настоящий момент окисление с использованием TEMPO и его производных широко распространено в лабораторной практике, при этом сама реакция неоднократно модифицировалась: в качестве вторичных окислителей помимо NaOCl используются иодозобензол, трихлороизоциануровая кислота, CuCl + O2, Cu(ClO4)2, I2 и ряд других.
Каталитическое дегидрирование спиртов — распространённый промышленный метод получения карбонильных соединений — в лабораторной практике используется редко из-за необходимости использования сложного оборудования и специально приготовленных катализаторов на основе меди, серебра, платины (в том числе с различными добавками), а также различных оксидов металлов, включая смешанные композиции.
Дегидрированием метанола над медью, хромом или серебром в промышленных масштабах получают формальдегид
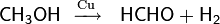
При дегидрировании метанола на модифицированном медном катализаторе при температуре 200 °С образуется метилформиат
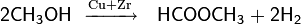
Высокодегидратированный оксид кремния(IV) может быть использован для селективного получения ацетальдегида из этанола
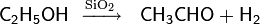
Одним из методов, используемых на практике довольно длительное время, является каталитическое дегидрогенирование первичных и вторичных спиртов в присутствии смешанного оксида меди-хрома при температуре около 300 °С
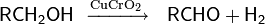
Современные препаративные методы дегидрирования спиртов на основе металлорганических катализаторов позволяют получать карбонильные соединения в мягких условиях и с высоким выходом. Например, сложный рутениевый комплекс можно использовать для трансформации первичных спиртов в кетоны или сложные эфиры
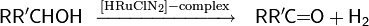
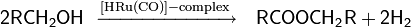
Другой пример реакции с использованием комплексных органических соединений рутения в качестве катализатора
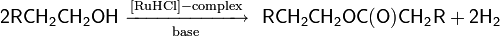
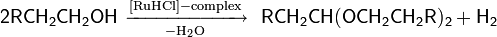
Биохимическое окисление спиртов. Особый способ окисления спиртов — биохимический, происходящий в живых организмах под действием естественных ферментов — является, с одной стороны, важным метаболическим процессом, с другой — промышленным микробиологическим процессом, используемым для получения различных полезных соединений. Наибольшее практическое значение имеет способность ряда аэробных бактерий семейства Acetobacteraceae (роды Acetobacter и Gluconobacter) под действием кислорода в процессе клеточного дыхания трансформировать спирты в соответствующие карбонильные соединения или карбоновые кислоты. Наиболее важным из процессов подобного типа, является уксуснокислое брожение, общая схема которого выглядит следующим образом (для Acetobacter aceti)
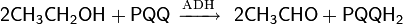
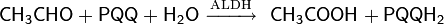
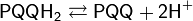
В данной схеме катализаторами процесса являются следующие ферменты: алкогольдегидрогеназа (ADH) и альдегиддегидрогеназа (ALDH). Коферментом группы дегидрогеназ выступает пирохинолон хинон (PQQ). Известны и другие примеры биохимического окисления спиртов. Так, например, граммотрицательные бактерии Gluconobacter oxydans помимо уксуснокислого превращения этанола, могут трансформировать глицерин в дигидрокисацетон, маннит — во фруктозу, а сорбитол — в сорбозу.
Реакции восстановления спиртов
Каталитическое гидрирование. Неактивированные гидроксильные группы довольно устойчивы к гидрогенолизу и могут быть восстановлены в довольно жёстких условиях. Реакции гидрирования протекают при высоких температурах и давлении, в качестве катализаторов используются никель, смешанные оксиды хрома-меди, цеолиты
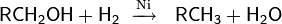
В процессе гидрирования для высших спиртов параллельно может происходить укорочение углеводородной цепочки
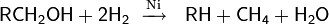
Гидрирование первичных спиртов может быть описано как SN2 замещение с атакой водородом углеродного атома. Реакция третичных спиртов соответствует механизму SN1. Гидрирование многоатомных спиртов может проходить с высокой степенью селективности. Так, например, гидрогенолиз глицерина можно остановить на стадии 1,2-пропандиола
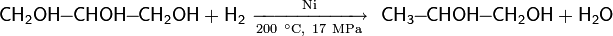
Удобным методом гидрирования спиртов является двухстадийный процесс, на первом этапе которого под действием дициклогексилкарбодиимида в присутствии каталитических количеств CuCl спирт трансформируется в O-алкил-N,N-дициклогексилизо-мочевину, которая затем легко гидрируется в мягких условиях уголь-палладиевым катализатором
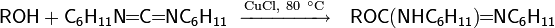
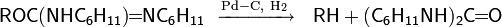
Реакция сочетания спиртов
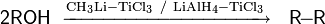
Аллиловые и бензиловые спирты под действием системы метиллитий−хлорид титана (III) при −78 °С или при кипячении в присутствии алюмогидрида лития и хлорида титана (III) вступают в реакцию симметричного сочетания, согласно приведённой выше схеме. В случае использования смеси двух различных спиртов образуется соответствующая смесь трёх возможных продуктов сочетания. Сочетание спиртов в присутствии рутениевого катализатора и кислот Льюиса происходит по другой схеме
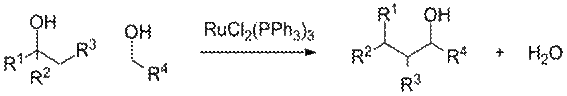
Реакция Бартон — МакКомби. Одним из удобных и широко используемых методов восстановления спиртов до алканов является радикальное деоксигенирование тиокарбонатов и ксантогенатов в присутствии гидрида трибутилолова (или других источников водородных радикалов) и азобисизобутиронитрила (AIBN, инициатор радикального процесса)
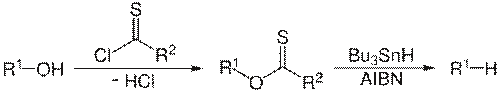
Данный метод, получивший название реакции Бартона— МакКомби или реакции Бартона, имеет следующий механизм

Восстановление спиртов другими методами. Одним из простейших способов восстановления спиртов является их взаимодействие с иодоводородом
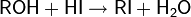
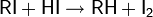
На практике чаще пользуются смесью фосфора с иодом для замены дорогостоящего HI и регенерации иода в процессе реакции
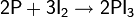
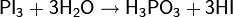
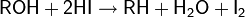
Среди прочих восстановителей различных в литературе встречаются: иодистоводородная кислота в уксусном ангидриде, металлический цинк в комбинации с уксусной или соляной кислотами, натрий в жидком аммиаке и др.
Реакции карбонилирования и гидроформилирования спиртов
Реакции карбонилирования спиртов. В 1953 г. Реппе в своей работе показал, что в присутствии карбонилов кобальта, железа и никеля под действием высокой температуры и давления спирты способны присоединять оксид углерода (II) с образованием карбоновых кислот. Процесс получил название карбонилирование
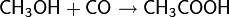
Карбонилирование многоатомных спиртов приводит к поликарбоновым кислотам
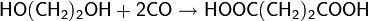
В дальнейшем процесс был усовершенствован: был применён кобальтовый катализатор с иодсодержащим промотором. Активным соединением в процессе является HCo(CO)4 (тетракарбонилгидрокобальт), образующийся в ходе реакций
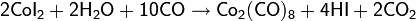
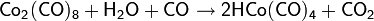
Далее процесс идёт следующим образом
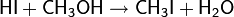
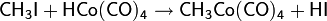
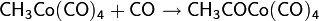
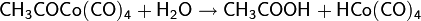
Карбонилирование используется в промышленных синтезах и возможно не только для метанола: использование родия и других катализаторов позволяет присоединять CO к самым различным первичным, вторичным и даже третичным спиртам.
Реакции гидроформилирования спиртов
Для низших спиртов возможно осуществление и реакции гидроформилирования более характерной для алкенов 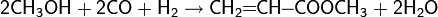
Более известна реакция гомологизации, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 г. — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанол
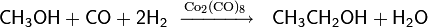
Гидроформилирование процесс крайне ограниченного использования — только немногие спирты (трет -бутанол, бензиловый спирт) дают приемлемые выходы и относительно высокую селективность.
Реакции окислительного карбонилирования спиртов
В 1963 г. был впервые описан процесс окислительного карбонилирования спиртов в присутствии PdCl2 в качестве катализатора
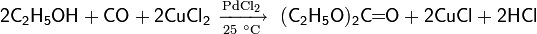
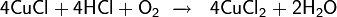
Если реакцию проводить при повышенном давлении (7 МПа) и температуре
(125 °С) конечным продуктом вместо диэтилкабоната будет диэтилоксалат. Разработаны также схемы синтеза методом окислительного карбонилирования диметилкарбоната и диметилоксалата из метанола, дибутилоксалата из бутанола, а также ряда других соединений.
Прочие важные реакции с участием спиртов
Пинаколиновая перегруппировка. Дитретичные 1,2-диолы способны участвовать в реакциях пинаколиновой перегруппировки. В ходе процесса происходит 1,2-миграция алкильной группы в промежуточном карбкатионе. Продуктами являются пинаколины — кетоны, в которых карбонильнах группа соединена с третичным атомом углерода. Название реакции происходит от наиболее известного примера перегруппировки, превращения пинакола в пинаколон
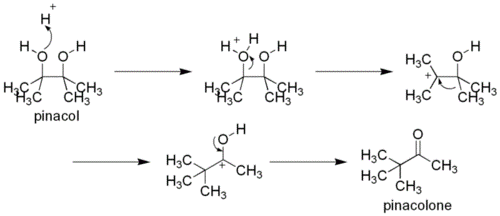
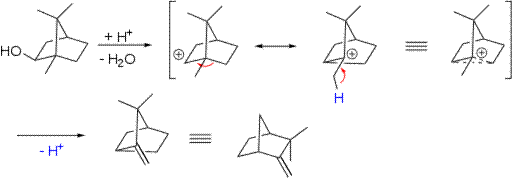
Пинаколиновая перегруппировка относится к перегруппировке Вагнера— Mеервейна. При дегидратации спиртов алициклического ряда (содержащих насыщенный циклический фрагмент) возможно образование продуктов 1,2-миграции алкильной группы. Миграция направлена к карбкатионному центру в процессе элиминирования. Такие реакции, наряду с аналогичными в результате присоединения к кратным связям или нуклеофильного замещения, называются перегруппировками Вагнера— Меервейна. Особое значение реакция имеет для бициклических соединений, в частности — производных камфоры. Примером такой реакции может служить кислотно-катализируемое превращение изоборнеола в камфен
Некоторые реакции присоединения с участием спиртов
Присоединение спиртов к соединениям, содержащим кратные связи, имеет важное значение в лабораторной практике. Наиболее типичные реакции присоединения с участием спиртов:
· Реакция спиртов с альдегидами в присутствии катализаторов (НСl, n-толуолсульфокислота и др.) приводит к образованию ацеталей
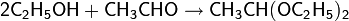
· Спирты довольно легко присоединяются к эпоксидам, в результате чего образуются эфиры этиленгликоля (целлозольвы)
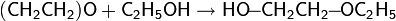
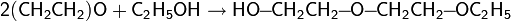
· Нагревание спиртов с нитрилами в присутствии газообразного HCl приводит к образованию иминоэфира (подробнее см. раздел: Взаимодействие спиртов с хлорангидридами, ангидридами кислот и нитрилами)
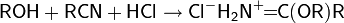
· Взаимодействие спиртов с изоцианатами приводит к образованию уретанов
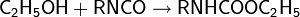
Аналогично реагируют и изотиоцианаты:
· При взаимодействии спиртов с сероуглеродом в щелочной среде образуются дитиокарбонаты
· 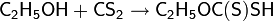
· Алкены в присутствии PdCl2 присоединяются к спиртам с образованием кеталей как основных продуктов
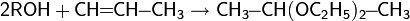
· Алкины присоединяют спирты в присутствии щелочей с образованием алкенильных эфиров (реакция Фаворского)
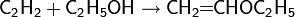
Защита гидроксильной группы при органическом синтезе. Спирты, как правило, достаточно легко вступают в реакции нуклеофильного замещения с различными субстратами, способны окисляться до карбонильных соединений или терять воду под действием кислот. При проведении комплексных синтезов, часто появляется необходимость защиты гидроксильных групп для осуществления реакций в отношении других реакционных центров. Во время синтеза защищенная гидрокисльная группа остается без изменения, а по окончании процесса защита снимается с помощью специальных реагентов.
Защита через силильные эфиры. Одним из наиболее распространённых способов защиты гидроксильных групп является реакция спиртов с хлортриалкилсиланом в присутствии основания с образованием алкилсилильных эфиров

Образующийся силильный эфир можно далее использовать для сторонних синтезов

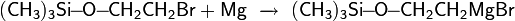

 Для снятия защиты используется кислотный гидролиз
Для снятия защиты используется кислотный гидролиз
Защита через простые эфиры. Важным способом защиты гидроксильных групп является метод образования простых эфиров. В качестве таких соединений чаще всего используются трет -бутиловый, аллиловый, бензиловый, трифенилметиловый эфиры; реже — метиловый эфир. Установка защиты происходит следующим образом
· трет -бутиловый эфир
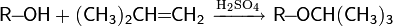
· аллиловый эфир
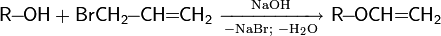
· бензиловый эфир
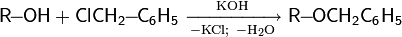
· трифенилметиловый эфир
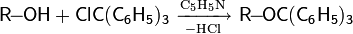
· метиловый эфир
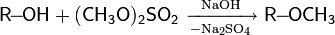
Для снятия защиты чаще всего используют кислотный гидролиз простых эфиров действием HI, HBr, CF3COOH и прочих подобных реагентов.
Одним из эффективных реагентов для удаления защиты гидроксильных групп является раствор трет -бутилата калия в ДМСО, являющегося сильным основанием («супероснованием»). Этот раствор способен генерировать карбанионные интермедиаты, которые достаточно легко вступают в реакцию с простыми эфирами

Защита через сложные эфиры. Защита гидроксильной группы возможна через образование сложных эфиров. Чаще всего для этих целей используются ацетаты, образующиеся при взаимодействии спиртов с уксусным ангидридом при комнатной температуре в пиридиновой среде; иногда в сочетании с некоторыми кислотными катализаторами
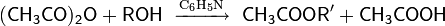
Снятие защитной группы осуществляется с помощью основного (реже — кислотного) гидролиза, например: аммонолиза аммиаком в среде метанола.
Для защиты гидроксильной группы в сахарах, помимо ацетатной, используется бензоильная и нитробензоильная защита (реагент — хлористый бензоил или нитробензоил). В химии стероидов находит применение формиатная защита (реагент — муравьиная кислота), которая избирательно (без затрагивания прочих сложноэфирных групп) может быть удалена гидрокарбонатом калия в метанольном растворе. Среди прочих защитных сложноэфирных групп отметим трифтор-, и хлор-, метокси- и феноксиацетаты, а также карбонаты и некоторые другие производные.
Защита через ацетали и кетали. Одним из наиболее общих и эффективных методов защиты гидроксильных групп является количественная реакция спиртов с 2,3-дигидро-4H-пираном в условиях кислотного катализа (POCl3, HCl и др.). Для снятия защиты образующиеся тетрагидропираниловые эфиры могут быть подвергнуты кислотному гидролизу в достаточно мягких условиях
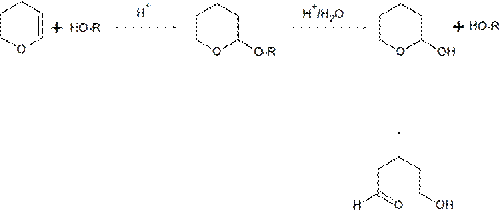
Тетрагидропиранильная защита достаточна распространена из-за лёгкости установки и удаления, однако неприменима в условиях кислой среды и для оптически активных спиртов. Если есть необходимость защиты стереоизомерных спиртов, для защиты используются симметричные ацетали или кетали и, в частности, метоксипроизводные дигидропирана.
Идентификация спиртов
Химические методы идентификации спиртов
Качественный анализ гидроксильных групп. Существует множество относительно простых тестов, позволяющих выявить в органическом соединении наличие гидроксильного фрагмента (−OH), однако все они имеют довольно ограниченное применение и не являются универсальными: часто присутствие прочих функциональных групп или кратных связей в веществе могут либо не проявить искомые свойства спирта, либо дать ложно положительный эффект на ту или иную реакцию.
Наиболее известные качественные реакции на спирты:
· Проба Лукаса: при реакции вторичного или третичного спирта при комнатной температуре (первичные спирты в реакцию, как правило, не вступают) с реактивом Лукаса (смесь концентрированной соляной кислоты и хлорида цинка) происходит образование галогенопроизводного, которое распознаётся по образованию характерного масла, образующего отдельную от исходного спирта фазу. При этом зафиксировав время реакции, можно различить вторичные (эффект наблюдается по истечение 5-ти минут) и третичные спирты (реакция протекает практически мгновенно или в течение не более 3-х минут)
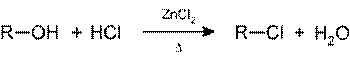
Некоторые первичные спирты, например: аллиловый или бензиловый, дают положительную реакцию с реактивом Лукаса.

Положительная (справа) и отрицательная проба Лукаса
· Иодоформная проба: предназначена для идентификации спиртов вида R−CH(OH)−CH3 и кетонов вида R−C(O)−CH3
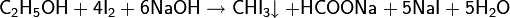
Идентификацию спиртов осуществляют по характерному жёлтому осадку иодоформа, обладающего специфическим запахом.
· Тест Виктора Мейера: позволяет дифференцировать первичные, вторичные и третичные спирты по реакции получаемых из них нитропроизводных с азотистой кислотой. На первой стадии спирты трансформируются в галогенопроизводные, которые, в свою очередь, превращаются в нитроалканы
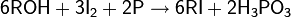
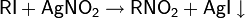
Далее взаимодействие с HNO2 делает возможными три варианта развития событий
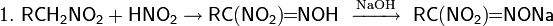
раствор окрашивается в красный цвет (натриевая соль нитроловой кислоты — RC(NO2)=NONa)
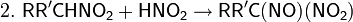
раствор окрашивается в синий цвет
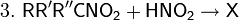
раствор остаётся бесцветным (реакция не идёт).
· Цератная проба: при взаимодействии спиртов с азотнокислым раствором гексанитратоцерата(IV) аммония, имеющим жёлтую окраску, образуются переходные комплексы красного цвета, которые затем обесцвечиваются вследствие окисления спирта и перехода Ce(IV) в анион Ce(III). Для спиртов, нерастворимых в воде, используют растворы в диоксане или ацетонитриле
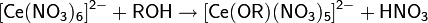
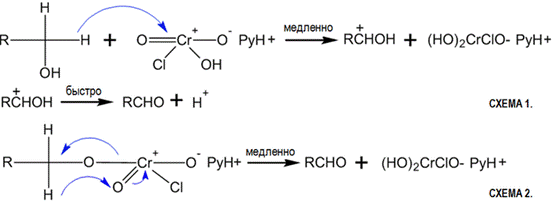
· Окислительная проба: при взаимодействии первичных или вторичных спиртов с реактивом Джонса (раст
|
|
|

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!