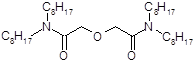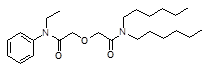Признано, что наилучшими экстракционными свойствами среди диамидов дигликолевой кислоты обладает N, N, N’, N’ - тетраоктил-дигликольамид (TODGA) (Рисунок 3). Он обладает высокой растворимостью в алифатических углеводородах и характеризуется высокими значениями коэффициентов распределения при экстракции актинидов (III) и лантанидов (III) из азотнокислых растворов [ 29, 30 ].
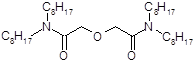
Рисунок 3 - Структура N, N, N’, N’ - тетраоктил-дигликольамида (TODGA)
Коэффициенты распределения америция и кюрия достаточно высоки (> 30) при экстракции из растворов азотной кислоты (с концентрацией выше 1М) 0,1М раствором TODGA в n-додекане и достаточно низки (< 0,01) при реэкстракции 0,01 моль/л раствором азотной кислоты. Экстракция лантаноидов происходит также хорошо [ 31 ].
Экстракционная способность к трехвалентным катионам (Am3+ и Eu3+) у TODGA выше, чем к уранил-иону. Дигликольамиды имеют в своем строении два карбонильных кислорода и один эфирный кислород. Проведенные структурные исследования показали, что молекула дигликольамида координируется различным образом при экстракции разных металлов. Особое значение для механизма образования комплекса с металлом имеет вклад эфирного кислорода [ 32 ]. В таблице 1 представлены данные по экстракции актинидов и лантанидов и коэффициенты разделения от Am [ 30 ].
Таблица 1 - Экстракция металлов из 1М HNO3. Экстрагент - 0,1М TODGA в n-додекане
| Металл
| DM
| DM/DAm
|
| La (III)
| 5,3
| 0,18
|
| Eu (III)
| 265
| 8,8
|
| Lu (III)
| 631
| 21
|
| Th (IV)
| 147
| 4,9
|
| U (VI)
| 0,8
| 0,027
|
| Np(V)
| 0,0056
| 0,00020
|
| Am(III)
| 30
| 1,0
|
| Cm(III)
| 78
| 2,6
|
| Cf(III)
| 156
| 5,2
|
Экстракционная способность TODGA по отношению к актинидам уменьшается в ряду: An(IV) > An(III) > An(VI) > An(V), причём тяжелые актиниды экстрагируются лучше, чем более легкие. Для 1М HNO3: D (Th(IV)), D (Cm(III)) > D (Am(III)) [ 33 ].
Исследование экстракционных свойств TODGA показывает, что экстракционная способность данного диамида строго зависит от степени окисления извлекаемого элемента. Коэффициент распределения достигающий значений выше 50 был получен при экстракции Ca (II), Sc (II), Y (III), Zr (IV), Ln (III), Hf (IV), Bi (III), актинидов (III) и (IV), с ионным радиусом равным 100 пм для двухвалентных, 87 - 116 пм для трехвалентных и 83 - 105 пм для четырехвалентных элементов. Методом сдвига равновесия был определен состав экстрагируемых комплексов: M(TODGA)3(NO3)n или M(TODGA)4(NO3)n, где n = 3 или 4, кроме Ca (II) - Ca(TODGA)2(NO3)2 [ 34 ].
Экстракционная способность TODGA и его гомологов по отношению к щелочноземельным металлам изменяется в ряду Ca (II) > Sr (II) > Ba (II) [3 5 ]. Таким образом, с увеличением ионного радиуса извлекаемого металла происходит снижение коэффициентов распределения (ионные радиусы: 112, 125, и 142, для Ca, Sr и Ba, соответственно). Аналогичная зависимость экстракционной способности от ионного радиуса была получена и для лантаноидов [ 30 ]. Предположительный механизм экстракции щелочноземельных металлов описывается следующим уравнением:
M2+ + 2NO3- + 2TODGA + HNO3 M(NO3-)2(TODGA)2(HNO3) [ 35 ] (3)
Экстракционная способность TODGA была исследована в 11 растворителях. Наибольшие значения коэффициенты распределения металлов принимают при использовании растворителей с высокими диэлектрическими константами (нитробензол, 1-октанол), и наименьшие при использовании хлорированных и ароматических растворителей [ 30 ].
Таблица 2 - Экстракция Am и Eu из 1 М HNO3. Экстрагент - 0,1М TODGA в растворителе
| Органический растворитель
| DAm
| DEu
|
| Нитробензол
| 220
| >500
|
| 1,2 - Дихлорэтан
| 9,9
| 34
|
| 1-Октанол
| 81
| >500
|
| Этилацетат
| >500
| >500
|
| Хлороформ
| 0,12
| 0,097
|
| Диэтиловый эфир
| 100
| 300
|
| Бензол
| 0,39
| 0,83
|
| Толуол
| 0,3
| 0,79
|
| Тетрахлорметан
| 0,095
| 0,39
|
| n-Додекан
| 30
| 265
|
| n-Гексан
| 33
| >500
|
Исследование экстракции америция из различных кислот раствором 0,1 моль/л TODGA в додекане показало, что коэффициенты распределения Am возрастают в ряду: HCl < HNO3 << HClO4 [ 36, 37 ]. В случае соляной кислоты существенного изменения коэффициентов распределения не происходит вплоть до 2 моль/л HCl. Значения коэффициентов распределения при экстракции из HClO4 являются наибольшими и практически не меняются с изменением концентрации кислоты от 0,1 до 6 моль/л. Высокие DAm при экстракции из хлорной кислоты можно объяснить, так называемым, перхлоратным эффектом, замеченным ранее для бидентантых экстрагентов [ 38, 39 ]. Например, добавление хлорной кислоты к азотно- и фосфорнокислым растворам вызывает значительный рост (на несколько порядков) коэффициентов распределения америция при его экстракции CMPO.
В случае экстракции Am из HNO3, коэффициенты распределения металла резко возрастают с ростом концентрации кислоты вплоть до концентрации 3 моль/л, при которой значения коэффициентов распределения выходят на плато - происходит насыщение экстрагента. Коэффициенты распределения U в данных условиях продолжают расти вплоть до 6 моль/л HNO3 [ 30 ].
Еще одной характерной особенностью TODGA, наравне с образованием третьей фазы, является склонность к агрегации при экстракции кислоты. Агрегаты представляют собой сферические обратные мицеллы, состоящие из полярного центра, содержащего молекулы воды и ионы экстрагируемого металла, окруженного примерно четырьмя молекулами TODGA [ 40 ]. Состав агрегатов сильно зависит от кислотности водной фазы. 0,1 моль/л раствор TODGA, при равновесной концентрации азотной кислоты в водной фазе меньшей 0,7 моль/л, представляет собой смесь мономеров и димеров. При повышении кислотности водной фазы, молекулы экстрагента образуют более крупные агрегаты содержащие вплоть до семи молекул TODGA [ 41, 42 ].
Исследования радиационной стабильности TODGA показало, что основными продуктами радиолиза являются диоктиламин и N, N’ - диоктилмоноамиды. Использованный в качестве растворителя n-додекан повышает радиолиз, за счет сенсибилизирующего эффекта n-додекана. Добавление таких веществ, как бензол или N, N’ - диоктилгексанамид, к раствору TODGA в n-додекане защищает TODGA от радиолиза. В системе TODGA-n-додекан-HNO3, соэкстрагируемая кислота не оказывает промотирующего действия на радиолиз дигликольамида. В сравнении с другими экстрагентами, например малонамидами, TODGA характеризуется меньшей радиолитической устойчивостью. При комнатной температуре TODGA обладает высокой гидролитической устойчивостью [ 43 ]
На использовании TODGA в качестве экстрагента основан так называемый ARTIST -процесс, разработанный японскими учеными. Данныйпроцесс включает два этапа: изоляция U (VI) от продуктов деления с помощью разветвленных алкильных производных моноамидов и соэкстракция актинидов с использованием TODGA. Другое назначение данного процесса заключается в применении его для разделения трехвалентных актинидов и лантанидов и в отделении актинидов от продуктов деления, 90Sr и 137Cs [ 33 ].
Цели и задачи работы
диамид экстрагент радионуклид европий
Целью данной работы явилось изучение экстракционного извлечения европия и америция из кислых сред тетраоктил дигликольамидом в полярных фторированных разбавителях.
Для достижения этой цели поставлены следующие задачи:
1 Исследование экстракционных свойств татраоктил дигликольамида в полярных фторированных разбавителях по отношению к европию и амерцию в кислых средах.
2 Изучение влияния типа растворителя на экстракцию. Изучение влияния типа кислой среды на экстракционные способности TODGA.
Экспериментальная часть
Объекты исследования
Объектами исследования являются экстрагент и разбавители. В качестве экстрагента использовали тетраоктил дигликольамид. В исследовательской работе, в качестве растворителей для тетраоктил дигликольамида, были использованы тяжелые фторированные полярные растворители такие как: метанитробензотрифторид (Ф-3), фенилтрифторметилсульфон (ФС-13) и 1,1,2,2,3,4,4,10,10,11,11,12,12,13,13 гексадекафтор - 6,8 - диоксатридекан (формаль-2), а также используемые для сравнения полярные не фторированные растворители - дихлорэтан и не полярные расворители - додекан. Основные свойства растворителей указаны в таблице 3.
Таблица 3 - Свойства использованных растворителей
| Наименование растворителя
| Структурная формула
| Плотность, d420 г/см3
| Диэлектрическая проницаемость, e
| Вязкость, При 20 oC, МПа*с
|
| ДХЭ
| 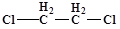
| 1,252
| 10,4
| 0,89
|
| Ф-3
| 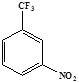
| 1,436
| 22,3
| 3,02
|
| Формаль-2
| 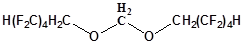
| 1,673
| -
| 13,4
|
| Додекан
| С12Н26
| 0,749
| 2,016
| 1,26
|
| ФС-13
| 
| 1,410
| 29,0
| 3,60
|
Растворитель Ф-3 очищали последовательной двукратной промывкой раствором 1 М гидроокиси натрия, затем 3 М азотной кислотой, дистиллированной водой до нейтральной реакции и фильтрованием через бумажный фильтр. ДХЭ очищали промывкой 6 М серной кислотой и дистиллированной водой до нейтральной реакции. Сушили над безводным углекислым калием и перегоняли при атмосферном давлении. Формаль-2 очищали перегонкой при пониженном давлении.
Экстрагент - тетраоктил дигликольамид (TODGA) был предоставлен фирмой «Katchem», РЖЕЖ, Чехия. Другие амиды были синтезированы в Институте Органической химии Национальной Академии наук Украины (Киев, Украина). Свойства впервые синтезированных соединений представлены в таблица 4.
Таблица 4 - Формулы и ПМР-спектры диамидов дигликолевой кислоты
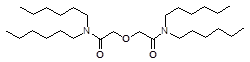
N, N, N`, N` - Тетрагексил дигликольамида
| (АМ-1))1H NMR (d, ppm, (CDCl3, TMS): 0.86 (m, 12H, CH3), 1.26 (s 24H, N(CH2)2(CH2)3 CH3), 1.51 (m, 8H, NCH2 CH2), 4.15 (t, J = 7.4 Hz, 4H, N CH2), 3.28 (t, J = 7.4 Hz, 4H, N CH2), 4.32 (s, 4H, C(O) CH2 O CH2 C(O))
|
|
N, N, N`, N` - Тетраоктил дигликольамида
| (АМ-2 TODGA))1H NMR (d, ppm, (CDCl3, TMS): 0.86 (m, 12H, CH3), 1.26 (s 32H, N(CH2)2(CH2)3 CH3), 1.51 (m, 8H, NCH2 CH2), 4.15 (t, J = 7.4 Hz, 4H, N CH2), 3.28 (t, J = 7.4 Hz, 4H, N CH2), 4.32 (s, 4H, C(O) CH2 O CH2 C(O))
|
|

Продолжение таблицы 4
| 2 - [(Этил-фенил-карбамоил) - метокси] - N, N-диприпил-ацетамид (АМ-3)1H ЯМР спектр (d, ppm, (CDCl3, TMS): 0.89 (m, 6H, N(CH2)2 CH 3), 1.11 (t, J = 7.4 Hz, 3H, NCH2 CH 3), 1.53 (m, 4H, NCH2 CH 2), 3.21 (m, 4H, N CH 2 CH2CH3 + N CH 2 CH3), 3.75 (m, 2H, N CH2 CH2CH3), 3.93 (s, 2H, O CH2 C(O)), 4.28 (s, 2H, O CH2 C(O)), 7.15 (d, J = 12.6 Hz, 2H, Ar H), 7.38 (t, J = 7.4 Hz, 3H, Ar H).
|
|
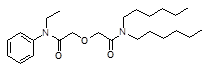
| 2 - [(Этил-фенил-карбамоил) - метокси] - N, N-дигексил-ацетамид (АМ-4)1H NMR (d, ppm, (CDCl3, TMS): 0.87 (m, 6H, N(CH2)5 CH 3), 1.11 (t, J = 7.4 Hz, 3H, NCH2 CH 3), 1.23 (m, 4H, N(CH2)2(CH 2)3), 1.46 (m, 4H, NCH2 CH 2 (CH2)3CH3), 3.22 (m, 4H, N CH 2 (CH2)4CH3 + N CH 2 CH3), 3.72 (m, 2H, N CH 2 (CH2)4CH3), 3.93 (s, 2H, O CH 2 C(O)), 4.26 (s, 2H, O CH 2 C(O)), 7.12 (d, J = 12.6 Hz, 2H, Ar H), 7.39 (t, J = 7.4 Hz, 3H, Ar H).
|
|
Методика эксперимента
Экстракцию проводили в полипропиленовых пробирках объемом 1.5 мл, при t=(22±1) С0 и времени контакта фаз 3 минуты. После перемешивания смесь водной и органической фаз в соотношении 1:1 разделяли центрифугированием при частоте 2200 об/мин в течение 5-10 минут. Затем отбирали аликвотную часть раствора для анализа.
Экстрацию азотной кислоты проводили в полипропиленовых пробирках объёмом 5,4 мл, при t=(22±1) 0С и времени контакта фаз 3 минуты, В:О=1:1. Затем методом титрования, используя в качестве титранта 0,1М NaOH и в качестве индикатора бром-крезол зеленый, определяли количество азотной кислоты в водной фазе. В органической фазе определяли по формуле:
Сорг.= Сисх. - С вод. (4)
Коэффициент распределения определяли:
HNO3 =[HNO3]орг/[HNO3]вод. (5)
3.3 Методика определения
Для определения коэффициента распределения Am (III) и Eu (III), в полиэтиленовую пробирку объёмом 1,5 мл, помещали по 0,6 мл органической и водной фаз необходимого состава, и перемешивали при температуре 20±2˚C в течение 5 минут (по данным предварительных опытов этого времени достаточно для установления равновесия). Водная фаза содержала 1·10-6 М нитрата европия и радиоизотопную метку соответствующего элемента (Am241, Eu152). Основной массив данных получен при совместной экстракции америция (III) и европия (III). Ранее определено, что коэффициенты распределения при совместном извлечении практически не отличаются от коэффициентов при раздельном извлечении Am/Eu. Фазы разделяли центрифугированием при 2200 об/мин в течение 10 минут, затем аликвоты по 0,4 мл органической и водной фаз помещали в полиэтиленовые пробирки ёмкостью 0,5 мл. Коэффициент распределения определяли на сцинтилляционном γ-спектрометре «DeskTop InSpector» на основе NaJ-детектора 51Ч51 мм с колодцем производства фирмы «Canberra». Продолжительность измерения выбирали так, чтобы погрешность радиометрических измерений не превышала 10%. По результатам анализа рассчитывали коэффициент распределения металла по формуле:
M = Aорг/Aвод (6)
где Aорг(вод) - удельная активность в органической (водной) фазе, Бк / мл.
Коэффициент разделения пары Am / Eu определяли как:
Кр = DAm / DEu (7).
Результаты и обсуждение
Результаты изучения экстракции америция и европия различными диамидами дигликолевой кислоты приведены в таблицах 3 и 4.
Таблица 5 - Экстракция Am (III) и Eu (III) из азотнокислых сред дигликольамидами
|
| Дигликольамид в Ф-3
|
|
| 0,01 M АМ-2
| 0,04 M АМ-3
| 0,04 M AM-4
|
| CHNO3исх
| DAm
| DEu
| DAm
| DEu
| DAm
| DEu
|
| 0,1
| -
| -
| 0,19
| 0,19
| 0,24
| 0,26
|
| 0,3
| 0,53
| 0,81
| 0,55
| 0,58
| 0,67
| 0,76
|
| 1,0
| 2,9
| 11
| 2,6
| 4,1
| 3,1
| 11
|
| 3,0
| 3,7
| 28
| 8,7
| 40
| 10
| 64
|
| 6,0
| 0,35
| 3,3
| 10
| 120
| 12
| 150
|
Таблица 6 - Эффективность экстракции Am (III) и Eu (III) из 1 M и 3 M азотной кислоты тетрагексил дигликольамидом (АМ-1)
|
| ФС-13
| Нитробензол
| Ф-3
|
| СМ-1, M
| 1,0 M
| 3,0 M
| 1,0 M
| 3,0 M
| 1,0 M
| 3,0 M
|
|
| DEu
| DAm
| DEu
| DAm
| DEu
| DAm
| DEu
| DAm
| DEu
| DAm
| DEu
| DAm
|
| 0,1
| 90
| 82
| 440
| 330
| 230
| 160
| 600
| 250
| 420
| 112
| 630
| 270
|
| 0,05
| 67
| 19
| 230
| 40
| 200
| 48
| 330
| 60
| 180
| 32
| 260
| 95
|
| 0,025
| 16
| 5,9
| 45
| 9,1
| 48
| 14
| 52
| 11
| 40
| 10
| 190
| 28
|
| 0,001
| 2,5
| 1,5
| 3,8
| 1,4
| 7,2
| 2,9
| 4,7
| 1,4
| 5,8
| 2,3
| 15
| 3,7
|
Данные таблиц 3 и 4 свидетельствуют, что максимальной экстракционной способностью из изученных диамидов обладает тетрагексилдиамид дигликолевой кислоты (АМ-1). Его экстракционные свойства заметно лучше, чем для триалкилмонофенилпроизводных и совпадают с экстракционными свойствами тетраоктилдиамида дигликолевой кислоты (TODGA). Также очевидно, что разбавитель существенно влияет на экстракционные свойства экстрагента и разделение америций - европий. Для поиска наиболее эффективной экстракционной системы целесообразно изучить экстракционную способность TODGA во фторированных разбавителях. Экстракционная способность TODGA ранее была исследована в 11 различных растворителях. Наибольшие значения коэффициенты распределения металлов принимают при использовании таких растворителей как: этилацетат > диэтиловый эфир > нитробензол > 1-октанол, и наименьшие при использовании хлорпроизводных метана, этана и ароматических растворителей (таблица 2).
В данной работе сравнение полярных тяжелых фторированных (ПТФ) растворителей проводили с ДХЭ и додеканом. Выбор растворителей для сравнения обусловлен тем, что ДХЭ и додекан, а также их аналоги, наиболее распространены в жидкостной экстракции. Кроме этого, практически во всех опубликованных работ, где исследуется экстракционные свойства диамидов дигликолевой кислоты, в качестве растворителя используют додекан.
Экстракция азотной кислоты
Экстракцию радионуклидов проводим из азотнокислых сред. Обосновывается это тем, что при переработке ОЯТ методом жидкостной экстракции используют в основном азотнокислые растворы. Рафинат PUREX-процесса, для фракционирования которого планируется использовать изучаемые здесь экстрагенты, также является азотнокислым.
Диамиды дигликолевой кислоты относятся к классу нейтральных экстрагентов. Экстракционные свойства данных экстрагентов сильно зависят от кислотности среды. Для определения влияния природы разбавителя на эффективность и селективность экстракции системами на основе TODGA, необходимо изучить экстракцию азотной кислоты.
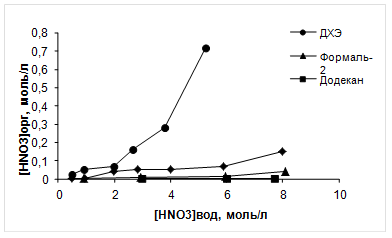
Рисунок 4 - Изотерма экстракции азотной кислоты различными разбавителями
Как видно из рисунка 4, заметная экстракция азотной кислоты для всех разбавителей наблюдается при [HNO3]вод > 4 M. Наименьшие значения экстракции азотной кислоты наблюдается для Ф-3, а наибольшие для ДХЭ. В случае формаль-2 наблюдается значительное увеличение экстракции азотной кислоты при [HNO3]вод > 6 M. Природа растворителя практически не влияет на экстракцию азотной кислоты растворами TODGA в разбавителе (рисунок 5). Представленные данные показывают, что при экстракции азотной кислоты растворами TODGA, на 1 M TODGA экстрагируется 3 M HNO3.
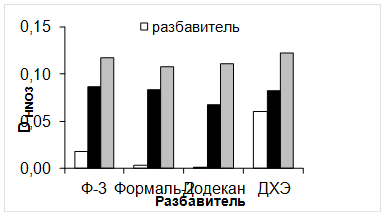
Рисунок 5 - Зависимость коэффициента распределения азотной кислоты (DHNO3) от природы разбавителя для систем: TODGA - разбавитель - 3 M HNO3