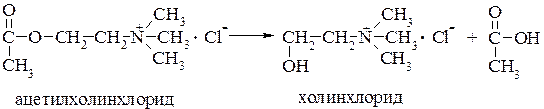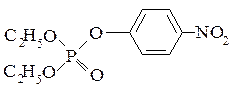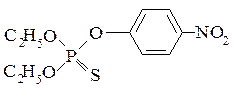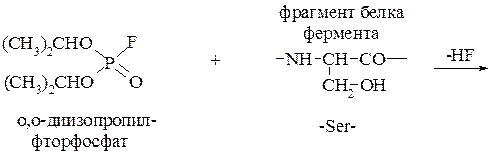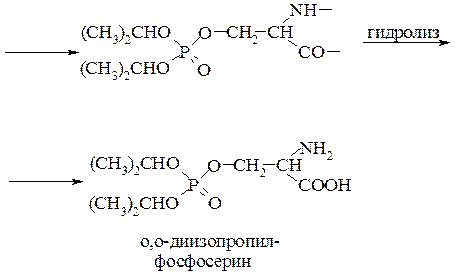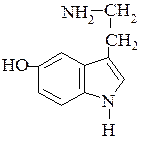Одним из последствий взаимодействия токсиканта с биомолекулами является изменение активности ферментов. Например, красная кровяная соль – K3[Fe(CN)6], применяемая в фотографии, или цианиды, такие как KCN, используемые в аналитической химии для определения ионов Fe2+, Li+, Sn2+ опасны тем, что взаимодействуют с некоторыми ферментами, в частности, цитохромоксидазами. Основная функция этих железосодержащих белков, называемых цитохромами, состоит в переносе электронов в аэробных клетках. В процессе каталитического переноса валентность содержащегося в них геминового железа не изменяется (или может обратимо меняться). Неорганические соли синильной кислоты, а также сероводород, приводят к ингибированию (инактивации) цитохромоксидаз. Таким образом, клетки теряют способность переносить кислород из крови. Дыхательная цепь при этом разрушается, возникает состояние удушья (тканевая гипоксия).
Некоторые фосфорорганические соединения, называемые нервными ядами, являются высокотоксичными для центральной нервной системы. Они ингибируют действие фермента ацетилхолинэстеразы (АХЭ), функция которого заключается в следующем. В нервной клетке роль передатчика нервного импульса выполняет нейрогормон ацетилхолин. Он содержится в белке яиц, молоке, печени, желчи.
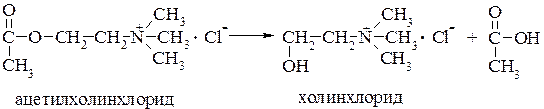
При нормальном функционировании организма избыток ацетилхолина под действием ацетилхолинэстеразы разлагается до холина и уксусной кислоты.
«Нервные яды» ингибируют ее действие. Это приводит к накоплению в клетках избыточного количества ацетилхолина, который действует как яд, и организм погибает при явлениях сильного возбуждения.
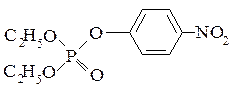
параоксон
В настоящее время установлен механизм действия параоксона – фосфорорганического соединения, применяемого в качестве инсектицида.
Он ингибирует фрагмент активного центра АХЭ – гидроксильную группу боковой цепи серина. При этом сначала образуется переходный комплекс параоксона с белком, затем он распадается. Устойчивость переходного комплекса, характеризующаяся константой аффинности, и скорость распада (гидролиза), зависящая от константы инактивации, определены экспериментально не только для параоксона, но и для многих других фосфорорганических соединений.
Как же правильно поступить? Необходимо или отказаться от применения этих соединений или изменить их структуру так, чтобы уменьшить прочность переходного комплекса. Например, ослабить связь уходящей группы в молекуле, увеличив вероятность ее гидролиза. Таким образом, рассматривая обе конкурентные реакции – взаимодействие фосфорорганического соединения с ферментом и его гидролиз, можно предсказать его токсичность по отношению к человеку.
Поскольку у насекомых АХЭ менее доступна для экзогенных веществ, чем у млекопитающих, существует и другой вариант выхода из данной ситуации – повысить избирательность их действия. Вновь синтезированное химически инертное соединение может превращаться в активное или в организме насекомых или в организме млекопитающих. Примеры такого подхода к синтезу соединений с заданными биологическими свойствами известны из литературны. Если в молекулу параоксона вместо P=O группы ввести P=S, то полученное соединение – паратион - будет практически безвредно для человека, потому что в организме насекомых есть фермент, превращающий его в параоксон, а в организме млекопитающих такого фермента нет.
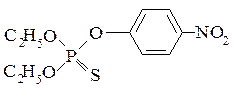
паратион
При замене в молекуле паратиона этокси-групп на метокси-группы также получается малотоксичное для человека соединение, которое может быть использовано как инсектицид.
Хорошо изучен механизм действия О,О -диизопропилфторфосфата, используемого для борьбы с различными насекомыми. Он может быть представлен следующим образом:
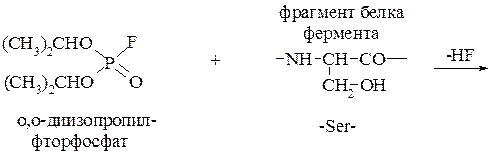
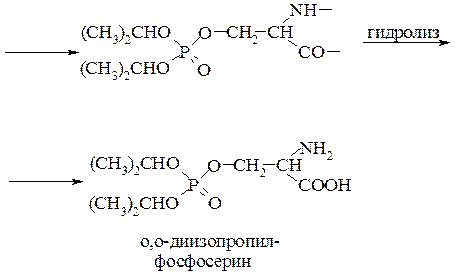
О,О ¢-диизопропилфторфосфат (дихлофос) реагирует с остатком серина (Ser) белковой цепи. Фосфорилирование идет по гидроксильной группе боковой цепи аминокислоты. Последующий гидролиз фосфорилированного полипептида приводит к образованию О, О ¢-диизопропилфосфорилсерина. До того, как была изучена токсичность дихлофоса, его длительное время использовали в медицинской практике для снижения внутриглазного давления при глаукоме.
Сероуглерод, выделяющийся в результате разрушения дитиокарбаматов, является специфическим ингибитором другого фермента – моноаминооксидазы. Это приводит к нарушению обмена биогенных аминов. Они необходимы организму лишь в определенных количествах. Их избыток разрушают моноаминооксидазы. При ингибировании данного фермента в тканях может накапливаться, в частности, серотонин, который действует как токсичное соединение.
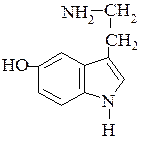
серотонин