Закономерности в атомных спектрах.
Бальмер проводил исследование спектров излучения атомов водорода. Экспериментально было установлено, что атомы водорода (как и атомы других элементов) излучают электромагнитные волны строго определённых частот, другими словами, спектр атома водорода состоит из спектральных линий, длины волн которых строго определены. При этом оказалось, что величину, обратную длине волны спектральной линии, можно рассчитать, как разность, некоторых двух величин, которые называются спектральными термами:
1/λ = Т n1 – Tn2 (1)
Для атома водорода терм можно записать следующим образом:
Tn = Rн/ n2 (2)
где n = 1,2,3... принимает ряд положительных значений,
R h - постоянная Ридберга, численно равная:
R h = (1,097373177 ± 0,000000083) 107м -1.
Тогда длину волны любой спектральной линии водорода можно рассчитать по обобщенной Формуле Бальмера:  (3)
(3)
(n1 = 1,2,3...) (n2=n1, n1+1, n1+2 …)
Длины волн, рассчитанные по формуле (3), совпали с экспериментально измеренными величинами.
Постулаты Бора.
Наличие резких спектральных линий, испускаемых атомами химических элементов, указывает на то, что процессы внутри атомов должны быть дискретны. Законы же классической физика приспособлены для описания непрерывных процессов. Нильс-Бор в 1913 году ясно понял это противоречие и сформулировал два постулата:
1) Атом (и всякая атомная система) может находиться не во всех состояниях, допускаемых классической механикой, а только в некоторых избранных (квантовых) состояниях, характеризующихся определёнными дискретными значениями E1, E2, E3.... В этих состояниях, вопреки классической электродинамике, атом не излучает. Поэтому они называются стационарными состояниями.
2) При переходе из стационарного состояния с большей энергией En2 в стационарное состояние с меньшей энергией E n 1 энергия атома изменяется на E n 2 – E n 1. При этом испускается один фотон с энергией
hν = ħ ω = En2 – En1 (4)
Такое же соотношение справедливо и для случая поглощения. Соотношение (4) называется правилом частот Бора и объясняет комбинационный принцип Ритца. Сравнивая (1) и (4), находим:
Tn = - E n / С h (5)
Тем самым раскрывается физический смысл термов. Они определяются
энергетическими уровнями атомов. Совокупность значений энергии стационарных состояний атома
E1, E2, Е3... образует
энергетический спектр атома.
В спектроскопии спектральные термы и уровни энергий принято изображать горизонтальными линиями, а переходы между ними стрелками. Стрелкам, направленным от высших уровней к низшим, соответствуют линии изучения, стрелкам, проведенным в обратных направлениях, линии поглощения. На рис.1 изображён спектр водорода.
Уровни энергии здесь нумеруются квантовым числом. За нуль принята энергия уровня с n = ∞. Все энергетические уровни, расположенные ниже, дискретны. Им соответствуют отрицательные значения полной энергии атома. Выше линий n = ∞ энергия не квантуется, т.е. энергетический спектр непрерывен. Но при Е<0 движение электрона ограничено, а при Е > 0 не ограничено, т.е. при непрерывном энергетическом спектре атома электрон может, как угодно далеко удаляться от ядра и атом ионизируется.
Таким образом, ядро и электрон образуют связанную систему атом-электрон только в случае дискретного энергетического спектра.
Если понимать под атомом только связанные состояния, то можно сказать,что уровни энергии атома всегда дискретны, как это и постулировал Бор. В квантовой механике строго доказывается, что дискретный энергетический спектр является следствием ограничения области пространства, в которой электрон совершает движение. В случае атома это ограничение области движения электрона вызвано силой притяжения его к ядру. рис.1.Энергетический спектр атома водорода
Двух постулатов Бора, конечно, недостаточно для построения полной теории. Они должны быть дополнены, прежде всего правилами квантования, с помощью которых могут быть вычислены уровни атома.
Модель Бора атома водорода
В качестве исходной посылки Бор взял планетарную модель атома Резерфорда и, пытаясь объяснить наблюдаемые в спектре водорода закономерности, нашел правило квантования. Так он предположил, что возможны лишь такие орбита движения электрона вокруг ядра, для которых момент импульса электрона
L = m v r (6)
где m - масса электрона, V - его скорость, г - радиус орбиты, удовлетворяет условию:
mvr = nћ (n = 1.2.3...) (7)
где n называется главным квантовым числом.
ћ = h / 2 π - постоянная Планка перечёркнутая (постоянная Дирака).
Далее Бор применил законы классической физики. Используя второй закон Ньютона, для электрона, вращающегося под действием кулоновской силы вокруг ядра:  (8)
(8)
и, исключая скорость из уравнений (7) и (8), было получено выражение для радиусов допустимых орбит
 (n =1,2,3…) (9)
(n =1,2,3…) (9)
Радиус первой орбиты водородного атома называется Боровским радиусом и равен
 (10)
(10)
Внутренняя энергия атома равна кинетической энергий электрона и энергии взаимодействия электрона с ядром.
 (11)
(11)
так как  (смотри формулу 8) (12)
(смотри формулу 8) (12)
Подставив в (11) выражение  из (9), найдём разрешённые значения внутренней энергии атома:
из (9), найдём разрешённые значения внутренней энергии атома:  (n= 1.2, 3...) (13)
(n= 1.2, 3...) (13)
При переходе атома водорода из состояния  в состояние
в состояние  излучается фотон.
излучается фотон.  (14)
(14)
Длина волны испускаемого света будет: 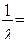
 (15)
(15) 
Мы, следуя Бору, пришли к обобщённой формуле Бальмера (3).
Гипотеза Де Бройля.
Электроны в атомах движутся по законам, отличным от законов классической механики и электродинамики,
Де Бройль предположил, что между корпускулярными и волновыми характеристиками электрона существует точно такая же связь, как между соответствующими характеристиками фотона. В гл. X была приведена связь импульса фотона с длиной волны излучения:
(45.1) p= mф c= mф c2/ c= hv/ c= h/ λ или λ= h/ p (45.2)
Де Бройль постулировал, что соотношение (45.2) справедливо не только для фотонов, но и для электронов. Впоследствии оказалось, что это соотношение верно для любых микрочастиц и систем, состоящих из них.
Электрон движется со скоростью v <c и его импульс p= mev где me= m0 e/(1- v2/ c2)1/2 (45.3)
Таким образом, соотношение де Бройля сопоставляет электрону с импульсом р длину волны или λ= h/ p= или λ= h/ mev (45.4)
При ускорении электрона в электрическом поле с разностью Потенциалов U, не превышающей 104 в, масса электрона практически не отличается от массы покоя т0е. Кинетическая энергия, приобретаемая  электроном в ускоряющем поле, равна
электроном в ускоряющем поле, равна

 и скорость
и скорость
(45.5) Из (45.4) и (45.5) следует (переходя для U к вольтам):
При размерах электронных приборов /«10 см λ>> l и волновые свойства для электронного пучка практически не проявляются. Волновые свойства, в частности дифракция электронов, могут наблюдаться на дифракционной решетке с постоянной порядка ~ К. Так же как и для рентгеновских лучей, дифракцию электронов можно пытаться обнаружить с помощью естественной — кристаллической — решетки
Лазеры
Возможны процессы, при которых поток излучения, проходя через вещество, будет не ослабляться, но усиливаться. Подобные процессы реализуются в приборах, получивших название квантовых усилителей и квантовых генераторов.
Квантовые генераторы, излучающие в диапазоне видимого и инфракрасного излучения, получили название лазеров
В лазере усиление света производится излучением, индуцированным светом, проходящим сквозь вещество.
Рассмотрим условия, при которых такое усиление возможно. Для определенности возьмем в качестве рабочего вещества атомарный газ, так что элементарными поглотителями и излучателями световых квантов будут свободные атомы.
Обозначим через 1 и 2 энергетические уровни атома, переход между которыми отвечает частоте усиливаемого излучения v, так что E1-E2=/hv. Остановимся только на тех переходах, которые реализуются при взаимодействиях с излучением. Переход 1 à2 может произойти только при поглощении фотона, т. е. в результате взаимодействия между атомом и проходящим потоком излучения. Что же касается перехода 2 à1, связанного с излучением фотона, то он может происходить спонтанно (независимо от действия излучения) и индуцирование (т. е. в результате воздействия проходящего потока излучения).
Можно доказать, что при данной плотности потока излучения частоты v вероятность перехода 1 à2 равна вероятности индуцированного перехода 2 à 1).
Если бы спонтанное излучение отсутствовало, то это означало бы, что равновесие между излучением и газом возможно при равном числе атомов в состояниях 1 и 2: N2 – N1 Наличие спонтанного излучения означает добавочную возможность переходов 2 -> 1, так что равновесие возможно только при N2 > N1 , что всегда имеет место при термодинамическом равновесии изолированных систем.
При спонтанном излучении фотон имеет произвольное направление вектора импульса. Фотон индуцированного излучения имеет то же направление, что и фотон, вызвавший его появление. Более того, эти фотоны когерентны — в данной точке пространства и в данный момент времени фазы их волн почти в точности равны между собой (конечно, с точностью до целого числа 2л).
Если речь идет об усилении направленного потока излучения, то из сказанного следует, что интерес представляет лишь индуцированное, но не беспорядочное спонтанное излучение. Усиление проходящего через вещество потока излучения будет тем больше, чем больше будет число индуцированных переходов 2 _à 1 (это число пропорционально числу атомов в состоянии 2, т. е. N%) и чем меньше будет поглощение, т. е. число переходов 1 à2 (это число пропорционально NJ. Большое число спонтанных переходов нежелательно, так как спонтанное излучение, не усиливая проходящего потока, уменьшает ЛГ2 и увеличивает Nj.
Следовательно, условие, при котором можно достигнуть усиления проходящего через вещество излучения, состоит в следующем:
Населенность уровня 2 должна быть больше населенности уровня 1, т. е. N2 > N1



 (3)
(3) 
 (8)
(8) (n =1,2,3…) (9)
(n =1,2,3…) (9)  (10)
(10)  (11)
(11) (смотри формулу 8) (12)
(смотри формулу 8) (12) из (9), найдём разрешённые значения внутренней энергии атома:
из (9), найдём разрешённые значения внутренней энергии атома:  (n= 1.2, 3...) (13)
(n= 1.2, 3...) (13) в состояние
в состояние  излучается фотон.
излучается фотон.  (14)
(14)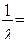
 (15)
(15) 
 электроном в ускоряющем поле, равна
электроном в ускоряющем поле, равна
 и скорость
и скорость


