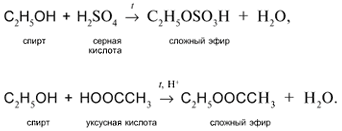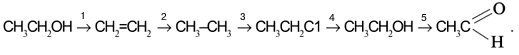ВВЕДЕНИЕ
Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ.
ГЛАВА 1. ПРОИЗВОДСТВО ЭТАНОЛА ФЕРМЕНТАЦИЕЙ БИОМАССЫ
Получение этанола. Обычно этанол получают отгонкой, и, по всей вероятности, этот способ будет применяться и в ближайшем будущем. Отгонка производится в колоннах путем последовательного отделения этанола от других компонентов жидкой фазы.
Отделение барды. В первой колонне отделяются продукты ферментации (главным образом этанол) и некоторое количество воды от неферменти-рующихся твердых веществ в жидкой фазе (барде). Эта колонна обычно называется «пивным перегонным кубом». Желательно, чтобы на этом этапе из жидкой среды был отогнан весь этанол. В некоторых конструкциях колонн возможно увеличение концентрации этанола в верхнем погоне путем ректификации. Для отделения твердых веществ из жидкой фазы, движущейся вниз, предусмотрена отпарная секция.
Производство безводного этанола. Последовательность перегонки после «пивного перегонного куба» зависит от требований, предъявляемых к этанолу. При производстве пищевого этанола последний должен быть очищен в соответствии с требованиями спецификаций на этанол или продукт, в котором он будет использован. При производстве этанола промышленного назначения необходимо удалить из него все загрязняющие вещества, в том числе сивушные масла, которые являются побочными продуктами ферментации. При получении безводного к очищенному продукту добавляют вещества, разрушающие водно-этанольную азеотропную смесь. Этанол и азотообразующую компоненту отделяют друг от друга в следующей колонне. В стандартных условиях для производства безводного этанола требуется по крайней мере четырехкратная перегонка.
Этанол, предназначенный для использования в качестве топлива, не должен содержать воду [8]. Вместе с тем предполагается, что из такого этанола нет необходимости отделять сивушные масла. Поэтому перегонная система для получения этанола, предназначенного для использования в качестве топлива, включает «пивной перегонный куб» с ректификацией и колонны для азеотропной перегонки и отпарки. Спецификации на готовый продукт. Количество энергии, расходуемой на очистку этанола, определяет числа действующих колонн. В каждой колонне для поддержания заданного равновесия паров и жидкости над тарелками расходуется значительное количество тепловой энергии. Поэтому с энергетической точки зрения важное значение имеет спецификация на готовый продукт. В зависимости от спецификации и гибкости установки для производства более широкого ассортимента продуктов эксплуатационные расходы могут возрасти больше или меньше.
Этанол урок одноатомный спирт
Урок-коррекция.
1 этап. 10-15 минут. Учащиеся задают вопросы по тренировочным упражнениям.
2 этап. 20-30 минут. Самостоятельная работа. Работа разноуровневая. Учащиеся выбирают любой вариант.
Самостоятельная работа (тема: “Одноатомные спирты”).
Оценка “удовлетворительно”
| Вариант 1
| Вариант 2
|
| 1. Какие вещества называют спиртами? (привести примеры).
2. Какие спирты образуются в результате гидратации следующих веществ: этена, бутена-2.
3. Осуществить превращения:
1)С2Н 5 ОН->С2Н 4 ->С2Н 5 Cl->С2Н5 ОН
2)ацетилен- >А-> этанол
4. При взаимодействии 12,8 г спирта с натрием образовалось 4,48 л водорода. Какой это спирт?
| 1. Написать общую формулу спиртов. Что такое функциональная группа?
2. Написать уравнение гидролиза водным раствором щелочи следующих соединений: хлорэтана, 2-хлорбутана.
3. Осуществить превращения:
1)СН 4 -> С2Н 2 -> С2Н 4 -> С2Н 5 ОН
2)этанол -> А-> этан
4. При дегидратации 12 г спирта образовался алкен и 3,6 г воды. Какой это спирт?
|
Оценка “хорошо”
| Вариант 3
| Вариант 4
|
| 1. Объяснить образование водородных связей между молекулами спирта и влияние на физические свойства.
2. Как получить спирты из алкенов (привести два примера).
3. Осуществить превращение: оксид углерода (IV) – метанол – хлорметан – этан – углекислый газ.
4. Найти молекулярную массу вещества А: пропанол-1 – А - пропанол-2
5. 0,5 моль метанола нагрели с KBr и H2SO4 и получили 38 г бромметана. Найти выход бромметана
| 1. Как доказать, что спирты отравляюще и пагубно действуют на организм человека.
2. Дописать уравнения и назвать вещества.
1. СН 3 – CHCl - СН 2 - СН 3 + КОН(водн)
2. СН 3 – CHCl - СН 2 - СН 3 + КОН(спирт)
1. Осуществить превращения: метан – этан – этен – этанол – углекислый газ
2. Определить молекулярную массу вещества А: этанол – А – 1,2-дихлорэтан.
3. Какая масса этилата натрия получится при взаимодействии этанола массой 11,5 г с натрием массой 9,2 г?
|
Оценка “отлично”
| Вариант 5
| Вариант 6
|
| 1. Почему температура кипения спиртов намного выше, чем соответствующих углеводородов?
2. Сколько изомерных бутиловых спиртов может образоваться из изомерных алкенов С4Н 8 при их гидратации?
3. Написать уравнения реакций, в результате которых можно получить из метана бутадиен-1,3.
4. Метанол массой 2,04 кг получили взаимодействием оксида углерода (11) объемом 2 м3 с водородом объемом 5 м3 (ну). Найти выход продукта реакции.
5. Определить массу пропанола-2, взятого для реакции, если во время дегидратации пропанола-2 получили пропен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2%.
| 1. Почему нельзя физическими методами получить 100%-ный этанол из его водного раствора?
2. Сколько изомерных третичных спиртов имеют состав.С6Н13 ОН? Написать формулы и назвать.
3. Написать уравнения реакций, в результате которых можно получить из метана диэтиловый эфир.
4. Какую массу бутадиена-1,3 можно получить из спирта объемом 230 л и плотностью 0,8 кг/л, если массовая доля этанола в спирте 95%? Выход продукта реакции составляет 60%.
5. Вычислить массу добытого продукта, если выход на обеих стадиях синтеза составляет по 60%, если известно, что из пропанола-2 массой 24 г добыт 2-бромпропан, из которого синтезировали 2,3-диметилбутан.
|
Химические свойства спиртов
Одноатомные спирты не обладают ни щелочными, ни кислотными свойствами. Водные растворы спиртов на индикаторы не действуют.
Рассмотрим химические свойства спиртов на примере этанола. В молекуле этилового спирта СН3–СН2–ОН имеется четыре типа химических связей, различающихся полярностью: 1) Н–О;
2) С–О; 3) С–Н; 4) С–С. В результате химических превращений разрываются наиболее полярные связи Н–О, С–О и С–Н. Неполярная связь С–С в реакциях спиртов не разрывается.
1. Разрыв связи Н–О в реакции с натрием:
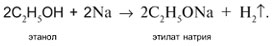
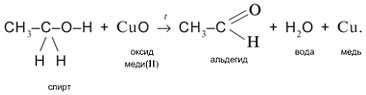
2. Одновременный разрыв связей Н–О и С–Н, находящихся при спиртовом атоме углерода, под действием окислителя (CuO) с отщеплением молекулы Н2О и образованием альдегида (СН3СНО):
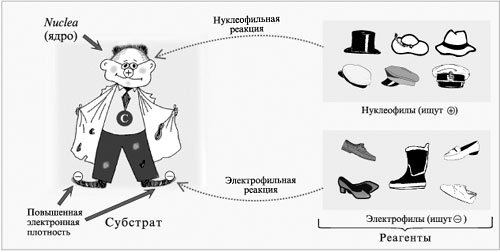
2. Разрыв связи 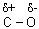 под действием нуклеофильных реагентов (ионов В– или молекул с неравномерным распределением заряда в молекуле
под действием нуклеофильных реагентов (ионов В– или молекул с неравномерным распределением заряда в молекуле 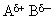 ) в кислой среде.
) в кислой среде.
3. а) Действие кислот НСl или НВr с образованием галогеналканов:
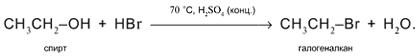
б) Действие кислородсодержащих кислот – неорганических и органических – с образованием сложных эфиров (подробнее см. урок 29):
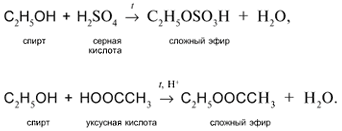
Решение


1. Составьте уравнения реакций пропанола-2 СН3СН(ОН)СН3 со следующими реагентами:
а) Na; б) CuO; в) HCl в присутствии H2SO4 (конц.) при нагревании; г) H2SO4 (конц.) при 160 °С (продукт – алкен); д) H2SO4 (конц.) при 140 °С (продукт – простой эфир).
2. Алюминий реагирует со спиртами подобно натрию. При этом происходит замещение гидроксильного водорода на металл и выделение свободного водорода Н2. Реакция протекает при нагревании около температуры кипения спирта. Составьте уравнения реакций металлического алюминия со спиртами: а) метанолом; б) этанолом.
3. Почему температуры кипения спиртов выше, чем у соответствующих по молекулярной массе углеводородов (С2Н5ОН, Мr = 46, tкип = 78 °С; С3Н8, Мr = 44, tкип = –42 °С)?
4. Напишите схему реакций, с помощью которых пропанол-1 можно превратить в пропанол-2.
Из спиртов ROH получают соединения многих других классов: алкилгалогениды RHal, алкены R'СН=СН2, простые эфиры RОR', сложные эфиры R'СООR, альдегиды R'СНО, карбоновые кислоты R'СООН и т.д. Спирты используют в качестве растворителей при синтезе новых соединений, производстве лаков и красок, фармацевтических препаратов, душистых веществ, парфюмерно-косметической продукции. Этанол используют как дезинфицирующее средство, горючее в двигателях. Он идет также на изготовление алкогольных напитков.

Применение этилового спирта
Для прочного усвоения знаний по химии надо овладеть умением составлять и решать цепочки химических превращений. Решить цепочку – это значит записать уравнения реакций, соответствующие каждой стрелке схемы. В результате удается из имеющихся в наличии веществ получать новые необходимые вещества. Для решения цепочек необходимо знать:
а) способы получения веществ и б) химические свойства веществ различных классов.

Пример цепочки химических превращений в производстве этанола
Задача. Составьте уравнения реакций для цепочки превращений:
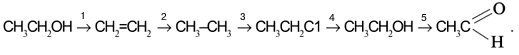
Решение
Воспользуемся удобным способом, помогающим определять реагенты, требуемые для превращения одного вещества в другое: будем находить отличие в составе двух веществ, стоящих по разные стороны от стрелки, и из химической формулы с большим числом атомов вычитать формулу с меньшим числом атомов. Так, для первой стрелки схемы:

Следовательно, чтобы превратить спирт СН3СН2ОН в алкен СН2=СН2, надо отщепить молекулу воды от молекулы спирта:

Вторая реакция схемы состоит в присоединении водорода к алкену:

Третья стрелка схемы представляет реакцию замещения водорода в алкане СН3–СН3 на хлор. Это достигается действием молекулярного хлора на алкан:

Четвертое превращение – замещение атома хлора в хлорэтане С2Н5Сl на гидроксильную группу ОН:

Пятая реакция заключается в отщеплении двух атомов водорода от молекулы спирта. На практике это означает окисление спирта кислородом [O] окислителя, т.е. связывание избыточных атомов Н в форме Н2О:

ЛИТЕРАТУРА
1. О.В. Байдалина. О прикладном аспекте химических знании // Химия в школе, 2005, № 5, с. 45-47.
2. Ахметов Н.С. Методика преподавания темы «Закономерности протекания химических реакций» // Химия в школе. 2002, № 3, с. 15 – 18.
3. Ахметов Н.С. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
4. Рудзитис Г.Е., Фельдман Р.Г. Учебник для 8 класса средней школы. М.: Просвещение, 1992.
5. Материалы сайта www.1september.ru
6. О.С. Габриелян, Н.П. Воскобойникова, А. В. Ящукова. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003 г.
7. Малинин К.М. Технология серной кислоты и серы. М., Л., 1994.
8. Васильев Б.Г., Отвагина М.И. Технология серной кислоты. М., 1985.
9. Отвагина М.И., Явор В.И., Сретенская Н.С., Шарифов М.Ю. Промышленность минеральных удобрений и серной кислоты. М., НИИТЭХИМ. 1972. Выпуск № 4.
10. Резницкий И.Г. Возможности использования нитрозного способа для переработки газов автогенных процессов на серную кислоту / Цветные металлы. 1991. № 4.
11. Березина Л.Т., Борисова С.И. Утилизация фосфогипсов - важнейшая экологическая проблема // Химическая промышленность. 1999 г. № 12.
12. Громов А.П. Экологические аспекты производства серной кислоты // Экология и промышленность России. 2001, № 12.
13. Лидин Р.А. Химия: Руководство к экзаменам / Р. А. Лидин, В. Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. с. 64 – 70.
14. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А.А. Каверина, Д.Ю. Добротин, М.Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51.
15. Химия: Большой справочник для школьников и поступающих в вузы / Е.А. Алферова, Н.С. Ахметов, Н.В. Богомолова и др. М.: Дрофа, 1999. с. 430-438
16. Р.П. Суровцева, С.В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.
ВВЕДЕНИЕ
Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ.
ГЛАВА 1. ПРОИЗВОДСТВО ЭТАНОЛА ФЕРМЕНТАЦИЕЙ БИОМАССЫ
Получение этанола. Обычно этанол получают отгонкой, и, по всей вероятности, этот способ будет применяться и в ближайшем будущем. Отгонка производится в колоннах путем последовательного отделения этанола от других компонентов жидкой фазы.
Отделение барды. В первой колонне отделяются продукты ферментации (главным образом этанол) и некоторое количество воды от неферменти-рующихся твердых веществ в жидкой фазе (барде). Эта колонна обычно называется «пивным перегонным кубом». Желательно, чтобы на этом этапе из жидкой среды был отогнан весь этанол. В некоторых конструкциях колонн возможно увеличение концентрации этанола в верхнем погоне путем ректификации. Для отделения твердых веществ из жидкой фазы, движущейся вниз, предусмотрена отпарная секция.
Производство безводного этанола. Последовательность перегонки после «пивного перегонного куба» зависит от требований, предъявляемых к этанолу. При производстве пищевого этанола последний должен быть очищен в соответствии с требованиями спецификаций на этанол или продукт, в котором он будет использован. При производстве этанола промышленного назначения необходимо удалить из него все загрязняющие вещества, в том числе сивушные масла, которые являются побочными продуктами ферментации. При получении безводного к очищенному продукту добавляют вещества, разрушающие водно-этанольную азеотропную смесь. Этанол и азотообразующую компоненту отделяют друг от друга в следующей колонне. В стандартных условиях для производства безводного этанола требуется по крайней мере четырехкратная перегонка.
Этанол, предназначенный для использования в качестве топлива, не должен содержать воду [8]. Вместе с тем предполагается, что из такого этанола нет необходимости отделять сивушные масла. Поэтому перегонная система для получения этанола, предназначенного для использования в качестве топлива, включает «пивной перегонный куб» с ректификацией и колонны для азеотропной перегонки и отпарки. Спецификации на готовый продукт. Количество энергии, расходуемой на очистку этанола, определяет числа действующих колонн. В каждой колонне для поддержания заданного равновесия паров и жидкости над тарелками расходуется значительное количество тепловой энергии. Поэтому с энергетической точки зрения важное значение имеет спецификация на готовый продукт. В зависимости от спецификации и гибкости установки для производства более широкого ассортимента продуктов эксплуатационные расходы могут возрасти больше или меньше.



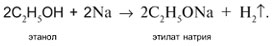

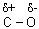 под действием нуклеофильных реагентов (ионов В– или молекул с неравномерным распределением заряда в молекуле
под действием нуклеофильных реагентов (ионов В– или молекул с неравномерным распределением заряда в молекуле 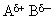 ) в кислой среде.
) в кислой среде.