

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Интересное:
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
У элементов IIБ-группы предпоследний электронный слой полностью заполнен, «неспаренных» электронов нет.
Элементы IIБ-группы имеют два спаренных электрона на s-подуровне внешнего уровня. Эти электроны и определяют постоянную валентность, равную двум.
Увеличение электроотрицательности в ряду элементов IIБ-группы Zn(1,6)—Сd(1,7)—Нg(1,9) приводит к ослаблению основных и восстановительных свойств, т.е. возрастает неметалличность элемента.
Цинк, кадмий и ртуть, как и все d-элементы, образуют большое число комплексных соединений.
Цинк — элемент побочной подгруппы второй группы, четвёртого периода ПС, с атомным номером30.Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства. Оксид цинка (II) ZnO – белые кристаллы. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом: ZnO + C → Zn + CO;
ZnO + CO → Zn + CO; ZnO + H → Zn + HO.
Гидроксид цинка (II) Zn(OH) – бесцветное кристаллическое или аморфное вещество. При температуре выше 125°С разлагается:
Zn(OH) → ZnO + H O.
Кадмий представляет собой белый блестящий металл. На воздухе он быстро тускнеет благодаря образованию тонкой окисной пленки.
Оксид кадмия CdO образуется при горении кадмия в виде коричневого порошка. При нагревании около 700° начинает возгоняться не плавясь. При более сильном нагревании разлагается. Поэтому при нагревании оксид кадмия легко восстанавливается, в токе водорода уже при 270-300°, углеродом или окисью углерода при температуре 700°.
Гидроксид кадмия Сd(OH)2 в виде белого осадка выпадает при действии щелочи на растворы солей кадмия. Она практически не растворяется в избытке осадителя, но растворима в водном растворе аммиака. Обладает очень слабым амфотерным характером, образуя гидроксокадматы. Сульфид кадмия CdS выделяется в виде желтого осадка при пропускании сероводорода в растворы солей кадмия. При прокаливании оксида кадмия с серой он получается в виде красивых кристаллов. Свежеосажденный сульфид кадмия очень мало растворим в растворе сернистого аммония и совсем не растворяется в растворах сульфидов щелочных металлов. Сульфид кадмия нерастворим в разбавленной соляной кислоте, но растворяется в концентрированных кислотах, в теплой разбавленной азотной кислоте, а также в кипящей разбавленной серной кислоте.
|
|
Ртуть. Для ртути характерны две степени окисления: +1и +2.В степени окисления +1ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании.
На холоде ртуть+2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I).В степени окисления +2ртуть образует катионы Hg2+,которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных растворах. В более концентрированных растворах он дегидратируется.
Zn, Cd, Hg – микроэлементы. Кадмий и ртуть– примесные элементы. Около 70% ртути сосредоточено в жировой и мышечной тканях. Кадмий локализуется на 30%в почках, остальное – в печени, легких, поджелудочной железе.
Цинк. В организме взрослого человека больше всего цинка в мышцах (65%) и костях (20%). Остальное количество приходится на плазму крови, печень, эритроциты. Токсичность ртути связана с агглютинацией (склеиванием, слипанием) эритроцитов, ингибированием ферментов. Токсичность кадмия связана с его сродством к нуклеиновым кислотам. В результате его присоединения к ДНК нарушается ее функционирование.
|
|
В качестве глазных капель применяют 0,25%-ный водный раствор цинк сульфата ZnSО4. В стоматологии цинк хлорид ZnСl2 используют для прижигания папилом, для лечения воспаленных слизистых.
Хлорид ртуть (II) Нg2Сl2 (сулема) водные растворы при больших разбавлениях применяются для дезинфекции. Для лечения кожных и венерических заболеваний применяют мази, содержащие оксид ртути (II) НgО и сульфид ртути (II) НgS.
Жидкая ртуть используется в ряде приборов, применяемых в медицине.
Источники ультрафиолетового света — ртутно-кварцевые лампы медицинского назначения содержат газообразную ртуть (пары).
41. Подгруппа хрома. Важнейшие соединения, строения и свойства. Медико-биологическое значение.
6 Б- группу составляют элементы – Cr, Mo, W. Конфигурация валентных электронов Cr, Mo - W
Сумма валентных электронов = 6. У Cr и Mo последний электронный слой занимают 13 эл., у W – 12. Этот слой неустойчив. Поэтому валентность Cr, Mo, W непостоянна. По этой причине набор с.о. от +2 до +6.
В группе d-элементов с увеличением порядкового номера увеличивается устойчивость соединений с высшей и низшей с.о.
Комплексные соединения данной группы элементов чаще всего имеют координационное число 6 и гибридизацию типа
Характерной особенностью соединений этой гр явл склонность к полимеризации кислородных форм эл-ов 6 гр. Это св-во усиливается при движении по гр сверху вниз.
хим св-ва соед Cr. Образует оксиды основного, амфотерного и кислотного характера.
Хром (2)..
Соли двухвалентного хрома являются энергичными восстановителями. Водный раствор хлорида исп-ся в газовом анализе для количественного поглощения О2.
Cr (3) гидроксид облад амф св-ми. Растворяясь в кислотах и щелочах, образует аква- или гидроксокомплексы:
Соединения Cr(6) кислородосодержащие комплексы. Оксид шестивалентного соответствует хромовым кисл-ам. Они образуются при растворении в воде CrO3. CrO3образует полихромные к-ты состава
Мед-био роль. Это микроэлементы живых организмов.
Металлический Cr нетоксичен, а соединения Cr (3) и Cr (6) опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам. Производные Cr (6) обладают концерогенными св-ми. Соед Cr (6) применяются как фунгициды.
Мо. В крови преобладает Мо(6), если лигандом будет кислород, то образуется устойчивые изополимолибдат-ионы:
|
|
Избыточное содержание в пище нарушает метаболизм Са и РО4, вызывая снижение прочности костей – остеопорозы. Входит в сост различн ферм. В орг чел к ним относ альдегидогидроксидазы, ксантиндегидрогеназы.
42. Общая характеристика р-эл-ов. Элементы 3А гр ПС. Важнейшие св-ва соединений В и Аl и их био роль.
Входят В, Аl, Ga, In, TI. Общая электронная формула валентной оболочки атомов эл-в 3А-гр, где n – номер периода, к которому относится элемент Э.. Атомы этих эл-ов имеют по 3 валентных электрона на s-и p-орбит внешнего энергетического уровня. В невозбужденном состоянии неспарен только р-электрон. \Соответственно в соединениях эти эл-ты могут проявлять с.о. +1. Однако, за искл TI, для эл-о 3А-гр более характерн с.о. +3. Для TI с.о. +1
В организме эл-ты 3А-гр наход в с.о. +3.
Металлические свойства р-эл-в 3А-гр выражены значительно слабее, чем у соответствующих эл-в 2А и 1А-гр. У В преобл немеет св-ва.
В целом с ростом порядкового номера мет-ие св-ва эл-в 3А-гр усиливаются.
На св-ах Ga, In, TI сказывается заполнение d- орбит. Так, от Аl к Ga радиус атома уменьш, а энергия ионизации увелич. При переходе от In к TI происходит лишь незначительное увелич радиуса ат и некоторое возрастание эн-ии ионизации.
Оксиды Аl, Ga, In и TI Э2О3 и гидрокс Э(ОН)3 амфотерны, за искл TI гидрокс TI(ОН)3, обладающего только основными св-ми.
Наличие свободных d-орбит во внешн электронной оболочке у атомов Аl, Ga, In и TI сказывается на способностях этих эл-ов проявлять более высокие координационные числа по сравнению с В. Для В характерно корд ч 4. Для остальных 6.
Хим св-ва кислородных соедин В.Оксид имеет кислотный характер. Р-ся в воде с образованием ортоборной к-ты.
Ее протолитические св-ва связ не с отщеплением протонов, а с присоединением ионов ОН. При нагревании легко теряет воду и превращ в метаборную к-ту НВО2, затем в тетраборную Н2В4О7 и в оксид В2О3. При нейтрализации щелочю обр-ся комплексные анионы
При изб щел получ полибораты, выделяющиеся из р-ра в виде кристаллогидратов
К-ту примен в кач-ве антисептич ср-ва.. В зубопротезировании использ в кач наполнителя формы при отливке стальных зубов.
|
|
ХХим св-ва кислородных соед Аl. Он явл-ся типичным амфотерн эл-ом. Мет-ие св-ва выражены сильнее, чем у В. Коорд ч – 6, реже 4.
После удаления защитной пленки энергично взаимод с водой:
Р-ся в к-ах – соляной, разб серной, в щел.
Гидрокс р-ся в к-ах и щел.
Соли р-ся в воде, кроме AlPO4
Фармакологическое действ солей алюм основано на том, что ионы образуют с белками комплексы, выпадающие в виде гелей. Это приводит к гибели микробных кл.
Жженые квасцы используют в виде присыпок как вяжущее действие связ с тем, что жженые квасцы медленно поглощ воду. Вяж действ облад и жидкость Бурова – 8%-ный р-р Al(CH3COO)3
Хим св-ва кислородных соединений Ga, In и TI Коорд ч 6. При растворении гидроксидов и оксидов в кислотах образ-ся аквакомплексы состава а при растворении в щел – гидроксокомплексы состава. Оксиды и гидрокс с вал 3 явл амф соед.
Медико-биол роль.
Бор. Относ к примесным микроэл, его массовая доля 10−5%. Концентрируется главным образов в легких, селезенке, печени, мозге.. Избыток вреден для орг-ма. Большой изб угнетает амилазы, протеиназы, уменьшает активность адреналина. Участвует в углеродно-фосфатном обмене.
Алюминий. Относ к примесным микроэл, его массовая доля 10−5%. Концентрируется в сыворотке крови, легких, печени, почках. Влияет на развитие эпителиальной и соединительной тк, на регенерацию костных тк, влияет на обмен фосфора. Избыток тормозит синтез гемогл.
Биологич активн р-эл-в 3А гр связ с их способностью к образованию компексных соединений с кислородосодержащими лигандами и нерастворимых фосфтов.
43. Общая характеристика р-элементов. 4А группы ПС. Типичные св-ва важнейших соедин С, Si, Pb. Их био роль.
4А-гр ПС составляют С, Si, Ge, Sn, Pb. Общ электронная формула валентной оболочки атомов эл-ов 4Агр: 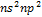 . Атомы этих эл-в имеют по 4 валентных электрона на s- и р-орбиталяхвнешнего энергетического уровня. В невозбужденном состоянии не спарены два р-эл-на. В соединениях эти элементы могут проявлять с.о. +2. Но в возбужденном сост электроны внешнего энергетического ур приобретают конфигурацию
. Атомы этих эл-в имеют по 4 валентных электрона на s- и р-орбиталяхвнешнего энергетического уровня. В невозбужденном состоянии не спарены два р-эл-на. В соединениях эти элементы могут проявлять с.о. +2. Но в возбужденном сост электроны внешнего энергетического ур приобретают конфигурацию  , и все 4 электрона оказываются неспаренными.
, и все 4 электрона оказываются неспаренными.
Радиус ат эл-в 4А-гр возрастают с увеличением порядкого номера. В этом же направлении закономерно снижается энергия ионизации и электроотрицательность.
При переходе от С к Pb немеет св-ва ослаблев, т к снижается способность присоединять электроны и увеличивается легкость отдачи.
Хим св-ва кислородных соед С и кремния. С(4) и кремний(4) оксиды ЭО2 явл-ся кислотными, и соответствующие им гидрокисды Н2ЭО3 – слабыми к-ми. Соответствующие оксиды и гидроксиды остальных эл-ов 4А-гр амфотерны.
СО2 постоянно образ-ся в тк организма в процессе обмена в-в и играет важную роль в регуляции дыхания и кровообращения. Явл-ся физиологическими стимулятором дыхательного центра. Большие конц вызывают ацидоз. Р-ся в воде. При этом в р-ре образ-ся угольная к-та.
|
|
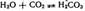
Она как двухосновная к-таа, образует средние и кислые соли: первые наз карбонатами, 2- водородкарбонаты. Все водородкарбонатаы хорошо раств-ся в воде; из средних солей растворимы карбонаты щелочных мет-в и аммония. Р-ры солей угольный к-ты вследствие гидролиза имеют щелочную среду.
Водородкарбонатная буф сист служит главной б.с. плазмы крови, обеспечивающей поддержание кислотно-основного гомеостаза, постоянного значения рН крови порядка 7,4
Т к при гидролизе карбонатов и водородкарбонатов получается щелочная среда, эти соединения применяют в кач антацидных (нейтрализующих к-ты) средств при повышенной кислотности желудочного сока.
В воде хорошо растворимы силикаты только щелочных мет-в. При действии минеральных к-т на р-ры силикатов получают кремниевые к-ты.
Кремниевые к-ты слабее угольной, они выпадают в осадок при действии СО2 на р-ры силикатов. Они сильнее гидролизуются.
Углерод моноксид. Это соединение ядовито и чрезвычайно опасно.
Проникая с воздухом в легкие, углерод (2) оксид быстро проходит через альвеолярно-капиллярную мембрану, р-ся в плазме крови, диффундирует в эритроциты и вступает в обратимое хим-ое взаимодействие как с окисленным, так и с восстановленным гемогл.
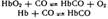
Образующийся карбонилгемоглобин не способен присоединять к снебе кислород. Вследствие этоо становится невозможным перенос кислорода от легких к тк.
Хи св-ва соединений олова и свинца. Оксиды амфотерны, так же как и соответствующие им гидроксиды
Соли Рb 2+ - ацетат, нитрат – хорошо растворимы в воде, малорастворимы хлорид и фторид, практически нерастворимы сульфат, карбонат,Ю хромат, сульфид. Все соединения свинца (2) в особенности растворимые, ядовитыю
Свинец и его соединения относ к ядам, действующим преимущ на нервно-сос сист и непосредственно на кровь. Ионы свинца 2+ являются сильными комплексообраз по сравнению с катионами остальных р-эл-в 4А-гр. Они образуют прочные комплексы с биолигандами. Ионы способны взаимод и блокировать сульфгидрильные группы SH белков, в молекулах ферментов, участвующих в снтезе порфиринов, регулирующих синтез гемма и др биомолекул:
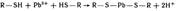
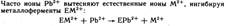
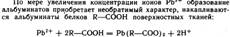
Поэт препараты свинца оказывают вяжущее действие на тк.
Био роль
С. По содержанию в орг-ме человека 21,15%. Относ к макроэл-ам. Входит в сост всех тк и кл в форме белков, жир, угл, витаминов, гормонов.
Si. По содержанию в орг-ме чел 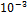 . Относ к примесным микроэл-ам. Больше всего в печени, надпочечниках, волосах.С нарушением обмена связывают возникновение гипертонии, ревматизма. В мед практике применяют кремний (4) карбид SiC – карборунд для шлифовки пломб и пластмассовых протезв. Пыль состоящая из частиц угля, SiO2, алюм, при воздейств на легкие выз пневмокониозы. При вдыхании пыли возникает силикоз.
. Относ к примесным микроэл-ам. Больше всего в печени, надпочечниках, волосах.С нарушением обмена связывают возникновение гипертонии, ревматизма. В мед практике применяют кремний (4) карбид SiC – карборунд для шлифовки пломб и пластмассовых протезв. Пыль состоящая из частиц угля, SiO2, алюм, при воздейств на легкие выз пневмокониозы. При вдыхании пыли возникает силикоз.
германий. В орг-ме 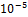 . Микроэлемент. Соединения германия усиливают процессы кровотворения в костном мозге. Малотоксичны.
. Микроэлемент. Соединения германия усиливают процессы кровотворения в костном мозге. Малотоксичны.
Олово.  . Микроэлемент. В кислой среде олово раст-ся и в форме соли поступает в кровь, проявляя токсичные действие
. Микроэлемент. В кислой среде олово раст-ся и в форме соли поступает в кровь, проявляя токсичные действие
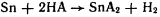
В мед практике находят применение различные материалы, в частности пломбировочные.

Свинец. 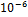 Токсичные соединения. Влияют на синтез белка, энергетический баланс кл и ее генетический аппарат. Влияет на развитие кариеса. Депонируется в основном в скелете в форме труднорастворимого фосфата
Токсичные соединения. Влияют на синтез белка, энергетический баланс кл и ее генетический аппарат. Влияет на развитие кариеса. Депонируется в основном в скелете в форме труднорастворимого фосфата
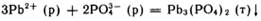

Токсичность соединений элементов 4А-гр с ростом атомной массы эл-та возрастает.
44. Общая характеристика углерода. Углерод – важнейший органоген.
Углерод - важнейший органоген. Общее содержание углерода около 21%. Физиологическая роль углерода определяется тем, что этот элемент входит в состав всех органических соединений и принимает участие во всех биохимических процессах в организме. Окисление биомолекул под действием кислорода приводит к образованию воды и углекислого газа(СО2), который является стимулятором дыхательного центра.
В свободном виде углерод не токсичен, но многие его соединения обладают значительной токсичностью: СО (угарный газ), четыреххлористый углерод ССI4,сероуглерод CS2,соли цианистой кислоты HCN, бензол С6Н6, фосген СОСI2,и ряд других. Углекислый газ в концентрации свыше 10%вызывает ацидоз (снижение рН крови), одышку и паралич дыхательного центра.
В фармации и медицине широко используются различные соединения углерода – производные угольной кислоты и карбоновых кислот, полимеры и др. Активированный уголь применяется для адсорбции газов и выведения из организма различных токсинов, графит в виде мазей используется для лечения кожных заболеваний.
45. Кислотно-основные свойства соединений углерода. Кислотно-основные свойства соединений углерода.Оксид углерода(4) является кислотным оксидом, а соответствующий ему гидроксид - угольная кислота Н2СО3 - слабой кислотой. Он плохо растворяется в воде. При этом вначале в ратворе образуется гидрат СО2 Н2О, а затем этот гидрат медлен но и обратимо превращается в Н2СО3. Большая часть растворен ного в воде оксида углерода(4) находится в виде гидрата.
В организме в эритроцитах крови под действием фермента каррбоангидразы равновесие между гидратом CO2 • Н2О и Н2СО3 устанавливается очень быстро. Образующаяся Н2СО3 диссоциирует в физиологических условиях до гидрокарбонат-аниона, а в более щелочной среде - до карбонат-аниона:
Угольная кислота существует только в растворе. Она образует два ряда солей - гидрокарбонаты (NаНСОз, Са(НС03)2) и карбонаты (Nа2СОз, СаСОз). В водных растворах соли угольной кислоты, особенно карбонаты, легко гидролизуются по аниону, создавая щелочную среду: 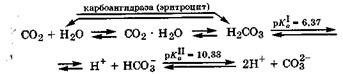
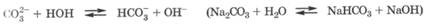 Совокупность угольной кислоты и гидрокарбонат-иона (Н2СО3, НСО3(-)) образует гидрокарбонатную буферную систему
Совокупность угольной кислоты и гидрокарбонат-иона (Н2СО3, НСО3(-)) образует гидрокарбонатную буферную систему
46.Окислительно-восстановительные свойства углерода, особенности реакций дисмутации.
Свойства по отношению к тем элементам, которые стоят правее него в периодической системе.
1) С +неметалл: С +S =CS2
C +O2 =CO2 — оксид углерода (IV) — кислотный оксид:
CO2 +H2O =H2CO3 — угольная кислота
2C+O2 =2CO — оксид углерода (II)несолеобразующий оксид C +H2O (t) =CO +H2 водяной газ 2) С +оксид:
С + Na2O = 2Na + CO
C + CO2 = 2CO
3) С +кислота-окислитель:
С +2H2SO4=CO2 +2SO2+2H2O
C +4HNO3=CO2 +4NO2+2H2O; Углерод может проявлять
окислительные свойства с элементами левее и ниже его в периодической системе:
С +2H2=CH4
3C+4Al =Al4C3— карбид алюминия
С +Si =SiC -карбид кремния. В результате реакций присоединения полярного реагента к субстрату по кратной межуглеродной связи один из атомов углерода понижает степень окисления, проявляя свойства окислителя, а другойповышает степень окисления, выступая восстановителем. В этих случаях имеет место реакция внутримолекулярного окисления-восстановления атомов углерода субстрата, т. е. процесс
дисмутации, под действием реагента, не проявляющего окислительно-восстановительных свойств.
47. Комплексообразующие свойства соединений углерода. В соединениях углерода нет несоединенных электронных пар, поэтому КС образуют те частицы, где электронная плотность повышена. Одним из участников комплексообразования является СО. Наличие повышенной электронной плотности позволяет образовывать молекуле прочные КС с гемоглобином и оксигемоглобином: HHb+CO=HHbCO;HHbO2+CO=HHbCO+O2.Прочность образующегося HHbCO больше в 210 раз, чем прочность исходного HHb. Поэтому СО-отравляющий газ.
48. Токсичность оксида углерода II и цианид-аниона.
Роль метгемоглобина.
Оксид углерода (СО) образуется при неполном сгорании углеродных веществ. СО связывает гемоглобин (Нb), образуя карбоксигемоглобин (СОНb) с низким сродством к кислороду. Высокое сродство СО к гемоглобину(в 220 раз больше кислорода) означает, что даже низкие концентрации СО «запирают» Нb и вызывают угрожающую жизни гипоксию.
Многие цианиды очень ядовиты. Цианид-анион является ингибитором фермента цитохром с-оксидаза в IV комплексе дыхательной цепи переноса электронов. Связывается с железом, входящим в состав фермента, чем препятствует переносу электронов между цитохром с-оксидазой и кислородом. В результате нарушается транспорт электронов, и, следовательно, прекращается аэробный синтез АТФ. Наиболее токсичным цианидом является синильная кислота.
Метгемоглобин способен присоединять к себе цианид-ионы, тем самым он способен предохранять от отравления цианидами. Реакция взаимодействия метгемоглобина с цианид-ионом, приводящая к образованию нетоксичного комплекса - цианметгемоглобина, протекает по схеме:
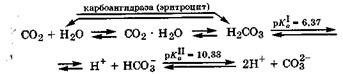
Но метгемоглобин не только связывает циркулирующий в крови цианид, а и освобождает от него заблокированный дыхательный фермент:
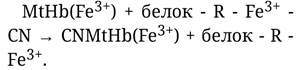
49. Германий, олово, свинец и их ф-х св-ва. Важнейшие соед.
Физические свойства: германий-в компактном состоянии имеет серебристый цвет и по внешнему виду похож на Ме. Олово- серебристо-белый мягкий Ме. Свинец- голубовато-белый тяжелый Me.
Химические свойства: От углерода к свинцу возрастает химическая активность.,уменьшается прочность связи. Свинец на воздухе покрывается оксидной пленкой. При нагревании реагирует с большинством неметаллов:Ge+O2=GeO2.Sn+O2=SnO2. 2Pb+O2=2PbO
Германий взаимодействует только с кислотами окислителями: Ge+4HNO3=H2GeO3+4NO2+H2O. 3Ge+4HNO3+18HF=3H2[GeF6]+4NO+H2O. Взаимодействует с щелочами в присутствии окислителей: Ge+2KOH+2H2O=K2GeO3(германат калия)+H2O.
Олово взаимодействует практически со всеми кислотами. Зависит от концентрации и ее окислительных свойств: Sn+2H2SO4(к)=H2SnO3+2SO2+H2O.
Sn+H2SO4(р)=SnSO4+SO2+2H2O. Sn+4HNO3(к)=SnO2*H2O(оловынкис-та)+4NO2+(2-x)H2O. 4Sn+10HNO3(р)=4Sn(NO3)2+NH4NO3+H2O.Окисляется горячими щелочами: Sn+2NaOH+2H2O=Na2[Sn(OH)4]+H2
Свинец не взаимодействует с разбавленными серной и соляной кислотами из-за образования малорастворимыхPbCl2 и PbSO4. При о у: 3Pb+8HNO3(любая)=3Pb(NO3)2+2NO2+4H2O. Pb+2CH3COOH=Pb(CH3COO)2+H2. С щелочными Ме не реагирует.
Водородные соединения: GenH2n+2-германы.SnH4 и Sn2H6-станаты.PbH4-плюмбан.
Кисродосодержащие соединения:Германий:GeO2+Ge=2GeO сильный восстановитель. Окисляется доGeO2. Оксиды олова и свинца(II) образуются лишь при термическом разложении солей или гидроксидов(II) без доступа воздуха: Pb(NO3)2=PbO+2NO. Монооксид свинца легко растворим в кислотах: PbO+2HNO3=Pb(NO3)2+H2O. Основные свойстваPbO+4NaOH+H2O=Na4[Pb(OH)6] кислотные свойства выражены слабо. Устойчивость и окислительная активность от СО возрастает к PbО, а восстановительная активность, наоборот, уменьшается. SnO2+2NaOH—»Na2SnO3+H2O. 2Na2SnO3+3H2O=Na[Sn2(OH)6].
PbO2-сильный окислитель. При нагревании разлагается с образованием свинцового сурика: 3PbO2—»Pb3O4+O2.
По содержанию в организме человека (10-4 %) олово относится к микроэлементам. Соединения олова токсичны, однако в опытах на животных установлено, что дефицит олова сопровождается замедлением роста и привеса, нарушением минерального состава внутренних органов, ухудшением слуха. Олово входит в состав желудочного фермента гастрина,
Пломбировочные материалы содержат олово.
Свинец и его соединения весьма токсичны. Соединения свинца влияют на синтез белка, энергетический баланс клетки и ее генетический аппарат.
Препараты свинца PbO (антисептик в приготовлении свинцового пластыря) и ацетат (СН3СОО)2Pb∙3Н2O (вяжущее средство при воспалительных заболеваниях кожи и слизистых оболочек) применяются только наружно.
50. Общая характеристика p-элементов 5 а группа. Типичные свойства важнейших соединений азота фосфора мышьяка сурьмы висмута. Их биологическая роль.
Пятую группу периодической системы входят азот,фосфор, мышьяк, сурьма,висмут. Атомы этих элементов имеют 5 валентных электронов на s и p орбитали внешнего энергетического уровня, из них в невозбужденном состоянии атома неспарены 3 электрона, при возбуждении атомов происходит распаривание электронов и переход одного из них на d подуровне (за исключением азота). Атомы элементов этой группы способны образовывать 3 и макс 5 ковалентных связей. В соединениях элементов этой группы проявляют СО +1,+2,+3,+4,+5,-3. Для азота характерны СО +3,+5,-3. Для фосфора +5, реже +3,-3. СО для для мужика из тюрьмы и висмутас +3, +5, и -3.
с увеличением радиусов атомов азота к висмуту закономерно уменьшается энергия ионизации и относительная электроотрицательность. Этим обусловлена ослабления неметаллических свойств в ряду N-P-As-Sb-Bi. азот и фосфор типичные неметаллы мышьяк амфотерен хотя неметаллические свойства сильнее выражены чем неметаллические. С фильма амфотерным металлические и неметаллические свойства примерно одинаковы,для висмута характерно преобладание металлических свойств.Азот и фосфор относятся к макроэлементам, массовая доля азота в организме человека 3,1%, фосфора – 0,95%. Мышьяк, сурьма и висмут относятся к примесным элементам, массовая доля их в организме человека составляет 10-6%.
Азот – органоген номер четыре. Значимость его для живого орга низма очень высока, именно он, наряду с углеродом, водородом и кис лородом, входит в состав жизненно важных аминокислот,
которые образуют ДНК, РНК и белки – основу жизни. Фосфор- органоген номер пять, играет исключительно важную роль в обмене веществ. Суточная потребность человека в фосфоре составляет 1,3 г. Фосфор настолько распространен в пищевых продуктах, что случаи его явной недостаточности практически неизвестны. Однако не весь фосфор, содержащийся в продуктах, может всасываться, поскольку его всасыва ние зависит от многих факторов: рН, соотношения между содержанием кальция и фосфора в пище, наличия в пище жирных кислот. мышьяк,сурьма и висмут постоянно находятся в живых организмах, но их физиологическая роль практически не выяснена. Ионы Аs 3+ и Sb3+ и в меньшей степени Bi3+ являются синергистами. Мышьяк и сурьма накапливаются в щитовидной железе, угнетают её функцию, вызывая эндемический зоб.
51. Фосфор, общая характеристика, положение элементов в ПС. Возможные значения валентности и степени окисления.
В периодической системе фосфор, как и азот, находится в группе 5А, но в 3 периоде. Наличие в валентном слое трех неспаренных электронов приводит к образованию трех связей. Фосфор имеет в валентном слое сво бодные 3 орбитали. Поэтому при возбуждении атома фосфора легко достигается состояние с пятью неспаренными электронами, что позволяет ему образовывать пять связей.
Фосфор в своих соединениях проявляет валент ность 3 и 5. Степень окисления атома фосфора в соединениях может меняться от -3до +5:
РН3(+3), Р2Н4(-2), Р(0), Р2О3(+3), Р2О5(+5)
Фосфор существует в виде нескольких аллотропных модификаций наиболее изученной белый и красный фосфор. Белый фосфор очень токсичен, смертельная доза для взрослого 0,1г(обусловлено хорошей растворимостью в жирах),другие модификации не токсичны. В природе фосфор встречается только в формах, содержащих фосфат-анион РО. Это обусловлено тем, что фосфор образует с
кислородом более прочные связи, чем с другими органогенами. В организме фосфор встречается только в виде фосфатов, неор ганических и органических.
Фосфор легко окисляется кислородом:
4Р+5О2=2Р2О5 (с избытком кислорода)
4Р+3О2=2Р2О3(при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами,серой,некоторыми металлами, проявляя окислительные и восстановительные свойства: 2Р+3Са=Са3Р2 (с металлами — ок-ль, образует фосфиды)
2Р+3S=P2S3 (с неметаллами —вос-ль)
52. Роль фосфатов в организме.
Фосфор в организме и в природе встречается в виде фосфатов. Фосфат в организме выполняют две основные функции: 1) являются структурными
компонентами клеточной мембраны, входят в состав фосфолипидов, основы нуклеиновых кислот
2) РО4 являются основными веществами, которые аккумулируют энергию необходимую для протекания метаболических реакций.Неорганические фосфаты входят в состав буферных систем плазмы и тканевой жидкости.От обмена фосфатов между кровью и костной тканью зависит нормальное течение процессов окостенения, поддержания нормальной костной структуры.Фосфаты являются структурными элементами костной ткани, участвуют в переносе энергии в виде макроэргических связей (АТФ, АДФ)
53.Оксид фосфора (V) Р2О5, взаимодействуя с водой, образует метафосфорную кислоту НРО3; последняя при кипячении образует
ортофосфорную кислоту Н3РО4, при нагревании Н3РO4 образуется дифосфорная (или пирофосфорная) кислота Н4Р2О7. Метафосфорная НРО3 кислота неустойчива и в чистом виде не выделена, так же как не выделены из растворов ее соли. Водой макромолекулы метафосфорной кислоты расщепляются до Н3РО4.Может существовать в виде полимеров (НРО3)n.
Таким образом, метафосфорные кислоты неустойчивы и пред ставляют собой лишь промежуточную ступень реакции гидратации оксида фосфора (V) Р2О5.
Ортофосфорная кислота Н3РO4 — наиболее устойчивая из всех кислот.Представляет собой твердое бесцветное кристаллическое легкоплавкое вещество. Ее кристаллы на воздухе превращаются в сиропообразную массу. Не ядовита. С водой смешивается в любых соотношениях.Как кислота она обладает средней силой. Проявляет свои кислотные свойства при взаимодействии с щелочами:
NaOH+H3PO4=NaH2PO4+H2O.
В водном растворе ортофосфорная кислота подвергается сту пенчато диссоциации:
I ступень: Н3РO4«Н++Н2РO-4
II ступень: Н2РO-4«Н++НРО2-4
III ступень: НРO2-4«Н++РO3-4
Обычно преобладает I ступень диссоциации. Будучи трехосновной, она образует соли — ортофосфаты 3 видов:
1) фосфаты — замещены все атомы водорода в фосфорной кислоте (К3РO4, (NH4)3PO4);
2) гидрофосфаты — замещены два атома водорода кислоты (К2НРO4, (NH4)2HPO4);
3) дигидрофосфаты — замещен один атом водорода кислоты (КН2РO4, NH4H2PO4).
54. Возможность обмена кальция и фосфора.
Обмен фосфора в организме тесно связана с обменом кальция. Это подтверждается уменьшением количества неорганического фосфора при увеличении содержания кальция в крови (антагонизм). Процесс окостенения в растущем организме протекает нормальная только при оптимальном соотношении кальция и фосфора в организме. Регулятором этого отношения является витамин D и гормон кальцитонин.
Избыточно богатая фосфором пища приводит к вымыванию кальция из костей, при избытке кальция развивается мочекаменная болезнь.
факторы, ухудшающие всасывание кальция в кишечнике и снижающие реабсорбцию его в почках, вызывают гипокальциемию, которая может частично компенсироваться вымыванием Ca из костей в кровь, что приводит к развитию остеомаляции или остеопорозов.
Избыточное всасывание Ca в кишечнике приводит к гиперкальциемии, которая компенсируется за счет усиленного отложения его в кости и выведения с мочой.
Неспособность организма удержать нормальный уровень Ca крови вызывает либо тяжелые гипокальциемические состояния, либо приводит к отложениям Ca в различных тканях и органах.
55. Макроэргические свойства полифосфатов. Гидролиз АТФ.
Особого внимания заслуживают макроэргические свойства полифосфатов связь Р-Оимеет значительную длину,Р несет значительный положительный заряд, поэтому этот фрагмент в молекуле фосфата склонен к реакциям гидролиза,реакциям этерификации и реакциям аманолиза (с аминами). Наибольшее значение имеет реакция гидролиза в организме человека 60% у взрослых 80% у новорождённых,так как среда водная.
Гидролиз АТФ.
Получаемая клетками энергия за счёт окисления продуктов питания или от солнечного света переводится в химическую энергию за счёт синтеза в них ATФ.
это вещество в организме выполняет функцию аккумулятора энергии, так как приводить гидролизе образуется АДФ или AMФ и фосфорная кислота и выделяется энергия. Молекула АТФ состоит из 3 остатков пантотеновая кислота, сульфитный остаток и азотистое основание.
АТФ+Н2О= АДФ+Ф+31кдж/моль
АТФ+2Н2О=АМФ+2Ф+62кдж/моль
такие связи при разрыве которых выделяется большое количество энергии называются макроэргическими (Р-О)
Разрыв любой связи в том числе и макроэргической требует всегда затраты энергии.После разрыва связи идут реакции гидратации изомеризации нейтрализации для которых ∆G<0, поэтому и весь суммарный процесс гидролиза АТФ протекает с выделением энергии.
В организме содержится всего 30 г АТФ,для того чтобы обеспечить организм энергией, АТФ гидролизуются десятки тысяч раз, отщепляя фосфор, затем происходит ресинтез АТФ
56.Мышьяк, сурьма, висмут. Их важнейшие соединения. Медико-биологическое значение.
По содержанию в организме человека мышьяк относится к микроэлементам. Он концентрируется в печени, почках, селезенке, легких, костях, волосах. Больше всего мышьяка содержится в мозговой ткани и в мышцах. Мышьяк накапливается в костях и волосах и в течение нескольких лет не выводится из них полностью. Эта особенность используется в судебной экспертизе для выяснения вопроса, имело ли место отравление соединениями мышьяка.
Определение мышьяка в биологическом материале проводят в несложном приборе по реакции Марша: к био–объекту добавляют цинк и соляную кислоту. Выделяю–щийся при реакции водород восстанавливает любое сое–динение мышьяка до арсина.
Если выделяющийся водород содержит примесь ар-сина, то при нагревании газовой смеси происходит раз–ложение AsH3:
2AsH3 = 2As° + 3Н2. и на стенках трубки для газовыделения образуется черный блестящий налет мышьяка – «мышьяковое зер–кало». Реакция Марша весьма чувствительна и позво–ляет обнаружить 7—10-7 г мышьяка.
В относительно больших дозах соединения мышья–ка очень ядовиты. Как уже упоминалось, токсическое действие соединений мышьяка обусловлено блокиро–ванием сульфгидрильных групп ферментов и других биологически активных веществ.
По содержанию в организме человека (10%) сурьма и висмут относятся к микроэлементам. По классифика–ции В. В. Ковальского сурьму и висмут относят к той груп–50б пе микроэлементов, которые постоянно находятся в живых организмах, но физиологическая и био–химическая роль которых практически не выяснена.
Физиологическая роль сурьмы, очевидно, подобна мышьяку. Ионы мышьяка As и сурьмы Sb и в меньшей степени висмут Bi являются синергистами. Так, извест–но, что в биогеохимических провинциях с избытком мышьяка в организмах увеличивается содержание не только мышьяка, но и сурьмы. При этом оба элемента накапливаются в щитовидной железе жителей, угнетают ее функцию и вызывают эндемический зоб. Синергизм мышьяка и сурьмы связан с их способностью к образо–ванию соединений с серосодержащими лигандами. Висмут же более склонен связываться с лигандами, со–держащими аминогруппы. Так, попадание растворимых соединений висмута в организм приводит к угнетению ферментов амино– и карбоксиполипептидазы.
Поступление внутрь организма водорастворимых соединений сурьмы, например стибина SbH3, оказывает токсический эффект подобно соединениям мышьяка. Токсичны и соединения висмута при инъекции. Напри–мер, для собак смертельная доза составляет 6 мг/кг массы. Однако при попадании большинства соединений сурьмы и висмута в пищеварительный тракт они практи–чески не оказывают ядовитого действия. Слабая токсич–ность этих соединений обусловлена тем, что соли Sb (III), Bi (III) в пищеварительном тракте подвергаются гидро–лизу с образованием малорастворимых продуктов, которые не всасываются в стенки желудочно-кишеч–ного тракта.
На этом основано применение лекарственных пре–паратов сурьмы и висмута, например, нитрата висмута основного.
57. Общая физико-химическая характеристика p-элементов. Биологическая роль р-элементов 4 А группы ПС.
Составляют углерод кремний германий олово свинец. Атомы этих элементов имеют 4 валентных электрона на s и P орбиталях внешнего энергетического уровня. В невозбужденном состоянии неспарены 2 электрона,поэтому могут проявлять СО +2. В возбужденном состоянии все 4 электрона оказываются неспаренными. Радиус атомов закономерно возрастают с увеличением порядкового номера,в этом же направлении снижается энергия ионизации и электроотрицательность. в живом организме углерод, кремний и германий находится в степени окисления +4, олово и свинец +2. При переходе от углерода к свинцу неметаллические свойства ослабевают так как снижается способность присоединять электроны и увеличивается легкость отдачи.
По содержанию в организме человека С относится к макроэлементам,он входит в состав всех тканей и клеток. С биологической точки зрения С является органогеном #1. По содержание в ор
|
|
|

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!