В чисто вымытую пробирку помещают по 1 капле 1%-ного раствора серебра нитрата и 10%-ного раствора натрия гидроксида. Наблюдают выделение бурого осадка серебра оксида:

Затем в пробирку при постоянном встряхивании добавляют по каплям 2%-ный водный раствор аммиака до полного растворения осадка.

!!! Необходимо избегать избытка аммиака, т.к. это снижает чувствительность реагента.
К полученному прозрачному раствору реактива Толленса добавляют 2 капли формальдегида. Наблюдают выделение свободного серебра в виде комковатеого чёрного (серого) осадка или зеркального налёта на стенках пробирки.
Реакция используется для качественного обнаружения альдегидной группы:
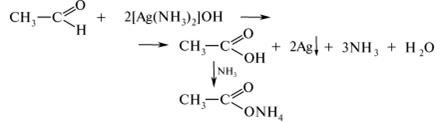
!!! По окончании работы с аммиачным раствором оксида серебра необходимо сразу же вымыть посуду, находившуюся в работе, а образовавшиеся осадки и налёты на стенках растворить разбавленной азотной кислотой.
Вопросы для самостоятельной работы
- Какими реакциями можно различить альдегиды и кетоны? Напишите соответствующие уравнения пеакций.
- Почему реактив Толленса готовят непосредственно перед проведением реакции «серебряного зеркала»?
- Почему в реакции серебряного зеркала не всегда серебро выделяется в виде тонкого налёта на стенках пробирки?
- К реакциям окисления альдегидов относится также восстановление реактива Фелинга. Что это за реактив, для чего он используется. Напишите соответствующие уравнения реакций.
- Какими качественными реакциями можно обнаружить кетоны?
- На чём основано дезинфицирующее действие формальдегида?
Лабораторная работа №9
Тема: Йодоформная проба (проба Либена) на ацетон
Цель: провести йодоформную реакцию с участием ацетона, составить уравнения реакций, сделать выводы, ознакомиться с данной пробой и её применением в фармакологи.
Реактивы и оборудование: раствора йода в калия йодиде, 10%-ный раствор натрия гидроксида, ацетон, пробирки.
Ход работы
В пробирку помещают 1 каплю раствора йода в калия йодиде и прибавляют до обесцвечивания по каплям 10%-ный раствор натрия гидроксида. После добавления в пробирку 1 капли ацетона наблюдают образование желтоватого осадка йодоформа и ощущают характерный запах:

Йодоформная проба положительна для уксусного альдегида и метилкетонов.
Вопросы для самостоятельной работы
- Что такое лакриматоры?
- Как данная проба используется в медицинской практике? Какая ещё подобная проба используется с этой же целью? Опишите кратко (Проба Легаля).
- Одним из продуктов реакции является йодоформ. Как и для чего это вещество применяется в медицине?
Лабораторная работа №10
Тема: Сравнение свойств уксусной и бензойной кислот
Цель: изучить растворимость в воде карбоновых кислот и их солей, определить значения pH растворов кислот, изучить действие перманганата калия на растворы карбоновых кислот, отметить различия, написать уравнения реакций, сделать выводы
Реактивы и оборудование: уксусная и бензойная кислоты, дист. вода, растворы гидроксида натрия, серной кислоты (разб.) и перманганата калия, универсальная индикаторная бумага, пипетки, пробирки, сухое горючее.
Ход работы
Опыт №1 Растворимость в воде карбоновых кислот и их солей. Отношенеие кислот к индикаторам.
1) Несколько капель или кристалликов каждой из кислот смешать с 1-2 мл воды в пробирке. Если кислота не растворяется при обычной температуре, смесь нагреть.
2) По капле полученных растворов органических кислот нанести на полоску индикаторной бумаги, определить pH полученных растворов.
3) Нагретые смеси охладить, отметить, выделяются ли снова кристаллы кислоты.
4) В пробирки, содержащие осадок малорастворимой кислоты, добавить по 2-3 капли гидроксида натрия, встряхнуть, отметит происходящие изменения.










