АНАЛИЗ ОРГАНИЧЕСКИХ
ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
УЧЕБНОЕ ПОСОБИЕ К ЛАБОРАТОРНЫМ ЗАНЯТИЯМ
ПО ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
ДЛЯ СТУДЕНТОВ СПЕЦИАЛИЗАЦИИ «ФАРМАЦИЯ»
ФАКУЛЬТЕТА ВЕТЕРИНАРНОЙ МЕДИЦИНЫ
Издание первое
КРАСНОДАР
Составитель:
к.х.н., доцент Дмитриева И.Г.,
Под общей редакцией д.х.н., профессора,
Доценко С.П.
Предназначены для студентов 4 курса факультета
ветеринарной медицины
Одобрена на заседании кафедры органической
и физколлоидной химии (протокол № 3 от 12.09.09 г.)
Утверждена методической комиссией факультета
ветеринарной медицины (протокол № 3 от 23.10.09 г.)
Рецензенты:
заслуженный ветврач РФ, доктор вет. наук, профессор Шипицин А.Г.;
доктор. хим. наук, Стрелков В.Д. (ВНИИБЗР).
Введение.
Методическое пособие «Анализ органических лекарственных веществ» предназначено для проведения лабораторно-практических занятий у студентов 4 курса факультета ветеринарной медицины.
В учебном пособии приведены методики для усвоения практических навыков по анализу лекарственных средств, с применением физических, химических и физико-химических методов.
Большинство лекарственных средств, используемых в медицинской практике, представляют собой органические вещества. Поэтому особое внимание уделяется способам идентификации органических лекарственных препаратов, а также их количественному определению.
Данное учебное пособие способствует развитию практических навыков и усвоению теоретического материала по анализу органических лекарственных средств.
Для более полного познания химии органических соединений в конце учебного пособия приведён список рекомендуемой литературы.
ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ.
При выполнении практических работ в лаборатории необходимо знать инструкции по технике безопасности и меры оказания первой медицинской помощи при несчастных случаях.
При порезе рук стеклом необходимо, прежде всего, удалить пинцетом кусочки стекла из раны. Затем смазать рану спиртовым раствором йода, прикрыть кусочком марли и ваты, наложить повязку. Если кровотечение сразу не прекращается, то следует приложить кусочек кровоостанавливающей ваты. Её можно приготовить в лаборатории, пропитав вату 10 % раствором хлорида железа или 3 % раствором перекиси водорода. При сильном кровотечении, связанном с ранением более крупных кровеносных сосудов, надо временно перетянуть руку эластичным жгутом из резиновой трубки, отправить больного в травматологический пункт.
При термических ожогах необходимо сразу смочить обожжённое место
5 % раствором танина в 40 % этиловом спирте. Лучше наложить небольшой компресс из ваты или марли, смоченной этим раствором.
При химических ожогах кислотами промывают поражённый участок водой, а затем 1-2 % раствором питьевой соды. Можно наложить компресс из ваты или марли, смоченной раствором соды. При ожогах щелочами промывают поражённый участок водой, а затем 1 % раствором уксусной или лимонной кислот, можно наложить компресс.
Если кислота или щёлочь попали в глаз, то его следует тщательно промыть водой, а затем соответственно 2 % раствором соды или борной кислоты.
При ожогах кожи бромом следует быстро смыть его большим количеством спирта и смазать поражённое место мазью от ожогов.
При ожогах фенолом следует растирать побелевший участок кожи глицерином, пока не восстановится нормальный цвет кожи. Затем промыть поражённый участок водой и наложить компресс из ваты, смоченной глицерином. Если своевременно не принять указанных мер, то могут образоваться долго незаживающие раны.
При ожогах горячими органическими растворителями необходимо промыть обожжённое место, чаще всего этиловым спиртом, затем водой.
В случае отравления хлором, бромом, оксидами азота, следует длительно вдыхать пары нашатырного спирта, затем выйти на свежий воздух и выпить молока.
При сильных ожогах, порезах и отравлениях после оказания первой медицинской помощи пострадавшего следует немедленно отправить в поликлинику.
Перевязочный материал и лекарственные средства всегда должны находиться в аптечке.
Тема 1. ИЗУЧЕНИЕ ФИЗИЧЕСКИХ И ФИЗИКО-ХИМИЧЕСКИХ
МЕТОДОВ ОПРЕДЕЛЕНИЯ ПОДЛИННОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
Установление подлинности лекарственных средств, в том числе физическими и физико-химическими методами, является необходимой составной частью фармацевтического анализа. Определение физических и физико-химических свойств и констант ЛС, позволяет осуществить предварительную идентификацию и оценить доброкачественность ЛС.
1.1. Определение растворимости лекарственных препаратов
Таблица 1
Растворимость некоторых ЛС (в 1мл на 1,0 г препарата).
| Препарат
| Растворители и пределы растворимости
|
| Вода
| Кипящая
вода
| Этанол
| Эфир
| Хлоро-форм
| Раствор
NaOH
| Развед.
НCI
|
| Кислота
ацетилсалициловая
| 100-
| -
| 1-10
| 10-30
| 10-30
| 10-30
| -
|
| Анестезин
| 1000-
| -
| 1-10
| 1-10
| 1-10
| -
| 30-100
|
| Кислота
бензойная
| 100-
| 10-30
| 1-10
| 1-10
| 1-10
| -
| -
|
| Натрия
бензоат
| 1-10
| 30-100
| -
| -
| -
| -
| -
|
Таблица 2
Условные термины растворимости и их сокращённые обозначения
| Условный термин
| Минимальный объём растворителя на 1,0 г препарата, мл
| Максимальный объём растворителя на 1,0 г препарата, мл
|
| Очень легко растворим
Легко растворим
Растворим
Умеренно растворим
Мало растворим
Очень мало растворим
Практически нерастворим
| -
-
|
Более 10000
|
Методика определения растворимости (ГФ изд. XI, вып. 1, с. 175). Отвешенную массу предварительно растёртого в порошок препарата вносят в отмеренный объём растворителя, соответствующий минимальному его объёму. Затем добавляют растворитель до максимального его объёма, при котором в растворе невооружённым глазом не обнаруживаются частицы препарата. Процесс растворения осуществляют в растворителях, имеющих температуру 20 °С. Массу препарата отвешивают на аптечных весах с точностью 0.01 г с таким расчётом, чтобы на установление растворимости расходовалось воды не более 100 мл, а органических растворителей – не более 10-20 мл.
Полученные сведения о растворимости оформляют в виде таблицы № 3.
Таблица 3
| Препарат
| Растворители и пределы растворимости
|
| Вода
| Кипящая
вода
| Этанол
| Эфир
| Хлоро-форм
| Раствор
NaOH
| Развед.
НCI
|
|
|
|
|
|
|
|
|
|
Затем делают заключение о соответствии растворимости исследованных препаратов требованиям соответствующей статьи ГФ.
Таблица 4
| Препарат
| Температура плавления,
°С
| Примечание
|
| Кислота
ацетилсалициловая
| 133-138
| Скорость подъёма температуры 4-6 °С в мин.
|
| Кислота
глютаминовая
| Не ниже 190
| С разложением
|
| Кислота
аскорбиновая
| 190-193
| С разложением, скорость подъёма температуры 5 °С в мин.
|
Методика определения температуры плавления
(ГФ изд. XI, вып. 1, с. 16).
При определении температуры плавления вещество предварительно высушивают в эксикаторе над серной кислотой в течение 24 ч. Капиллярная трубка должна быть с одного конца запаяна. Её заполняют так. Чтобы после уплотнения вещество имело высоту слоя около 3 мм. Уплотняют слой вещества многократным пропусканием в вертикально поставленную стеклянную трубку высотой не менее 50 см. Капилляр закрепляют в приборе так, чтобы запаянный его конец находимся на уровне середины ртутного шарика термометра. Нагревание проводят сначала быстро, а за 10°С до ожидаемого начала плавления медленно. Для каждого лекарственного препарата необходимо провести не менее двух параллельных определений. Расхождение между результатами не должны отличаться более чем на 1 °С.
Результаты определения оформляют в виде таблицы № 5.
Таблица 5
| Препарат
| Температура плавления, °С
| Заключение о соответствии
требованиям ГФ
|
| Определение 1
| Определение 2
| Среднее значение
|
|
|
|
|
|
|
ИК-спектроскопии
Инфракрасный спектр химического соединения является одной из его важных характеристик.
Инфракрасная область спектра занимает диапазон длин волн от видимого света до микроволновой области. Это область от 2,5 до 16 мк. Но для ИК-излучений используют волновые числа, т.е. величины обратные длинам волн, измеренным в сантиметрах. Тогда интервал 2,5-16 мк соответствует интервалу 4000 – 625 см -1.
Известно, что молекулы состоят из атомов, соединённых между собой химическими связями, которые находятся в непрерывном движении. Это движение напоминает непрерывное колебание системы шариков, связанных пружинами. Частоты колебаний зависят от природы связи (простая или кратная), от природы связанных атомов (С-Н, С-О, N-H), и от окружения. Если ударить по системе шариков, амплитуда колебаний возрастёт. Аналогично на молекулы воздействует ИК-излучение. Т.е если на химическое вещество направить ИК-лучи, происходит поглощение квантов с определённой длиной волны и колебания его атомов усиливаются. Луч, проходящий через вещество, ослабевает в области поглощения. При регистрации интенсивности прошедшего излучения получают кривую, на которой видны полосы поглощения. Это и есть ИК-спектр.
Различают два основных типа колебаний: валентные и деформационные.
Валентными колебаниями называют колебания атомов вдоль линии связи, они обозначаются буквой ν (ν С=С, ν С=О и т. д.). Если растянуть или сжать пружину с шариками и отпустить, шары начнут колебаться около положения равновесия - это валентные колебания.
Деформационные колебания связаны с изменением валентного угла, образованного связями у общего атома, они обозначаются буквой δ.
Валентные колебания более интенсивные, чем деформационные и имеют большее значение в идентификации веществ.
С увеличением числа атомов в молекуле число возможных колебаний быстро растёт. В реальной молекуле колебания атомов тесно связаны друг с другом и взаимодействуют между собой. Спектры молекул представляют собой сложный набор различных колебаний, каждое из которых проявляется в узком интервале частот.
Полосы колебания в ИК-спектрах делят на два типа.
Характеристические (в основном валентные), их присутствие в спектре доказывает наличие в исследуемом веществе определённых структурных элементов (функциональных групп, определённых связей). Характеристическими являются колебания, которые существенно отличаются от основных колебаний С-С, это колебания С-Н, О-Н, N-H, колебания кратных связей. Характеристические колебания принадлежат определённой связи, поэтому имеют достаточно определённую частоту в различных веществах, которая изменяется лишь незначительно за счёт взаимодействия с остальной частью молекулы.
Нехарактеристические, занимающие область 1000-400 см -1, где проявляются многочисленные неподдающиеся отнесению валентные колебания связей С-С, С-N. N-O и деформационные колебания. Это область колебаний углеродного скелета молекул. Нехарактеристические колебания составляют основную часть спектра и для каждого вещества образуют свой неповторимый набор полос. Иначе эту часть спектра называют область «отпечатков пальцев». Этим часто пользуются для установления тождественности веществ. Совпадение ИК-спектров в области «отпечатков пальцев» является убедительным доказательством идентичности веществ.
К настоящему времени собрано огромное количество данных, относящихся к характеристическим полосам, они сведены в таблицы, которые используют для интерпретации ИК-спектров.
Наиболее важные характеристические частоты.
Обозначение интенсивности: с. – сильная; ср. – средняя; сл. – слабая, п-переменная.
| Группа
| Частота, см-1
|
| О-Н
| 3650-3200 (п.)
|
| N-H
| 3500-2900 (ср.)
|
| С-Н
| 3300- 2700 (ср.)
|
| S-H
| ~ 2550 (ср. – сл.)
|
| С≡С
| ~ 2200 (сл.)
|
| С≡N
| ~ 2200 (ср. – сл.)
|
| C=O
| 1850-1650 (c.)
|
| С=С
| ~ 1650 (ср. – сл.)
|
| NO2
| ~ 1650 (с.) –асимметричные валентные колебания
~ 1350 (с.) - симметричные валентные колебания
|
| С-О-
| 1350 -1000 (с. – ср.)
|
| С-F
| 1400 -1000 (c.)
|
| C-CI
| 800 -600 (c.)
|
| C-Br
| 650-500 (c.)
|
| C-I
| 600-500 (c.)
|

| 1070-1030 (с.)
|

| 1330 (с.) –асимметричные валентные колебания
1150 (с.) –асимметричные валентные колебания
|
Задание: записать на ИК-спектрофотометре спектр лекарственного препарата, определить полосы поглощения характеристических групп, сделать вывод о соответствии препарата требованиям ГФ.
Информация
Функциональные группы – это группы атомов, которые отличаются высокой реакционной способностью и легко взаимодействуют с различными реактивами с заметным специфическим аналитическим эффектом (изменение цвета, появление запаха, выделение газа или осадка и т.д.).
Возможна идентификация препаратов и по структурным фрагментам.
Структурный фрагмент – это часть молекулы лекарственного вещества, которая взаимодействует с реактивом с заметным аналитическим эффектом (например, анионы органических кислот, кратные связи и т.д.).
Функциональные группы
Функциональные группы можно разделить на несколько типов:
2.2.1. Содержащие кислород:
а) гидроксильная группа (спиртовый и фенольный гидроксил):

б) альдегидная группа:

в) кето-группа:

г) карбоксильная группа:

д) сложноэфирная группа:

е) простая эфирная группировка:

2.2.2. Содержащие азот:
а) первичная ароматическая и алифатическая аминогруппы:

б) вторичная аминогруппа:

в) третичная аминогруппа:

г) амидная группа:
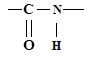
д) нитрогруппа:

2.2.3. Содержащие серу:
а) тиольная группа:

б) сульфамидная группа:

2.2.4. Содержащие галоген:

2.3. Структурные фрагменты:
а) двойная связь:

б) фенильный радикал:

2.4. Анионы органических кислот:
а) Ацетат-ион:

б) тартрат ион:

в) цитрат-ион:

г) бензоат-ион:

В данном методическом пособии приводятся теоретические основы качественного анализа структурных элементов и функциональных групп наиболее часто встречающихся в практике методик анализа лекарственных веществ.
2.5. ИДЕНТИФИКАЦИЯ СПИРТОВОГО ГИДРОКСИЛА
Лекарственные препараты, содержащие спиртовый гидроксил:
а) Спирт этиловый

б) Метилтестостерон

в) Ментол

2.5.1. Реакция образования сложных эфиров
Спирты в присутствии концентрированной серной кислоты образуют с органическими кислотами сложные эфиры. Низкомолекулярные эфиры имеют характерный запах, высокомолекулярные – определённую температуру плавления:


Спирт этилацетат
Этиловый (характерный запах)
Методика: к 2 мл спирта этилового 95% прибавляют 0,5 мл кислоты уксусной, 1 мл кислоты серной концентрированной и нагревают до кипения – ощущается характерный запах этилацетата.
2.5.2. Реакции окисления
Спирты окисляются до альдегидов при добавлении окислителей (дихромата калия, йода).




Суммарное уравнение реакции:
 Иодоформ
Иодоформ
(жёлтый осадок)
Методика: 0,5 мл спирта этилового 95% смешивают с 5 мл раствора натрия гидроксида, прибавляют 2 мл 0,1 М раствора иода – постепенно выпадает жёлтый осадок иодоформа, который имеет также характерный запах.
2.5.3. Реакции образования хелатных соединений (многоатомные спирты)
Многоатомные спирты (глицерин и др.) образуют с раствором сульфата меди а в щелочной среде хелатные соединения синего цвета:

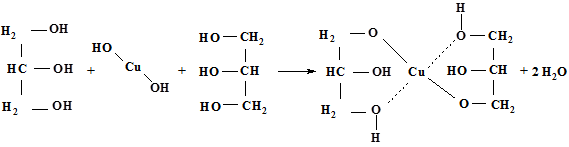
глицерин голубой интенсивно-синяя
осадок окраска раствора
Методика: к 5мл раствора сульфата меди прибавляют 1-2 мл раствора гидроксида натрия до образования осадка гидроксида меди (II). Затем прибавляют раствор глицерина до растворения осадка. Раствор окрашивается в интенсивно-синий цвет.
2.6.ИДЕНТИФИКАЦИЯ ФЕНОЛЬНОГО ГИДРОКСИЛА
Лекарственные препараты, содержащие фенольный гидроксил:
а) Фенол б) Резорцин

в) Синестрол

г) Кислота салициловая д) Парацетамол

2.6.1. Реакция с железа (III) хлоридом
Фенолы в нейтральной среде в водных или спиртовых растворах образуют соли с железа (III) хлоридом, окрашенные в сине-фиолетовый (одноатомные), синий (резорцин), зелёный (пирокатехин) и красный (флороглюцин). Это объясняется образованием катионов С6Н5OFe 2+, С6Н4O2Fe + и др.


Методика: к 1 мл водного или спиртового раствора исследуемого вещества (фенол 0,1:10, резорцин 0,1:10, натрия салицилат 0,01:10) прибавляют от 1 до 5 капель раствора железа (III) хлорида. Наблюдается характерное окрашивание.
2.6.2. Реакции окисления (индофеноловая проба)
а) Реакция с хлорамином
При взаимодействии фенолов с хлорамином и аммиаком образуется индофенол, окрашенный в различные цвета: сине-зелёный (фенол), буровато-жёлтый (резорцин) и др.

Методика: 0,05 г исследуемого вещества (фенол, резорцин) растворяют в 0,5 мл раствора хлорамина, прибавляют 0,5 мл раствора аммиака. Смесь нагревают на кипящей водяной бане. Наблюдается окрашивание.
б) Нитрозореакция Либермана
Окрашенный продукт (красный, зелёный, красно-коричневый) образуют фенолы, у которых в орто - и пара -положениях нет заместителей.

Методика: крупинку вещества (фенол, резорцин, тимол, кислота салициловая) помещают в фарфоровую чашку и смачивают 2-3 каплями 1 % раствора натрия нитрита в кислоте серной концентрированной. Наблюдается окрашивание, изменяющееся при добавлении натрия гидроксида.
| Лекарственное вещество
| Окраска при действии
натрия нитрита
| Окраска после добавления
раствора NaOH
|
| Фенол
| Тёмно-зелёная
| Вишнёво-красная
|
| Резорцин
| Фиолетово-чёрная
| Фиолетовая
|
| Тимол
| Тёмно-зелёная
| Фиолетовая
|
| Кислота салициловая
| Светло-коричневая, переходящая в фиолетовую
| Жёлтая
|
в) Реакции замещения (с бромной водой и азотной кислотой)
Реакции основаны на способности фенолов бромироваться и нитроваться за счёт замещения подвижного атома водорода в орто - и пара -положениях. Бромпроизводные выпадают в виде осадка белого цвета, а нитропроизводные окрашены в жёлтый цвет.

резорцин белый осадок

жёлтое окрашивание
Методика: к 1мл раствора вещества (фенол, резорцин, тимол) прибавляют по каплям бромную воду. Образуется белый осадок. При добавлении 1-2 мл кислоты азотной разведённой постепенно появляется жёлтое окрашивание.
2.7. ИДЕНТИФИКАЦИЯ АЛЬДЕГИДНОЙ ГРУППЫ
Лекарственные вещества, содержащие альдегидную группу
а) формальдегид б) глюкоза

2.7.1. Окислительно-восстановительные реакции
Альдегиды легко окисляются до кислот и их солей (если реакции протекают в щелочной среде). Если в качестве окислителей используются комплексные соли тяжёлых металлов (Ag, Cu, Hg), то в результате реакции выпадает осадок металла (серебра, ртути) или оксида металла (оксид меди (I)).
а) реакция с аммиачным раствором нитрата серебра

Методика: к 2 мл раствора серебра нитрата прибавляют 10-12 капель раствора аммиака и 2-3 капли раствора вещества (формальдегида, глюкозы), нагревают на водяной бане с температурой 50-60 °С. Выделяется металлическое серебро в виде зеркала или серого осадка.
б) реакция с реактивом Фелинга

красный осадок
Методика: к 1 мл раствора альдегида (формальдегида, глюкозы), содержащего 0,01-0,02 г вещества, прибавляют 2 мл реактива Фелинга, нагревают до кипения, Выпадает кирпично-красный осадок оксида меди.
2.8. ИДЕНТИФИКАЦИЯ СЛОЖНОЭФИРНОЙ ГРУППЫ
Лекарственные вещества, содержащие сложноэфирную группу:
а) Кислота ацетилсалициловая б) Новокаин

в) Анестезин г) Кортизона ацетат

2.8.1. Реакции кислотного или щелочного гидролиза
Лекарственные вещества, содержащие в своей структуре сложноэфирную группу, подвергают кислотному или щелочному гидролизу с последующей идентификацией кислот (или солей) и спиртов:
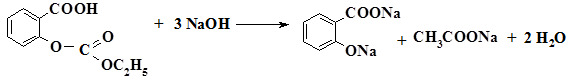
кислота ацетилсалициловая

кислота уксусная

кислота салициловая
(белый осадок)

фиолетовое окрашивание
Методика: к 0,01 г кислоты салициловой приливают 5 мл раствора натрия гидроксида и нагревают до кипения. После охлаждения к раствору добавляют кислоту серную до выпадения осадка. Затем вносят 2-3 капли раствора хлорида железа, появляется фиолетовое окращивание.
2.8.2. Гидроксамовая проба.
Реакция основана на щелочном гидролизе сложного эфира. При гидролизе в щелочной среде в присутствии гидроксиламина гидрохлорида образуются гидроксамовые кислоты, которые с солями железа (III) дают гидроксаматы железа красного или красно-фиолетового цвета. Гидроксаматы меди (II) – осадки зелёного цвета.

гидроксиламин гидрохлорид

гидроксамовая кислота

гидроксамат железа (III)

анестезин гидроксиламин гидроксамовая кислота

гидроксамат железа (III)
Методика: 0,02 г вещества (кислота ацетилсалициловая, новокаин, анестезин и др.) растворяют в 3 мл спирта этилового 95 %, прибавляют 1 мл щелочного раствора гидроксиламина, встряхивают, нагревают на кипящей водяной бане в течение 5 мин. Затем добавляют 2 мл кислоты хлористоводородной разведённой, 0,5 мл 10 % раствора железа (III) хлорида. Появляется красное или красно-фиолетовое окрашивание.
2.9. ОБНАРУЖЕНИЕ ЛАКТОНОВ
Лекарственные вещества, содержащие лактонную группу:
а) Пилокарпина гидрохлорид

Лактонная группа – это внутренний сложный эфир. Лактонную группу можно определить с помощью гидроксамовой пробы.
2.10. ИДЕНТИФИКАЦИЯ КЕТО-ГРУППЫ
Лекарственные вещества, содержащие кето-группу:
а) Камфора б) Кортизона ацетат

Кетоны менее реакционоспособны по сравнению с альдегидами ввиду отсутствия подвижного атома водорода, поэтому окисление проходит в жёстких условиях. Кетоны легко вступают в реакции конденсации с гидрохлоридом гидроксиламина и гидразинами. Образуются оксимы или гидразоны (осадки или окрашенные соединения).

камфора оксим (белый осадок)

фенилгидразин сернокислый фенилгидразон
(жёлтое окрашивание)
Методика: 0,1 г лекарственного вещества (камфора, бромкамфора, тестостерон) растворяют в 3 мл спирта этилового 95 %, прибавляют 1 мл раствора фенилгидразина сернокислого или щелочного раствора гидроксиламина. Наблюдается появление осадка или окрашенного раствора.
2.11. ИДЕНТИФИКАЦИЯ КАРБОКСИЛЬНОЙ ГРУППЫ
Лекарственные вещества, содержащие карбоксильную группу:
а) Кислота бензойная б) Кислота салициловая

в) Кислота никотиновая

Карбоксильная группа легко вступает в реакции благодаря подвижному атому водорода. В основном это два типа реакций:
а) образование сложных эфиров со спиртами (см. раздел 5.1.5);
б) образование комплексных солей ионами тяжёлых металлов
(Fe, Ag, Cu, Co, Hg и др.). При этом образуются:
- серебряные соли белого цвета,
- соли ртути серого цвета,
- соли железа (III) розовато-жёлтого цвета,
- соли меди (II) голубого или синего цвета,
- соли кобальта сиреневого или розового цвета.
Ниже приводится реакция с ацетатом меди (II):

кислота никотиновая осадок синего цвета
Методика: к 5 мл тёплого раствора кислоты никотиновой (1:100) приливают 1 мл раствора ацетата или сульфата меди, выпадает осадок синего цвета.
2.12. ИДЕНТИФИКАЦИЯ ПРОСТОЙ ЭФИРНОЙ ГРУППЫ
Лекарственные вещества, содержащие простую эфирную группу:
а) Димедрол б) Диэтиловый эфир

Простые эфиры обладают способностью образовывать оксониевые соли с кислотой серной концентрированной, которые окрашены в оранжевый цвет.

Методика: На часовое стекло или фарфоровую чашку наносят 3-4 капли кислоты серной концентрированной и прибавляют 0,05 г лекарсвенного вещества (димедрол и др.). Появляется жёлто-оранжевое окрашивание, постепенно переходящее в кирпично-красное. При добавлении воды окраска исчезает.
На диэтиловый эфир реакцию с серной кислотой не выполнят ввиду образования взрывоопасных веществ.
2.13. ИДЕНТИФИКАЦИЯ ПЕРВИЧНОЙ АРОМАТИЧЕСКОЙ
АМИНОГРУППЫ
Лекарственные вещества, содержащие первичную ароматическую аминогруппу:
а)Анестезин

б) Новокаин

Ароматические амины являются слабыми основаниями, так как неподелённая электронная пара азота смещена в сторону бензольного ядра. В результате способность атома азота присоединять протон уменьшается.
2.13.1. Реакция образования азокрасителя
Реакция основана на способности первичной ароматической аминогруппы образовывать в кислой среде соли диазония. При добавлении соли диазония к щелочному раствору β-нафтола появляется красно-оранжевое, красное или малиновое окрашивание (азокраситель). Эту реакцию дают местные анестетики, сульфамиды и др.

соль диазония

азокраситель
Методика: 0,05 г вещества (анестезин, новокаин, стрептоцид и др.) растворяют в 1 мл кислоты хлористоводородной разведённой, охлаждают во льду, прибавляют 2 мл 1 % раствора нитрита натрия. Полученный раствор прибавляют к 1 мл щелочного раствора β-нафтола, содержащего 0,5 г ацетата натрия.
Появляется красно-оранжевое, красное или малиновое окрашивание или оранжевый осадок.
2.13.2. Реакции окисления
Первичные ароматические амины легко окисляются даже кислородом воздуха, образуя окрашенные продукты окисления. В качестве окислителей используются также хлорная известь, хлорамин, перекись водорода, железа (III) хлорид, калия дихромат и т.д.

Методика: 0,05- 0,1 г вещества (анестезин, новокаин, стрептоцид и др.) растворяют в 1 мл натрия гидроксида. К полученному раствору добавляют 6-8 капель хлорамина и 6 капель 1 % раствора фенола. По мере нагревания на кипящей водяной бане повляется окрашивание (синее, сине-зелёное, жёлто-зелёное, жёлтое, жёлто-оранжевое).
2.13.3. Лигниновая проба
Это разновидность реакции конденсации первичной ароматической аминогруппы с альдегидами в кислой среде. Она выполняется на древесине или газетной бумаге.
Ароматические альдегиды, содержащиеая в лигнине (п -окси-безальдегид, сиреневый альдегид, ванилин – в зависимости от вида лигнина) взаимодействуют с первичными ароматическими аминами. Образуя основания Шиффа.
Методика: на лигнин (газетную бумагу) помещают несколько кристаллов вещества, 1-2 капли кислоты хлористоводородной, разведённой. Появляется оранжево-жёлтое окрашивание.
2.14. ИДЕНТИФИКАЦИЯ ПЕРВИЧНОЙ АЛИФАТИЧЕСКОЙ
АМИНОГРУППЫ
Лекарственные вещества, содержащие первичную алифатическую аминогруппу:
а) Кислота глутаминовая б) Кислота γ-аминомасляная

2.14.1. Нингидриновая проба
Первичные алифатические амины окисляются нингидрином при нагревании. Нингидрин –стабильный гидрат 1,2,3-триоксигидриндана:

Обе равновесные формы вступают в реакцию:


основание Шиффа 2-амино-1,3-диоксоиндан

сине-фиолетовое окрашивание
Методика: 0,02 г вещества (кислота глутаминовая, кислота аминокапроновая и другие аминокислоты и первичные алифатические амины) растворяют при нагревании в 1 мл воды, прибавляют 5-6 капель раствора нингидрина и нагревают, появляется фиолетовое окрашивание.
2.15. ИДЕНТИФИКАЦИЯ ВТОРИЧНОЙ АМИНОГРУППЫ
Лекарственные вещества, содержащие вторичную аминогруппу:
а) Дикаин б) Пиперазин

Лекарственные вещества, содержащие вторичную аминогруппу, образуют осадки белого, зеленовато-бурого цветов в результате реакции с нитритом натрия в кислой среде:

нитрозоамин
Методика: 0,02 г лекарственного вещества (дикаин, пиперазин) растворяют в 1 мл воды, прибавляют 1 мл раствора нитрита натрия, смешанного с 3-каплями хлористоводородной кислоты. Выпадает осадок.
2.16. ИДЕНТИФИКАЦИЯ ТРЕТИЧНОЙ АМИНОГРУППЫ
Лекарственные вещества, содержащие третичную аминогруппу:
а) Новокаин
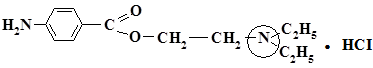
б) Димедрол

Лекарственные вещества, имеющие в своей структуре третичную аминогруппу, обладают основными свойствами, а также проявляют сильные восстановительные свойства. Поэтому они легко окисляются с образованием окрашенных продуктов. Для этого используют следующие реактивы:
а) кислота азотная концентрированная;
б) кислота серная концентрированная;
в) реактив Эрдмана (смесь концентрированных кислот – серной и азотной);
г) реактив Манделина (раствор (NH4)2VO3 в кислоте серной конц.);
д) реактив Фреде (раствор (NH4)2МоO3 в кислоте серной конц.);
е) реактив Марки (раствор формальдегида в кислоте серной конц.).
Методика: На чашку Петри помещают 0,005 г вещества (папаверина гидрохлорид, резерпин и др.) в виде порошка и прибавляют 1-2-капли реактива. Наблюдают появление соответствующего окрашивания.
2.17. ИДЕНТИФИКАЦИЯ АМИДНОЙ ГРУППЫ.
Лекарственные вещества, содержащие амидную и замещённую амидную группу:
а) Никотинамид б) Диэтиламид никотиновой
кислоты

2.17.1. Щелочной гидролиз
Лекарственные вещества, содержащие амидную (никотинамид) и замещённую амидную группу (фтивизид, фталазол, пуриновые алкалоиды, диэтиламид никотиновой кислоты), при нагревании в щелочной среде гидролизуются с образованием аммиака или аминов и солей кислот:

Методика: 0,1 г вещества взбалтывают в воде, прибавляют 0,5 м

































 Иодоформ
Иодоформ