

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Содержание
Введение
1.Процессы переработки метана
2. Принципиальная схема паровоздушной конверсии метана
3.1. Каталитическая конверсия метана
3.2. Процесс паровой каталитической конверсии метана
3.3. Схема химических превращений
3.4. Физико-химические основы процесса конверсии метана
3.5. Термодинамика и кинетика процесса конверсии метана водяным паром
4.1. Катализаторы конверсии метана
4.2. Катализаторы конверсии метана ГИАП-8, ГИАП-25, ГИАП-36Н
4.3. ДКР-1
5. Расчет процесса конверсии
Список использованной литературы
ВВЕДЕНИЕ
В последней четверти XX столетия после разразившегося в начале 70-х годов нефтяного кризиса изменился подход к источникам углеводородного сырья. Человечество осознало, что запасы нефти на Земле небесконечны и невосполняемы. Еще задолго до появления на Земле человека природа создала огромные количества органических веществ, законсервировала их, превратив в наиболее устойчивую форму, и спрятала в недра земли до поры до времени, до разумного использования человеком ее богатств. После энергетического шока 70-х годов взор нефтехимиков обратился в сторону природного газа как альтернативного нефти источника углеводородного сырья. Разведанные запасы природного газа превосходят аналогичные запасы нефти. Кроме того, природный газ можно отнести к возобновляемым источникам энергии и сырья. Значительные количества основных компонентов природного газа - метана и этана - образуются при бактериальном брожении биомассы растительного и животного происхождения, а также в процессах переработки органического сырья.
В настоящее время природный газ используется в основном в энергетических целях: тепловые электростанции на природном газе наиболее экологически чистые, пропанобутановая фракция применяется в качестве бытового топлива, а также как горючее для автотранспорта. В небольших количествах метан используют в металлургической промышленности как восстановитель. Однако степень химической переработки природного газа в ценные продукты остается на низком уровне, а значительная часть попутного нефтяного газа сжигается в факелах, что приводит к невосполнимой потере ценного сырья и порождает сложные экологические проблемы в регионах добычи. Столь расточительное отношение к ископаемым источникам сырья недопустимо и требует незамедлительного создания новых технологий переработки легкого углеводородного сырья.[1]
|
|
В настоящее время конверсия метана является основным промышленным методом получения водорода и технологических газов для синтеза аммиака, спиртов и других продуктов. Известны различные способы конверсии метана.От метода конверсии зависят как технологическая, так и энергетическая схемы производства аммиака в целом. Для выбора оптимального варианта необходимо знать состав конвертированного газа, его энтальпию и эксэргию.
Расчет равновесных составов конвертированного газа на основе известных методик требует использования ЭВМ и соответствующего программного обеспечения. Для упрощения этой задачи целесообразно построить номограммы для определения содержания отдельных компонентов в конвертированном газе, а также номограммы для нахождения его энтальпии и эксэргии. В литературе приведены номограммы только для паровой конверсии метана, однако, имеется возможность построения подобных номограмм и для других способов конверсии. [1]
Конверсия метана, являющегося основным компонентом природного газа, представляет собой наиболее экономичный способ получения азотоводородной смеси. Крупнейшие газовые месторождения имеются на Украине, Северном Кавказе, в Средней Азии, Поволжье, Сибири и других районах страны.
|
|
Природный газ бесцветен, не имеет запаха, значительно легче воздуха, горюч и взрывоопасен. При транспортировке по трубопроводам в природный газ добавляют меркаптаны, обладающие резким запахом, что позволяет легко обнаружить утечку газа, но создает дополнительные трудности при его переработке, так как меркаптаны — серосодержащие соединения, а сера является ядом для всех катализаторов производства аммиака. [2]
Состав природного газа в зависимости от месторождения изменяется следующим образом: метан - 55-99%, этан - 1-10 (пропан + бутан) - до 10, С5-углеводороды и выше - 1-5%, остальное - азот, углекислый газ, сернистые соединения, гелий.
Высокое содержание гелия в природном газе некоторых месторождений (в частности, для Собинского месторождения Красноярского края содержание гелия достигает 0,6%) делает экономически целесообразным его выделение. Поэтому первичная переработка природного газа должна включать следующие этапы:
1. стандартные процессы осушки (для того, чтобы не образовались газогидратные пробки) и выделения кислых газов СО2 и H2S с последующей утилизацией сероводорода, например в процессе Клауса;
2. выделение азота и гелия;
3. получение чистого метана;
4. производство С2-С5-углеводородов или широкой фракции легких углеводородов (ШФЛУ).
Криогенные процессы разделения углекислого газа, азота и гелия разработаны и широко используются. Однако процессы химической переработки метана в ценные продукты в большинстве случаев находятся в исследовательской стадии или существуют в лабораторных вариантах.
1 ПРОЦЕССЫ ПЕРЕРАБОТКИ МЕТАНА[1]
Так ли инертна молекула метана? Многочисленные синтезы на основе метана представляют огромный практический и теоретический интерес, так как позволяют получать ценнейшие органические соединения из природного газа практически без какой-либо предварительной переработки. Уже в настоящее время освоено промышленное производство большого количества важных продуктов из метана, в частности из него получают хлорсодержащие растворители, сероуглерод, синильную кислоту. В условиях пиролиза метана получают ацетилен и этилен. Каталитическая конверсия метана водяным паром является основным методом производства водорода и синтез-газа (смесь СО и Н2 в различных соотношениях). В свою очередь, синтез-газ в процессе Фишера-Тропша может быть превращен в различные кислородсодержащие соединения (метанол, формальдегид, ацетальдегид, уксусную кислоту, этиленгликоль), олефины, индивидуальные углеводороды, моторные топлива и другие продукты. В 1987 году в Новой Зеландии фирмой "Mobil Oil" был пущен в эксплуатацию завод по производству метанола и жидких углеводородов из продуктов паровой конверсии метана. Это свидетельствует о начале процесса переориентации ведущих нефтеперерабатывающих компаний на ненефтяное сырье.
|
|
Новые нетрадиционные методы получения синтез-газа из метана, такие, как электрохимическое окисление или конверсия с углекислым газом в термодиффузионном реакторе, находятся в стадии исследовательской проработки.
Несмотря на многообразие имеющихся теоретических возможностей превращения метана, наибольший интерес исследователей и производителей в последнее время привлекают следующие процессы:
1. получение синтез-газа;
2. прямое каталитическое превращение метана в этилен - окислительная конденсация метана;
3. прямое каталитическое окисление метана в кислородсодержащие продукты - спирты и формальдегид.
В промышленной практике получили распространение следующие методы конверсии метана: каталитическая конверсия и высокотемпературная (некаталитическая) конверсия. По первому методу конверсию можно проводить в одну и две ступени (соответственно одноступенчатая и двухступенчатая каталитическая конверсия). [3]
Разработка процесса прямого каталитического окисления метана в кислородсодержащие продукты началась еще в начале XX столетия. Несмотря на то что этот процесс термодинамически возможен при атмосферном давлении и комнатной температуре, до сих пор не удалось подобрать эффективные катализаторы. Поэтому в настоящее время этот процесс проводят без катализатора при высоких давлениях, однако выходы полезных продуктов невелики. Следовательно, данный процесс не является в настоящее время перспективным для промышленной реализации. Остановимся подробнее на наиболее привлекательном методе превращения метана - окислительной конденсации метана. [1]
|
|
2 Принципиальная схема паровоздушной конверсии метана[4]
Блок-схема отделения паровоздушной конверсии природного газа в технологической нитке производства аммиака приведена на рис.1.
Рис.1. Принципиальная схема отделения конверсии природного газа в агрегате по производству аммиака:1 – аппарат гидрирования сераорганических соединений; 2 – адсорбер сероводорода; 3 – печь первичного реформинга природного газа (трубчатая печь (Т.П.); 4 – реактор вторичного реформинга (шахтный реактор (Ш.Р.); 5, 6 – конвертеры монооксида углерода I и II ступени; 7 – блок очистки от СО2; 8 – метанатор; ТО – теплообменники.
Природный газ вначале проходит через аппараты 1, 2 очистки от сераорганических соединений. В аппарат 1 подается часть производимого в отделении конверсии потока азотоводородной смеси; содержащие серу соединения реагируют с водородом, образуя сероводород, который удаляется из смеси в аппарате 2 при взаимодействии с оксидом цинка, либо адсорбцией на цеолите. Очищенный природный газ смешивается с водяным паром и поступает в реакционные трубы печи первичного реформинга 3 (трубчатой печи), заполненные никелевым катализатором. Здесь происходит превращение большей части СН4 и сопутствующих углеводородов в смесь Н2, СО и СО2. Итоговые уравнения основных реакций, протекающих в трубчатой печи можно записать в виде:
СН4 + Н2О  3 Н2 + СО (1)
3 Н2 + СО (1)
СО + Н2О  Н2 + СО2 (2)
Н2 + СО2 (2)
Суммарный процесс: СН4 + 2Н2О  4 Н2 + СО2 (3)
4 Н2 + СО2 (3)
Реакция (1) идет с поглощением теплоты, реакция (2) – с ее выделением. Суммарный тепловой эффект процесса определяется эндотермической реакцией (1), необходимая теплота подводится к реакционным трубам от сжигаемого в межтрубном пространстве природного газа.
Вслед за первичной конверсией природного газа проводится паровоздушная конверсия остаточного количества углеводородов (вторичный реформинг) в шахтном реакторе 4. Данный аппарат выполняет в рассматриваемой схеме две важные функции: увеличение степени конверсии метана за счет значительного повышения температуры по сравнению с температурой, достигаемой в тепловой печи, и приготовление смеси газов с необходимым содержанием азота для последующего синтеза аммиака. В шахтном реакторе, загруженном никелевым катализатором, последовательно протекают реакции окисления горючей смеси газов кислородом воздуха, подаваемого на входе шахтного реактора, и реакции (1), (2). Среди реакций окисления превалирует реакция
2 Н2 + О2  2 Н2О, (3)
2 Н2О, (3)
протекающая до полного исчерпывания кислорода. Реакция (3) преобладает среди других реакций окисления, так как в газовой смеси, поступающей в шахтный реактор, количество водорода значительно превышает количество других горючих газов.
|
|
Обе функции шахтного реактора обеспечиваются за счет парадоксального на первый взгляд решения – сжигания части полученного на предыдущей стадии продукта в объеме реактора. В результате происходит адиабатный разогрев смеси, температура резко возрастает, вследствие чего и повышается степень конверсии метана. Весь кислород, содержащийся в подаваемом в шахтном реакторе воздухе, расходуется, и в смеси с продуктами конверсии остаются только другие компоненты воздуха – азот и аргон. Поэтому для приготовления азотоводородной смеси в данной схеме отпадает необходимость в выделении азота из воздуха путем его сжижения и низкотемпературной ректификации.
Выходящая из шахтного реактора смесь после ступенчатого промежуточного охлаждения последовательно проходит реакторы 5 и 6, в которых происходит практически полная конверсия метана с образованием водорода на селективных катализаторах (I ступень конверсии в реакторе 5 – на среднетемпературном железо-хромовом катализаторе и II ступень в реакторе 6 – на низкотемпературном цинк-хром-медном катализаторе), обеспечивающих избирательное протекание реакции (2) при заторможенной реакции (1). Далее полученная азотоводородная смесь освобождается от углекислого газа абсорбцией раствором моноэтаноламина или бикарбоната калия в технологическом блоке 7. Оставшиеся в смеси незначительные примеси оксидов углерода, являющихся ядами для катализатора синтеза аммиака, нейтрализуют во вспомогательном каталитическом реакторе – метанаторе 8, в котором реакции (1) и (2) протекают справа налево, превращая оксиды углерода в метан, инертный по отношению к катализатору синтеза аммиака. Из метанатора очищенная азотоводородная смесь идет в отделение синтеза аммиака, небольшая часть смеси поступает в головной аппарат 1 схемы.
3.1 Каталитическая конверсия метана[3]
Каталитическая конверсия метана может быть осуществлена либо в смеси метана с водяным паром, либо в смеси метана с водяным паром и кислородом.
В связи с тем, что реакция конверсии метана с водяным паром сильно эндотермична, для ее осуществления требуется подвод тепла. В промышленности этот процесс проводится в трубчатых печах. В трубы пожаропрочной стали загружается никелевый катализатор, снаружи трубы обогреваются топочными газами. Такой метод конверсии нашел применение в тех случаях, когда требуется получить технический водород с минимальным содержанием азота. Процесс ведется при температуре 800 — 850°С на выходе из слоя катализатора. К 1 м3 природного газа добавляют обычно 2—2,5 м3 водяного пара. Остаточное содержание, метана в конвертированном газе составляет 1 — 2%.
Преимущество этого метода заключается в том, что для обогрева труб могут быть использованы любые горючие газы, в том числе отходы производства. Недостатком этого метода являются большие капитальные затраты на сооружение установок и необходимость использования высококачественных легированных сталей.
Если требуется получить смесь водорода с азотом, например для синтеза аммиака, метан конвертируют смесью водяного пара и воздуха, обогащенного кислородом. Часть метана сжигают в реакционной зоне, в результате выделяется тепло, необходимое для протекания эндотермической реакции (3) взаимодействия метана с водяным паром. Процесс ведется в конверторами шахтного типа при температуре 800 — 900°С. Остаточное содержание метана в конвертированном газе составляет не более 0,5%. В настоящее время азотоводородную смесь получают в промышленности одноступенчатой или двухступенчатой конверсией метана.
Одноступенчатая конверсия метана. В зависимости от схемы производства аммиака конверсия природного газа проводится при действии на него водяногопара и кислорода или воздуха, обогащенного кислородом. Конверсия природного газа в присутствии водяного пара и кислорода применяется в тех случаях, когда конвертированный газ используется либо в синтезе метанола и высших спиртов, либо в производстве аммиака, в технологической схеме которого предусмотрено определение промывки газа жидким азотом.
Для получения аммиака в производствах, имеющих станцию медно-аммиачной очистки газа от окиси углерода, применяется конверсия метана с водяным паром и воздухом, обогащенным кислородом. Процесс конверсии метана осуществляется в аппаратных шахтного типа на никелевом катализаторе при температуре 850°С. Технологическая схема одноступенчатой конверсии природного газа подробно описана в последующих главах памятки. Конверсия метана может происходить не только в присутствии водяного пара и кислорода, но и двуокиси углерода по реакции (4). В этом случае конвертированный газ имеет повышенное содержание окиси углерода, что весьма целесообразно при синтезе метанола и высших спиртов. Путем изменения соотношения водяного пара и двуокиси углерода в исходной газовой смеси можно изменить соотношение водорода и окиси углерода в конвертированном газе до 3.
Двухступенчатая конверсия метана. В тех случаях, когда имеются дешевые источники тепла для обогрева реактора, азотоводородную смесь для синтеза аммиака получают методом двухступенчатой конверсии природного газа. Технологическая схема процесса представлена на рис. 3.
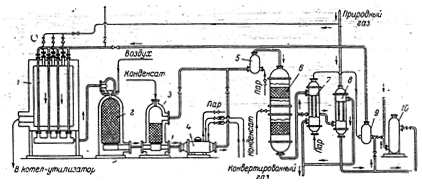
Рис 3. Технологическая схема двухступенчатой конверсии метана:
1 – трубчатая печь; 2 – конвертор метана второй ступени; 3 – увлажнитель; 4 – котел-утилизатор; 5, 9 – парогазосмесители; 6 – двухступенчатый конвертор окиси углерода; 7 – пароперегреватель; 8 - теплообменник; 10 – аппарат для очистки от соединений серы.
Природный газ под избыточным давлением 0,7 — 0,8 ат поступает в теплообменник 8, в котором подогревается до температуры 380°С за счет тепла газов, исходящих после конверсии окиси углерода. Из теплообменника природный газ подается в аппарат 10, заполненный поглотителем на основе окиси цинка, для связывания соединений серы. Очищенный газ смешивается в аппарате 9 с водяным паром, нагретым до 380°С в пароперегревателе 7 за счет тепла газа после конверсии СО. Парогазовая смесь (отношение пар: газ =5: 1) с температурой 380°С поступает в трубчатую печь 1, снабженную подвешенными трубами, изготовленными из специальной жаропрочной стали. В трубах размещается никелевый катализатор общим объемом 7,5 м3. Снаружи трубы обогреваются топочными газами, образующимися при сжигании какого-либо газа. Парогазовая смесь проходит через катализатор сверху вниз, при этом температура постепенно возрастает с 400 до 800°С. Степень превращения метана в первой ступени достигает 70%. Конвертированный газ после первой ступени поступает в конвертор шахтного типа 2, куда добавляется воздух. Остаточный метан почти полностью реагирует на никелевом катализаторе при температуре 850 — 900°С. Конвертированный газ после второй ступени содержит до 0,5% метана. Газ из конвертора метана поступает в увлажнитель 3, затем в котел-утилизатор 4 и далее (при 400°С) в конвертор 6.
В последнее время находят применение усовершенствованные трубчатые печи с двойными трубами. Катализатор помешается в кольцевом сечении, образованном внутренней и наружной трубами. Греющие газы подаются с внешней стороны наружной трубы. Природный газ вместе с паром проходит через катализатор сверху вниз, а полученный конвертированный газ — по внутренней трубе снизу вверх. Такая конструкция аппарата позволяет улучшить условия теплопередачи и увеличить температуру в слоях катализатора, не повышая температуру стенок труб.
ДКР-1
ДРК – 1 новый вид катализатора, предназначен для паровой и пароуглекислотной конверсии газообразных углеводородов в трубчатых печах крупнотоннажных агрегатов по производству аммиака, метанола, установок получения технического водорода. Катализатор представляет собой промотированный оксид никеля, нанесенный на высокоглиноземистый носитель в виде циллиндрических колец, имеет более высокую активность и стабильность.
Условия эксплуатации
Расчет процесса конверсии
Рассчитать процесс конверсии метана водяным паром по следующим данным:
| Производительность по метану | 1000 м3/час |
| Состав газа | метан – 98% |
| азот – 2% | |
| Степень конверсии | 70% |
| Температура | на входе 105°С |
| на выходе 900°С |
СН  + Н
+ Н  О
О  СО + 3Н
СО + 3Н 

1. Расчет термодинамических параметров.
СН 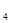
| Н  О О
| СО | Н2 | |
 Н Н  
| -74,85 | -241,81 | -110,53 | 0 |
D S  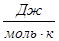
| 186,27 | 188,72 | 197,55 | 130,52 |
D G  
| -50,85 | -228,61 | -137,15 | 0 |
1.1. По закону Гесса находим тепловой эффект химической реакции при нормальных условиях:
D Н  =(S ni D Н
=(S ni D Н  )
)  - (S ni D Н
- (S ni D Н  )
) 
DН  = 0×3 - 110,53 + 241,81 + 74,85 = 206,13 кДж / моль
= 0×3 - 110,53 + 241,81 + 74,85 = 206,13 кДж / моль
1.2. Найдем энтропию реакции:
D S  = (S ni D S
= (S ni D S  )
)  - (S ni D S
- (S ni D S  )
) 
DS  =3×130,52 +197,55 -188,72 -186,27= 214,12 Дж / моль × К
=3×130,52 +197,55 -188,72 -186,27= 214,12 Дж / моль × К
1.3. Найдем изменение энергии Гиббса в ходе реакции при нормальных условиях:
D G  = (S ni D G
= (S ni D G  )
)  -(S ni D G
-(S ni D G  )
) 
DG  = 3×0-137,15+288,61+50,85=142,31 кДж / моль
= 3×0-137,15+288,61+50,85=142,31 кДж / моль
2. Найдем функцию зависимости теплоемкости от температуры С  = f(Т)
= f(Т)
СН 
| Н  О О
| СО | Н 
| |
| a | 14,32 | 30 | 28,41 | 27,28 |
| b | 74,66×10 
| 10,71×10 
| 4,1×10 
| 3,26×10 
|
| с’ | 0,33×10 
| -0,46×10 
| 0,5×10 
| |
| с | -17,43×10 
|
Ср(СН4) = 14,32 + 74,66×10  Т - 17,43×10
Т - 17,43×10  Т
Т 
Ср(Н2О) = 30 + 10,71×10-3Т + 0,33×105Т-2
Ср(СО) = 28,41+ 4,1×10-3×Т - 0,46×105Т-2
Ср(Н2) = 27,28 + 3,26×10-3Т + 0,5×105Т-2
D Ср = D а + D bT + D с’Т2+ D c Т-2
DСр = (3×27,28+28,41-30-14,32) + (3×3,26+4,1-10,71-74,66)×10-3Т +
+ (3×0,5-0,46-0,33)×105Т-2 - 17,43×10-6Т2
DСр = 65,93 - 71,49×10-3Т + 0,71×105Т-2 - 17,43×10-6Т2 Дж / моль × К
2.1. Для азота зависимость теплоемкости от температуры выглядит следующим образом:
Ср(N2) = 27,88 + 4,27×10-3Т
3.1. Найдем изменение энтропии в ходе реакции при нагревании от t 1 =25  C до t 2 =900
C до t 2 =900  C:
C:
DS= 
 dТ =
dТ =


D S =16.54 Дж/моль × К
3.2. Найдем изменение энтальпии в ходе реакции при нагревании от t 1 =25 ° C до t 2 =900 ° C:

DH= 65,93 (1173-298) -  ×71,49×10-3(11732-2982) -
×71,49×10-3(11732-2982) -  -
- 
D Н= - 2375 Дж/моль
3.3. Рассчитаем энергию Гиббса на выходе t 2 =900 ° С:


4. Найдем константу равновесия:
D G ° =- RTlnKp
Kp = exp (- D G ° / RT)
Kp = exp (-(-62058,71/8,31 × 1173))=582,04
4.1. Рассчитаем равновесную степень превращения метана. При температуре от 827°С и составе исходной смеси СН4 : Н2О = 1: 2 необходимо проводить процесс при абсолютном давлении 10 атм.
СН4 + Н2О ® СО + 3Н2
т.к. водяной пар в избытке, то РН2О = 2РСН4
Робщ = РСН4 + 2РСН4= 3РСН4
РСН4 = Робщ/3 = 10/3 атм.
При равновесии:






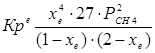



xe = 0,8115 и xe = - 2,29
Равновесная степень превращения равна 0,8115.
Вывод: равновесная степень превращения метана xe=0,8115,степень конверсии a = 0,7, данный процесс, возможно, провести в указанных условиях.
5. Составим материальный баланс.
| Приход | Расход | ||||
| Исходное вещество | m, кг | V,м3 | Продукт | m, кг | V,м3 |
| СН4 | 714,29 | 1000 | СН4 | 214,29 | 300 |
| N2 | 25,51 | 20,41 | N2 | 25,51 | 20,41 |
| Н2О | 1607,14 | 2000 | Н2О | 1044,64 | 1300 |
| СО | 875 | 700 | |||
| Н2 | 187,5 | 2100 | |||
| Итого: | 2346,94 | 3020,41 | Итого: | 2346,94 | 4420,41 |
5.1.Найдем количество поступающего метана (в час):
по закону эквивалентов

 (кг)
(кг)
Найдем количество конвертируемого метана:
V=0, 7×1000=700 (м3)

После реакции осталось:
m(СН4) = 714,29 – 500 = 214,29 (кг)
V(СН4)= 1000 – 700 = 300 (м3)
5.2. Найдем необходимое количество воды для осуществления реакции:

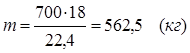
В промышленном производстве для осуществления процесса воду и метан берут в отношении 2:1. Исходя из этого условия рассчитаем количество поступающего водяного пара:
V = 2 × 1000 = 2000 (м3)

Не прореагировало водяного пара:
m(Н2О) = 1607,14 – 500 = 214,29 (кг)
V(Н2О) = 2000 – 700 = 300 (м3)
5.3. В реактор поступает  :
:
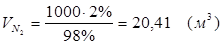
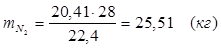
Т.к. азот не участвует в химической реакции, то на выходе:
m = 25,51 (кг)
V = 20,41 (м3)
5.4. Найдем количество образовавшегося в ходе реакции СО:


5.5. Найдем количество образовавшегося водорода:


Вывод:  . Материальный баланс сошелся.
. Материальный баланс сошелся.
6. Составим энергетический баланс:
| Приход | кДж | % | Расход | кДж | % |
| Q(СН4) | 675,87 | 4 | Q(СН4) | 1224,04 | 7,2 |
| Q(N2) | 10,16 | 0,06 | Q(N2) | 35,15 | 0,2 |
| Q(Н2О) | 1156,9 | 6,87 | Q(Н2О) | 4460,2 | 26,4 |
| Qподв | 15029,6 | 89,07 | Q(СО) | 1216,5 | 7,23 |
| Q(Н2) | 3420,87 | 20,24 | |||
| Qх.р. | 6515,8 | 38,62 | |||
| Итого: | 16872,53 | 100% | Итого: | 16872,56 | 100% |
6.1. Найдем тепло, которое поступает с исходными веществами – физическое тепло:

где T 1 – температура на входе, (t 1 =105  C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2).
C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2).
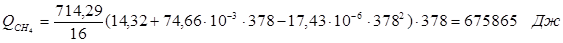


Реакция конверсии водяным паром сильно эндотермична, поэтому необходимо подогревать исходную реакционную смесь. В промышленности для подогрева системы используют природный газ, за счет сжигания которого выделяется необходимое количество тепла Q.
6.2. Найдем тепло веществ на выходе из реактора:

где T 2 – температура на выходе из реактора.
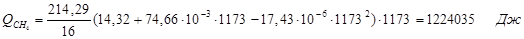




6.3. Найдем теплоту, поглощенную в ходе химической реакции:


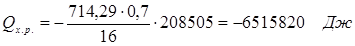
6.4. Найдем количество теплоты, которое необходимо затратить на подогрев исходной смеси:

6.5. Найдем количество природного газа, которое необходимо затратить для подогрева исходной смеси, считая, что природный газ на 95% состоит из метана (состав природного газа зависит от месторождения, колеблется от 55-99%):
По справочнику:
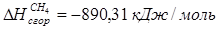

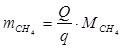


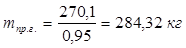
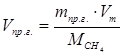

СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. А. Г. Аншиц, Е. Н. Воскресенская. Окислительная конденсация метана – новый процесс переработки природного газа.
2. Сосна М.Х., Энтин Б.М., Лейтес И.Л. Нонограммы для определения состава газа конверсии метана//Химическая промышленность. – 1989. - №7. - с.59
3. Крейндель Э.М. Конверсия метана природного газа. Л.:-1964.
4. Г.С. Яблонский. Кинетические модели гетерогенно-каталитических реакций. Элементы теории кинетики сложных химических реакций. Глава 1. В сб.: Химическая и биологическая кинетика / Под ред. Н.М. Эмануэля, И.В. Березина, С.Д. Варфоломеева. М.: Изд-во Моск. ун-та, 1983.
5. Водород. Свойства, получение, хранение, транспортирование, применение: Справ. изд./Д.Ю. Гамбург, В.П. Семенов,, Л.Н. Смирнова; Под ред. Д.Ю. Гамбурга, Н.Ф. Дубовкина. – М.: Химия, 1989.
Содержание
Введение
1.Процессы переработки метана
2. Принципиальная схема паровоздушной конверсии метана
3.1. Каталитическая конверсия метана
3.2. Процесс паровой каталитической конверсии метана
3.3. Схема химических превращений
3.4. Физико-химические основы процесса конверсии метана
3.5. Термодинамика и кинетика процесса конверсии метана водяным паром
4.1. Катализаторы конверсии метана
4.2. Катализаторы конверсии метана ГИАП-8, ГИАП-25, ГИАП-36Н
4.3. ДКР-1
5. Расчет процесса конверсии
Список использованной литературы
ВВЕДЕНИЕ
В последней четверти XX столетия после разразившегося в начале 70-х годов нефтяного кризиса изменился подход к источникам углеводородного сырья. Человечество осознало, что запасы нефти на Земле небесконечны и невосполняемы. Еще задолго до появления на Земле человека природа создала огромные количества органических веществ, законсервировала их, превратив в наиболее устойчивую форму, и спрятала в недра земли до поры до времени, до разумного использования человеком ее богатств. После энергетического шока 70-х годов взор нефтехимиков обратился в сторону природного газа как альтернативного нефти источника углеводородного сырья. Разведанные запасы природного газа превосходят аналогичные запасы нефти. Кроме того, природный газ можно отнести к возобновляемым источникам энергии и сырья. Значительные количества основных компонентов природного газа - метана и этана - образуются при бактериальном брожении биомассы растительного и животного происхождения, а также в процессах переработки органического сырья.
В настоящее время природный газ используется в основном в энергетических целях: тепловые электростанции на природном газе наиболее экологически чистые, пропанобутановая фракция применяется в качестве бытового топлива, а также как горючее для автотранспорта. В небольших количествах метан используют в металлургической промышленности как восстановитель. Однако степень химической переработки природного газа в ценные продукты остается на низком уровне, а значительная часть попутного нефтяного газа сжигается в факелах, что приводит к невосполнимой потере ценного сырья и порождает сложные экологические проблемы в регионах добычи. Столь расточительное отношение к ископаемым источникам сырья недопустимо и требует незамедлительного создания новых технологий переработки легкого углеводородного сырья.[1]
В настоящее время конверсия метана является основным промышленным методом получения водорода и технологических газов для синтеза аммиака, спиртов и других продуктов. Известны различные способы конверсии метана.От метода конверсии зависят как технологическая, так и энергетическая схемы производства аммиака в целом. Для выбора оптимального варианта необходимо знать состав конвертированного газа, его энтальпию и эксэргию.
Расчет равновесных составов конвертированного газа на основе известных методик требует использования ЭВМ и соответствующего программного обеспечения. Для упрощения этой задачи целесообразно п
|
|
|

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!