

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
Определение ионов алюминия и меди (II) в сточной воде
Курсовая работа по аналитической химии
Студентка 2 курса
Н.А. Сталоверова
Оценка “______”
Руководитель, доцент, к. х. н.
О.Н. Кононова
Оценка защиты “______”
Итоговая оценка “______”
Зав. кафедрой аналитической химии
С.В. Качин
Красноярск 2008
СОДЕРЖАНИЕ
Введение
1 Литературная часть
1.1 Физико-химическая характеристика алюминия
1.2 Физико-химическая характеристика меди
1.3 Аналитическое определение ионов алюминия(III) и меди(II)
2 Экспериментальная часть
2.1 Выбор объектов исследования
2.2 Приборы и реактивы
2.3 Методики, используемые в работе
2.3.1 Определение меди(II) йодометрическим методом
2.3.2 Определение алюминия(III) комплексонометрическим методом
2.4 Обсуждение результатов
Выводы
Список литературы
ВВЕДЕНИЕ
Вода-источник жизни, ничто живое на земле не может обойтись без нее, поэтому ее анализ имеет важное значение. В сточных водах содержится большее количество разнообразных органических, неорганических, органоминеральных веществ природного и техногенного происхождения. Вода может содержать эти вещества как в истинно растворенном состоянии, так и в коллоидном в виде суспензий и эмульсий. Качество воды предварительно оценивается по обобщенным показателям: цвет, прозрачность, пенистость, запах, кислотность и щелочность. Затем следует более глубокий анализ на содержание и токсичность присутствующих в воде веществ.
Данная работа посвящена определению содержания алюминия(III) и меди(II) в сточной воде.
Глава 1 ЛИТЕРАТУРНАЯ ЧАСТЬ
|
|
Глава 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выбор объектов исследования
В настоящее время человек оказывает большое влияние на природу. Из-за этого окружающая среда подвергается большему загрязнению, возрастает необходимость исследования водных ресурсов на пригодность к употреблению. Именно поэтому, нами выбрана в качестве объекта исследования сточная вода для определения в ней общего содержания алюминия(III) и меди (II), так как соединения этих элементов, попадая в природные водоемы, нарушают общий состав воды, и влияют на экосистему водоемов в целом.
Оборудование и реактивы, используемые в работе
Штатив с лапкой;
Конические колбы для титрования – 3 шт;
Мерная колба вместимостью 100мл;
Градуированная пипетка вместимостью 10мл;
Химические стаканы на 100 мл – 2 шт;
Фильтровальная бумага;
Тиосульфат натрия( ), 0,03N раствор;
), 0,03N раствор;
Иодид калия(KI), 20%-ый раствор;
Серная кислота(H2SO4), 2N раствор;
Крахмал( )
)  раствор;
раствор;
Комплексон III, 0,1N раствор;
Сульфат меди( ·5 H2O), 0,02М раствор;
·5 H2O), 0,02М раствор;
Индикатор ПАН раствор;
Ацетат аммония(CH3COONH4) раствор.
Методики, используемые в работе
Обсуждение результатов
В данной работе нами было определено общее содержание алюминия и меди.
В мерную колбу вместимостью 250,0 мл помещали 25,0 мл сточной воды, доводили до метки дистиллированной водой и перемешивали. Проба имела бесцветную окраску, не имела запаха, значение рН равнялось 1.
При титровании меди по сходящимся отсчетам по бюретке находим объемы V1 = 1,2 мл, V2 = 1,3 мл, V3 = 1,2 мл. По формуле определяем концентрацию N,моль/л:
N1 = (0,03 · 1,2) / 10 = 0,0036 моль·экв/л, (5)
N2 = (0,03 · 1,3) / 10 = 0,0039 моль·экв/л, (6)
N3 = (0,03 · 1,2) / 10 = 0,0036 моль·экв/л. (7)
Найдем среднюю концентрацию Nср = (0,0036 + 0,0039 + 0,0036) / 3 = 0,0037 моль·экв/л. Проверяем концентрацию по 3Sn –критерию:
 , (8)
, (8)
 (9)
(9)
3S3 = 1,7· 10-4 · 3 = 5,1 · 10-4. (10)
|
|
Рассчитаем доверительный интервал, при t=4,303, n=3:
 . (11)
. (11)
Из этого следует, что в нашей работе нет промахов и Nср = (0,0037±0,0004) моль·экв/л. Рассчитаем концентрацию меди в исследуемом растворе, в мг/л:
 мг/л. (12)
мг/л. (12)
При титровании алюминия по сходящимся отсчетам по бюретке находим объемы V1 = 23,1 мл, V2 = 23,0 мл, V3 = 22,9 мл.
По формуле определяем объем затраченного на титрование раствора ЭДТА:
 =(0,02·23,1)/0,1=4,62 мл, (13)
=(0,02·23,1)/0,1=4,62 мл, (13)
 =(0,02·23,0)/0,1=4,60 мл, (14)
=(0,02·23,0)/0,1=4,60 мл, (14)
 =(0,02·22,9)/0,1=4,58 мл. (15)
=(0,02·22,9)/0,1=4,58 мл. (15)
Рассчитает объем титранта, который пошел на титрование раствора:
 , (16)
, (16)
 мл, (17)
мл, (17)
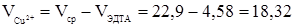 мл. (18)
мл. (18)
Затем рассчитываем концентрация алюминия в растворе:
 =(0,02·18,48)/20=0,01848 моль·экв/л, (19)
=(0,02·18,48)/20=0,01848 моль·экв/л, (19)
 =(0,02·18,40)/20=0,01840 моль·экв/л, (20)
=(0,02·18,40)/20=0,01840 моль·экв/л, (20)
 =(0,02·18,32)/20=0,01832 моль·экв/л. (21)
=(0,02·18,32)/20=0,01832 моль·экв/л. (21)
Найдем среднюю концентрацию Nср = (0,01848 + 0,01840 + 0,01832) / 3 = 0,01840 моль·экв/л.
Проверяем концентрацию по 3Sn –критерию, по формуле (8):
 , (22)
, (22)
3S3 = 0,7· 10-4 · 3 = 2,1 · 10-4. (23)
Рассчитаем доверительный интервал:
 . (24)
. (24)
Из этого следует, что в нашей работе нет промахов и Nср = (0,01840±0,00017) моль·экв/л.
Рассчитываем концентрацию алюминия в исследуемом растворе:
 мг/л. (25)
мг/л. (25)
В ходе эксперимента нами были установлены содержания меди и алюминия в сточной воде, они составляют N = (118,4±0,0004) мг/л и N = (496,8±0,00017) мг/л соответственно. Норма ПДК для меди составляет 0,3 мг/л, для алюминия 0,2 мг/л. Можно сделать вывод, что концентрации меди и алюминия превышает предельно допустимую концентрацию, и эта вода должна подвергнуться дополнительной очистке.
ВЫВОДЫ
1. Полученный раствор сточной воды содержал ионы алюминия и меди(II).
2. Йодометрическим методом определили содержание меди (II) в сточной воде N = (118,4±0,0004) мг/л.
3. Комплексонометрическим методом определили содержание алюминия в сточной воде N = (496,8±0,00017) мг/л.
4. Полученные концентрации были сравнены с ПДК, они значительно превышают предельно допустимые концентрации данных ионов в сточной воде.
СПИСОК ЛИТЕРАТУРЫ
1. Ахметов, Н.С. Общая и неорганическая химия / Н.П.Ахметов. – М.: Высшая школа, 2001. – С488-502.
2. Реми, Г. Курс неорганической химии Т.1 / Г.Реми. – М.: Мир, 1966. –С381-386.
3. Некрасов, Б. В. Основы общей химии Т.2/ Б. В. Некрасов. – М.: Химия, 1973. – С32-34.
|
|
4. Реми, Г. Курс неорганической химии Т.2 / Г.Реми. – М.: Мир, 1966. –С394-410.
5. Угай, Н. П. Общая и неорганическая химия / Н.П.Угай. - М.: Высшая школа, 2000. – С. 310-315.
6. Шварценбах, Г. Комплексонометрическое титрование / Г. Шварценбах, Г. Флашка. – М.: Химия, 1970 – С183-192, 251-257.
7. Васильев, В. П. Аналитическая химия. Лабораторный практикум / В.П.Васильев, Р.П.Морозова, Л.А. Кочергина. – М.: Дрофа, 2004.-С329-331.
8. Лурье, Ю.Ю. Аналитическая химия промышленных сточных вод/Ю. Ю.Лурье. – М.: Химия, 1984. – 447 с.
9. Лурье, Ю.Ю. Химический анализ производственных сточных вод/Ю.Ю.Лурье, А.И.Рыбникова. – М.: Химия, 1974. – 335 с.
10. Голосницкая, В.А. Анализ природных и сточных вод/В.А.Голосницкая. – Новочеркасск: Химия, 1979. – 84 с.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
Определение ионов алюминия и меди (II) в сточной воде
Курсовая работа по аналитической химии
Студентка 2 курса
Н.А. Сталоверова
Оценка “______”
Руководитель, доцент, к. х. н.
О.Н. Кононова
Оценка защиты “______”
Итоговая оценка “______”
Зав. кафедрой аналитической химии
С.В. Качин
Красноярск 2008
СОДЕРЖАНИЕ
Введение
1 Литературная часть
1.1 Физико-химическая характеристика алюминия
1.2 Физико-химическая характеристика меди
1.3 Аналитическое определение ионов алюминия(III) и меди(II)
2 Экспериментальная часть
2.1 Выбор объектов исследования
2.2 Приборы и реактивы
2.3 Методики, используемые в работе
2.3.1 Определение меди(II) йодометрическим методом
2.3.2 Определение алюминия(III) комплексонометрическим методом
2.4 Обсуждение результатов
Выводы
Список литературы
ВВЕДЕНИЕ
Вода-источник жизни, ничто живое на земле не может обойтись без нее, поэтому ее анализ имеет важное значение. В сточных водах содержится большее количество разнообразных органических, неорганических, органоминеральных веществ природного и техногенного происхождения. Вода может содержать эти вещества как в истинно растворенном состоянии, так и в коллоидном в виде суспензий и эмульсий. Качество воды предварительно оценивается по обобщенным показателям: цвет, прозрачность, пенистость, запах, кислотность и щелочность. Затем следует более глубокий анализ на содержание и токсичность присутствующих в воде веществ.
|
|
Данная работа посвящена определению содержания алюминия(III) и меди(II) в сточной воде.
Глава 1 ЛИТЕРАТУРНАЯ ЧАСТЬ
Физико-химическая характеристика алюминия
Алюминий - самый распространенный в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8%(масс). Основным сырьем для производства алюминия служат бокситы, содержащие 32-60% глинозема[1].
В настоящее время промышленные способы получения алюминия основаны на электролитическом разложении оксида алюминия, растворенного в расплавленном криолите. В качестве материала для электродов обычно используют ретортный графит[2].
Алюминий Al13 расположен в третьей группе периодической системы и имеет электронное строение 1s2 2s2 2p6 3s2 3p1 ; наиболее характерна степень окисления +3 и координационные числа 4 и 6. Металлический атомный радиус 0,143 нм, ковалентный – 0,126 нм, условный радиус иона Al 3+ - 0,057 нм. Энергия ионизации Al – Al + 5,99 Эв[1].
Алюминий – типичный амфотерный элемент, для него характерны анионные и катионные комплексы. Так, в кислой среде существует катионный аквакомплекс [Al(OH2 )6 ]3+ , а в щелочной – анионный гидрокомплекс и [Al(OH)6 ]3- [1].
Алюминий представляет собой серебристо-белый довольно твердый металл, с плотностью 2,7 г/см3, плавящийся про 660 и кипящий при 25200 С. Он характеризуется большой тягучестью, легко вытягивается в проволоку и прокатывается в тонкие листы, и высокой электропроводностью, составляющей примерно 0,6 электропроводности меди. Стандартный электродный потенциал алюминия равен - 1,663B. При нормальных условиях алюминий – серебристо–белый легкий металл. На воздухе алюминий покрывается тончайшей, но очень плотной, оксидной пленкой, предохраняющей металл от дальнейшего окисления[2]. В связи с этим его поверхность обычно имеет не блестящий, а матовый вид[3]. При накаливании мелко раздробленного алюминия он энергично сгорает на воздухе. Аналогично протекает и его взаимодействие с серой. С хлором и бромом его соединение происходит уже при обычной температуре, с иодом - при нагревании. При очень высоких температурах алюминий непосредственно соединяется также с азотом и углеродом, а с водородом он не взаимодействует. По отношению к воде алюминий практически вполне устойчив. Сильно разбавленные, а также очень крепкие HNO3 и H2SO4 на алюминий практически не действуют, тогда, как при средних концентрациях кислот алюминий постепенно растворяется. По отношению к CH3COOH и H3PO4 алюминий устойчив. Чистый металл также устойчив и по отношению к соляной кислоте, но обычный технический в ней растворяется. Алюминий легко растворим в сильных щелочах (NaOH, KOH)[2]:
|
|
2Al+2NaOH+6H2O=3H2+2Na[Al(OH)4] (1)
Довольно энергично разъедается он также раствором аммиака [2]. Соединение алюминия с кислородом сопровождается громадным выделением тепла, значительно большим, чем в случае многих других металлов. Ввиду этого при накаливании смеси оксида такого металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла[2].
Оксид алюминия представляет собой белую очень тугоплавкую и не растворимую в воде массу. Природный Al2O3 (минерал корунд), а так же полученный искусственно и затем сильно прокаленный, отличается большей твердостью и нерастворимостью в кислотах. Обычно загрязненный оксидом железа природный корунд вследствие своей чрезвычайной твердости применяется для изготовления шлифовальных кругов, брусков т.п.
Ввиду нерастворимости Al2O3 в воде, отвечающий этому оксиду гидроксид [Al(OH)3], может быть получен только косвенным путем (исходя из солей). Он представляет собой объемистый студенистый осадок белого цвета, практически не растворимый в воде, но растворяющийся в кислотах и сильных щелочах. Гидроксид алюминия имеет, следовательно, амфотерный характер. Однако и основные, и кислые свойства его выражены довольно слабо[3].
С тех пор как алюминий стал доступным для промышленного использования, он получил широкое распространение. Из него изготавливают аппараты для промышленных целей, а также многочисленные предметы домашнего обихода. Обрезки алюминиевой жести перерабатывают в алюминиевый порошок, употребляемый в качестве литографической краски, а так же для изготовления взрывчатых веществ, применяемых в пиротехнике[2].
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!