Одной из важнейших характеристик атомов и молекул является их масса. Наиболее универсальным и точным методом измерения масс атомных и молекулярных частиц является масс- спектрометрия. В настоящее время созданы приборы, позволяющие производить измерения масс с точностью до 0,0001% и регистрировать молекулы с массой до 10000 атомных единиц. Масс-спектрометрия нашла очень широкое применение как в научных исследованиях, так и при решении разнообразных прикладных задач. В ядерной физике с помощью масс- спектрометрии производятся изотопные измерения, определяется состав продуктов деления ядер, устанавливается точное значение масс ядер. В молекулярной физике определяется молекулярная масса вещества, элементный состав и строение молекул, измеряется энергия связи атомов в молекуле и другие её характеристики. Возможность определения массы, элементного состава и строение молекул делает масс- спектрометрию уникальным аналитическим методом. Масс- спектрометрия широко используется для определения состава сложных органических и биоорганических соединений, металлических сплавов, композиционных материалов, различных газовых сред и т.д. Благодаря своей высокой чувствительности и быстродействию масс- спектрометрия оказалась очень эффективной при изучении кинетики химических процессов; процессов, протекающих в плазме, атмосфере и др. Сущность масс-спектрометрического метода измерения состоит в следующем: в устройстве, которое называется ионным источником, исследуемое вещество подвергается энергетическому воздействию. При этом образуются свободные ионы, которые направляются в масс-анализатор – устройство, где происходит пространственное или временное разделение ионов по массам. После масс - анализатора ионы регистрируются. Обычно при измерениях параметры масс - анализатора изменяются таким образом, чтобы в регистрирующее устройство последовательно попадали ионы с разной массой. Такая запись, выполненная в цифровом или графическом виде, называется масс-спектром. В качестве примера на рис.1 приведён масс-спектр остаточных газов, записанный на лабораторном приборе. Таким образом, масс-спектр представляет собой набор пиков. Положение пика в масс-спектре определяет массу зарегистрированного иона, а его площадь – относительное количество ионов данного типа. Важной характеристикой любого масс-спектрометра является его разрешающая способность.

а. Вакуумная ловушка прибора б. Вакуумная ловушка пуста
заполнена жидким азотом
Рис. 1. Масс-спектры остаточного газа лабораторного прибор.
В настоящее время используются несколько типов масс-анализаторов, которые можно разделить на две основные группы: статические и динамические. Принцип действия статического анализатора основан на том, что при движении заряженной частицы в поперечном магнитном поле кривизна её траектории однозначно определяется массой частицы. Поэтому после прохождения магнитного поля ионы с разными массами разделяются в пространстве, и, следовательно, каждый тип иона может быть зарегистрирован отдельно. Работа динамических масс-анализаторов основана на том, что при движении заряженной частицы в электрическом поле её скорость определяется также массой частицы, и, поэтому, за один и тот же промежуток времени ионы с разной массой пройдут пути разной длины. Используя импульсные или переменные электрические поля, можно пропустить на коллектор только ионы заданной массы.
Классическим примером статических анализаторов является анализатор с секторным магнитным полем. На рис. 2 приведена схема такого масс-анализатора, в котором ионы, проходя через поперечное магнитное поле, изменяют направление своего движения на 180 градусов (угол сектора, занимаемого магнитным полем).

Рис. 2. Движение ионов в поперечном магнитном поле.
Сферическая аберрация может быть уменьшена путём использования магнитного поля со специально подобранными границами. Причиной хроматической аберрации может быть нестабильность ускоряющего напряжения, а также разброс ионов по начальным кинетическим энергиям. Для устранения хроматической аберрации ионный пучок пропускают через специальный энергоанализатор. Такие комбинированные масс - анализаторы называются анализаторами с двойной фокусировкой. В современных масс-спектрометрах угол поворота ионов в магнитном поле, обычно берётся меньше 180. В этом случае для выполнения условия фокусировки пучка по направлениям необходимо, чтобы выходная щель ионного источника, вершина угла секторного магнитного поля и коллекторная щель лежали на одной прямой, как показано на рис.3.

Рис. 3. Секторный магнитный анализатор.
Примером использования динамических анализаторов масс может служить времяпролётный масс-спектрометр, схема которого приведена на рис.4, использующий прерывистый ускоряющий потенциал.

Рис. 4. Схема времяпролётного масс-спектрометра.
Это даёт возможность разбить пучок ионов на отрезки, что позволяет сортировать ионы по их скоростям, что равносильно сортировке по массам. Этот принцип положен в основу времяпролётного масс-спектрометра. Пучок электронов ионизирует образец в режиме электронного удара или химической ионизации. К сетке приложен ускоряющий потенциал порядка нескольких киловольт в форме импульсов напряжения длительностью 1 мкс и менее с частотой несколько десятков тысяч Гц. Эти импульсы сообщают ускорение ионам в длинной, свободной от полей, трубе дрейфа, вдоль которой, ионы движутся со своими собственными скоростями. Пройдя бесполевую, область ионы детектируются.
Промежуточным между масс - спектрометрами, использующими статический и динамический анализаторы масс, можно считать масс-спектрометр ионно-резонансного типа, принцип работы которого имеет большую аналогию с циклотроном.
На рис.5 представлен ионный источник масс-спектрометра ионно-циклотронного резонанса, который одновременно является и анализатором их масс.

Рис. 5 Принцип действия омегатронного масс-спектрометра
1, 2 – высокочастотные пластины, 3 – катод, 4 – коллектор ионов, 5 –
коллектор электронов.
Ионизационная коробочка, давление в которой не превышает 10-5 торр, помещена в постоянное магнитное поле, а к пластинам 2 приложено переменное электрическое поле с частотой. Электронный пучок, параллельный направлению магнитного поля, ионизирует молекулы, присутствующие в объёме. Под действием полей B и Е ионы описывают вокруг электронного пучка спиральные траектории в плоскости, перпендикулярной B. Из этих ионов только частицы с зарядом и массой, циклотронная чистота которых равна частоте приложенного электрического поля, описывают раскручивающиеся спирали, в результате чего попадают на коллектор ионов 4.
Эти ионы, называемые резонансными, отдают свой заряд коллектору, которого не могут достичь ионы другой массы. При изменении частоты приложенного электрического поля на коллектор ионов попадают частицы с различным отношением e/m.
Каждой собранной группе частиц с одной и той же массой соответствует пик ионного тока, амплитуда которого пропорциональна количеству собранных ионов и ширина которого является функцией приложенных электрического и магнитного полей.
Назначение и возможности масс-спектрометра в значительной степени определяются типом ионных источников, которыми он укомплектован. Источники разделяются на два основных класса: газовые источники и источники для анализа твёрдых веществ. В ионных источниках первого типа вещество в области ионизации находится в газообразном состоянии. Для ионизации газа чаще всего используют быстрые электроны. Устройство такого ионного источника показано на рис.6.

Рис.6. Устройство газового ионного источника.
Анализируемый газ поступает в ионизационную коробочку, где он ионизируется электронным пучком. Энергия электронов задаётся разностью потенциалов, приложенной между катодом и ионизационной коробочкой. Образующиеся ионы вытягиваются из коробочки и ускоряются до требуемой энергии. Ширина пучка и его угловая расходимость определяются геометрией выходных щелей источника. Обычно ионизационная коробочка находится под высоким (ускоряющим) потенциалом, а выходная щель – при потенциале земли.
Ионизация электронным ударом является наиболее простым и универсальным способом получения ионов. Энергию ионизирующих электронов можно изменять в широких пределах. Обычно используют электроны с энергией 70 - 150 эВ, при которой сечение ионизации максимально. При ионизации молекул электронами с такой энергией возникают процессы диссоциативной ионизации. [7]
Система вода образца
Для того чтобы избежать нежелательных химических реакций в результате взаимодействия молекул и ионов, в источнике масс-спектрометра, как правило, поддерживается высокий вакуум (10-5-10-6 ммрт. ст.). Поэтому уже сам ввод образца является самостоятельной технической задачей.
2.3.1. Баллон напуска
Одной из первых систем ввода, практически не используемой в настоящее время, служил баллон напуска (рис. 7). Анализируемое вещество находилось в газообразном состоянии (давление около Ю-2 мм.рт.ст.) в баллоне объемом 50-2000 см3, внутренняя поверхность которого была остеклена для предотвращения нежелательных химических реакций на стенках сосуда. В поздних вариантах предусматривалась система нагрева пробы в баллоне. Этот резервуар соединялся с источником ионов отверстием очень небольшого диаметра, через которое осуществлялось молекулярное натекание образца в масс-спектрометр.

Рис.7. Баллон напуска.
Альтернативными вариантами соединительного отверстия служили капилляры или пористые диафрагмы. Эти устройства позволяли получить стабильную концентрацию вещества в источнике и были необходимы на начальных этапах развития органической масс-спектрометрии, когда применялись малоэффективные вакуумные системы, а скорость развертки масс-спектра составляла минуты. Очевидным недостатком данного ввода является необходимость переводить вещество в газовую фазу в условиях неглубокого вакуума, что для многих образцов весьма проблематично. Конструкции стыковки баллонов напуска с ионными источниками подробно описаны в фундаментальном труде Джона Бейнона.
2.3.2. Прямой ввод.
Развитие техники позволило в 60-х годах XX века перейти на более совершенную систему ввода, которая является общепринятой и широко распространенной в настоящее время. Это — прямой ввод вещества в область ионизации. Твердый образец помещается в специальную микрокапсулу (стекло, кварц, керамика, металл), которая штоком вводится непосредственно в ионный источник, т. е. испарение осуществляется прямо в источнике ионов в условиях глубокого вакуума. При необходимости образец может быть нагрет с помощью программируемой печки до температуры 400-500°С, а в некоторых случаях, как, например, в условиях десорбционной химической ионизации, — выше 1000°С. Понятно, что в этих условиях количество соединений, доступных
масс-спектрометрическому анализу, значительно возрастает. Полное испарение введенного образца позволяет измерить количество соединения, т. е. прямой ввод позволяет наряду с качественным проводить и количественный анализ веществ.
Важно обращать внимание не только на температуру прямого ввода, но и на температуру источника ионов. Если вещество труднолетучее, а прямой ввод перегрет, оно может конденсироваться на стенках источника, что ведет к его быстрому загрязнению. Кроме того, последовательные процессы испарения и конденсации приводят к увеличению роли деструкции вещества и, соответственно, к искажению масс-спектра. Процессы деструкции имеют место и в случае слишком высокой температуры источника. Принципиальная схема прямого ввода представлена на рис. 8.
Программируемый нагрев образца в вакууме позволяет решить одновременно три задачи: во-первых, перевести в газовую фазу широкий круг органических соединений;

Рис.8. Система прямого ввода.
во-вторых, подобрать оптимальную температуру съемки, когда воспроизводится качественный масс-спектр; в-третьих, анализировать смеси соединений с разной степенью летучести. Такое фракционное испарение позволяет в некоторых случаях провести достаточно быстрый качественный и количественный анализ смеси без ее предварительного разделения.
Важной характеристикой прямого ввода является существенное уменьшение количества образца, необходимого для получения масс-спектра. В данном случае следует опасаться ввести слишком много вещества. Считается, что твердый образец в капилляре на конце штока должен быть едва различим глазом. Избыточное количество образца может привести к искажению масс-спектра из-за протекания ионно-молекулярных реакций и вызвать быстрое загрязнение источника ионов. Многие масс-спектрометристы предпочитают наносить вещество из раствора и вводят шток в источник после испарения растворителя.
Еще один важный параметр съемки для наиболее распространенных спектров электронного удара связан с положением образца относительно пучка электронов. Если образец расположен достаточно далеко, его молекулы достигают пучка электронов только после ряда последовательных столкновений со стенками источника. При этом возрастает роль процессов термодеструкции. Однако если поместить образец слишком близко к пучку электронов, наконечник штока может приобрести отрицательный заряд и начать отталкивать электроны, что приводит к расфокусировке пучка.
Система прямого ввода применяется в основном в сочетании с методами электронного удара и химической ионизации, хотя его модификации используются в случае бомбардировки быстрыми атомами и для некоторых других методов
ионизации.
2.3.3. Мембранный ввод.
Достаточно перспективным является мембранный ввод пробы. Мембрана изготавливается из органического материала и пропускает в источник масс-спектрометра соединения, растворимые или адсорбируемые материалом мембраны и обладающие высоким коэффициентом диффузии в нем. Анализируемое соединение должно быть достаточно летучим, чтобы испаряться на вакуумированной стороне мембраны. В одном из приводимых ниже вариантов мембрана размещается вне источника ионов (рис. 9), в другом — капиллярная мембрана вводится непосредственно в источник (рис. 10). Достоинством такого ввода является селективность в пропускании веществ разной природы. Поскольку мембрана не пропускает воду, неорганические газы и соли, она может использоваться для эффективного мониторинга загрязнения воздуха или воды органическими соединениями, а также для контроля биохимических процессов. Например, в работе показано, что предел обнаружения в воде для широкого круга органических соединений с молекулярной массой <300 Да может достигать нанограммов в литре. В литературе описаны возможности непрерывного мониторинга органических соединений в сточных и природных водах, в воздухе, мониторинга биологических реакций.

Рис. 9. Размещение мембраны вне Рис. 10. Размещение мембраны внутри
источника ионов источника ионов
2.3.4. Хроматомасс-спектрометрия, ГХ-МС (GC-MS).
На сегодняшний день хроматомасс-спектрометрия (хромасс, ГХ-МС) является
наиболее широко используемой разновидностью органической масс-спектрометрии, хотя, начиная с 90-х годов XX века, многочисленные варианты комбинированного метода высокоэффективная жидкостная хроматография — масс-спектрометрия используются все шире и в ближайшее время, вероятно, займут лидирующее положение.
Стыковка газового хроматографа и масс-спектрометра была абсолютно логичной, поскольку оба метода использовались для анализа смесей органических соединений в газовой фазе и обладали приблизительно равной чувствительностью. Единственной проблемой для объединения двух методов в едином приборе являлось рабочее давление. Газовый хроматограф работает при атмосферном давлении, а масс-спектрометр— в условиях глубокого вакуума. Основные принципы стыковки были сформулированы и претворены в жизнь в 1957 году. Первоначальные проблемы, связанные с недостаточной мощностью вакуумных систем и набивными колонками с рабочими потоками газа-носителя 30 мл/мин, решались установкой сепараторов различного типа. Эти устройства размещались между выходным концом колонки хроматографа и ионным источником масс-спектрометра и предназначались для обогащения пробы анализируемым веществом за счет избирательной откачки значительно более легкого газа-носителя (водород, гелий). Появление более мощных вакуумных систем и капиллярных колонок с меньшими потоками (0,5-2,0 мл/мин) значительно облегчило задачу, а замена металла или стекла, из которых изготавливались колонки, на плавленый кварц позволила ввести конец колонки непосредственно в ионный источник. Все это сделало метод ГХ-МС простым и эффективным.
Метод прежде всего предназначен для анализа смесей органических соединений и заключается в их разделении на колонке хроматографа с последовательным выходом компонентов из колонки в ионный источник масс-спектрометра, где происходит их ионизация. Масс-спектрометр должен проводить запись спектра (сканирование) с достаточной частотой, чтобы зарегистрировать масс- спектр каждого соединения несколько раз. Это условие является важнейшим, поскольку концентрация вещества очень быстро изменяется. В зависимости от того, на восходящей или нисходящей стороне хроматографического пика будет записан масс-спектр, будут дискриминированы или низкие, или высокие массы (рис. 11).
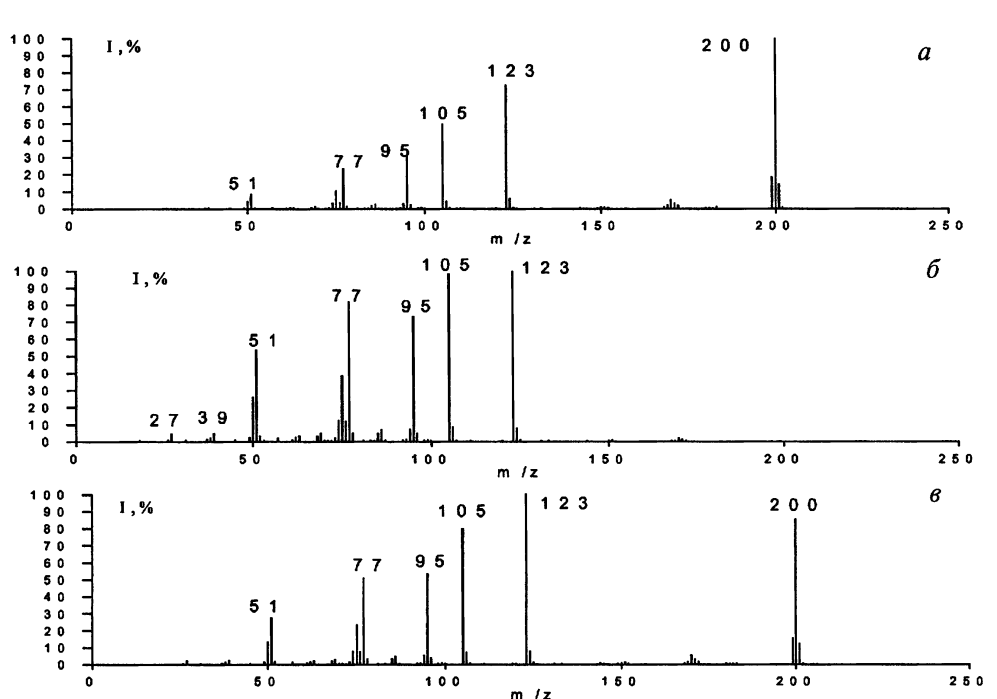
Рис. 11. Масс-спектры л-фторбензофенона на восходящей стороне (а), на нисходящей
стороне (б) и вершине хроматографического пика (в)
Безусловно, лучшим будет спектр, зарегистрированный на вершине хроматографического пика, где максимальна концентрация вещества и минимальны ее изменения во времени. Желательно получить 5-10 спектров каждого компонента смеси, а для улучшения качества спектра часто необходимо проводить усреднения и вычитания фона. Очень важна скорость сканирования и для количественного анализа. Недостаточное число сканирований приводит к значительному искажению площади хроматографического пик.
Хромасс добавляет к масс-спектрометрической информации еще один очень важный параметр — время удерживания. Именно благодаря этому параметру появляется возможность во многих случаях проводить качественный и количественный анализ изомеров, масс-спектры которых практически неразличимы. Хромасс позволяет также детектировать ультрамикрокомпоненты на фоне высоких концентраций других соединений.
В методе реакционной хроматомасс-спектрометрии перед колонкой хроматографа или между колонкой и масс-спектрометром устанавливается реакционная камера, в которой можно осуществлять заданные превращения анализируемых соединений. В таком варианте дериватизация, разделение и анализ компонентов пробы осуществляются в режиме «on-line». Реакционная хроматомасс-спектрометрия может использоваться для улучшения разделения компонентов смеси или для проведения структурных анализов.
2.3.5. Жидкостная хроматография—масс-спектрометрия, ЖХ-МС (LC-MS)
Решить проблему анализа тяжелых полярных термолабильных соединений
можно при замене газового хроматографа на жидкостный. Наиболее сложным моментом оказывается стыковка жидкостного хроматографа с масс-спектрометром. Масс-спектрометр обычно работает в условиях глубокого вакуума (10-6 мм рт. ст.), а скорость потока через стандартную колонку жидкостного хроматографа составляет примерно 1 мл/мин. Две наиболее часто используемые в современной хроматографии жидкие фазы —метанол и вода. Испаряясь в источнике ионов, 1 мл метанола образует 0,55л пара, а 1 мл воды—1,24 л пара.
2.3.5.1. Ленточный транспортер (Moving Belt)
Исторически первым интерфейсом можно считать ленточный транспортер, появившийся в 1976 г. Принципиальная схема устройства представлена на рис. 12.
Его основной конструкционной деталью является тонкая полиимидная кольцевая лента. Элюат из колонки хроматографа попадает на ленту, движущуюся по направлению к источнику ионов. На пути следования он проходит вдоль инфракрасных испарителей, которые переводят в газовую фазу значительную долю подвижной фазы. Далее лента проходит вакуумный замок, и в условиях вакуума остатки растворителя откачиваются насосами. В месте перегиба ленты, в ионном источнике, находится импульсный нагреватель, который переводит в газовую фазу молекулы образца, подвергающиеся электронному удару или химической ионизации. Двигаясь в обратном направлении, лента очищается от избытка нанесенного образца благодаря дополнительным испарителям, а
иногда и растворителям, и возвращается за новой порцией элюата в исходном (теоретически чистом) виде.

Рис. 12. Принципиальная схема ленточного транспортера.
К достоинствам метода следует отнести:
1. Возможность использования стандартных библиотек масс-спектров электронного удара для идентификации исследуемых веществ.
2. Возможность работы со стандартными колонками для жидкостной хроматографии, поскольку метод использует скорости потока до 1.5 мл/мин. Такие потоки приемлемы при распылении элюата на ленту.
3. Неорганические соли, используемые в качестве буфера при хроматографировании, не мешают анализу.
Тем не менее ленточные транспортеры не получили широкого признания, поскольку лишь незначительно расширяли круг органических соединений, доступных масс-спектрометрическому анализу.
2.3.5.2. Прямой ввод жидкости (Direct Liquid Introduction, DLI)
Данный метод тоже следует рассматривать скорее как историю масс-спектрометрии. Он более или менее активно использовался в 80-х годах XX века, но уступил место более прогрессивной технике, основанной на аналогичном принципе. Фактически все современные интерфейсы ЖХ-МС, за исключением проточного варианта бомбардировки быстрыми атомами, могли бы быть названы прямым вводом жидкости.
Для реализации прямого ввода жидкости на выходе из хроматографической колонки устанавливается диафрагма с отверстием 2-5 мкм (рис. 13). Возникающая струя мелких капель, движется с большой скоростью к источнику ионов.

Рис. 13. Принципиальная схема метода прямого ввода жидкости.
На пути следования капли проходят через камеру испарения, где большая часть растворителя переходит в газовую фазу. Оказываясь в источнике масс-спектрометра, молекулы анализируемого вещества подвергаются химической ионизации, тогда как молекулы растворителя играют роль газа-реагента. Основной недостаток метода— низкая скорость потока. Давление в источнике становится слишком высоким при потоках более 50 мкл/мин. Поэтому требуется либо разделять поток из стандартных хроматографических колонок, уменьшая тем самым чувствительность метода примерно в 20 раз, либо использовать узкие колонки. Кроме того, узкое отверстие диафрагмы постоянно забивается, а добавки неорганических солей к подвижной фазе приводят к быстрому ухудшению работы масс-спектрометра.
2.3.5.3 Поток частиц (Particle Beam)
В этом варианте интерфейса поток из колонки хроматографа направляется через капилляр в стеклянный распылитель, где элюат превращается в облако мелких капель, разорванных концентрическим потоком гелия. Это облако перемещается внутри стеклянной испарительной камеры, стенки которой подогреваются, а давление поддерживается на уровне чуть ниже атмосферного. При этом происходит частичное испарение растворителя, и размер капель уменьшается. Испарительная камера заканчивается узким отверстием, за которым следует сепаратор молекулярного пучка с вакуумной откачкой (рис. 14). Вылетая из испарительной камеры, частицы приобретают высокую скорость благодаря сужению потока. Поскольку более тяжелые молекулы анализируемого вещества менее подвержены диффузии, чем атомы гелия или молекулы растворителя, именно они и проходят в узкое входное отверстие сепаратора, а из него в масс- спектрометр.

Рис. 14. Принципиальная схема интерфейса с потоком частиц.
Частицы анализируемого вещества в ионном источнике подвергаются химической или электронной ионизации. Получение спектров электронного удара является преимуществом метода, поскольку позволяет использовать компьютерные библиотеки масс-спектров. Такой интерфейс может работать с потоками жидкости из хроматографа в диапазоне от 0,1 до 1,0 мл/мин. Чувствительность метода для получения полного масс-спектра лежит на уровне единиц нанограммов (10-9 г). Этот метод фактически заменил ленточный транспортер, хотя и не устранил недостатков, связанных с невозможностью работы с высокомолекулярными, нелетучими и термолабильными соединениями.
2.3.5.4. Термораспыление или термоспрей (Thermospray, TSP) и плазмораспыление или плазмаспрей (Plasmaspray).
Принципиальная схема методов термораспыление и плазмораспыление представлена на рис. 15. В этом случае поток из колонки жидкостного хроматографа направляется в нагреваемый капилляр. Диаметр капилляра 0,1 мм, что значительно больше по сравнению с отверстием для метода прямого ввода жидкости. Это устраняет случаи закупорки — серьезный недостаток прямого ввода жидкости. Температура капилляра поддерживается на уровне температуры кипения растворителя. В результате из капилляра вырывается струя пара, которая попадает в ионизационную камеру. В случае плазмаспрея подача напряжения на разрядный электрод или просто пучок электронов создают условия химической ионизации, причем роль газа-реагента играют пары растворителя.
Работая в режиме плазмораспыления, исследователи замечали, что часто удается регистрировать ионы даже в случае выключенного электрода. Анализ этого эффекта привел к возникновению техники термораспыления. Дело в том, что некоторые анализируемые соединения уже в растворе находятся в виде положительных или отрицательных ионов. Используемые в большинстве случаев в качестве растворителей в жидкостной хроматографии вода и метанол с добавками кислот и оснований могут протонировать или депротонировать субстрат. Появлению заряда служат также добавки электролитов, например ацетата аммония. Струя пара, выходящая из капилляра, представляет собой аэрозоль небольших заряженных капель. Нагретый источник ионов и работающие вакуумные насосы заставляют эти капли при движении уменьшаться в размере. В конечном итоге градиент поля на каплях может достигать критических значений, что приводит к устранению сольватной оболочки и появлению свободных ионов в газовой фазе. Выталкивающий потенциал направляет эти ионы в узкое отверстие, ведущее к анализатору, а избыток растворителя откачивается насосами (рис. 15).
Термоспрей и плазмаспрей применимы к потокам жидкости из хроматографа в диапазоне от 0,5 до 2,0 мл/мин, что позволяет работать с обычными аналитическими колонками. Следует отметить нежелательность использования в качестве буфера нелетучих неорганических солей из-за возможного образования отложений в источнике ионов.

Рис. 15. Принципиальная схема термоспрея (плазмаспрея)
В качестве недостатка метода можно отметить его плохую воспроизводимость. Интенсивность спектра, а также наличие или отсутствие фрагментных ионов существенно зависят от состава раствора, наличия добавок, температуры капилляра и источника. В связи с этим важным становится выбор оптимальных условий регистрации спектра для каждого анализируемого вещества. Чувствительность метода лежит в очень широком диапазоне, от единиц нанограммов до десятков микрограммов. Увеличение доли пиков фрагментных ионов в спектре достигается увеличением потенциала на выталкивающем электроде. Причиной тому становятся более эффективные столкновения разогнанных ионов с молекулами, так как в этой части ионного источника давление достаточно высоко.[8]
Методы ионизации
Протонирование - механизм ионизации, при котором к молекуле присоединяется протон, сообщая ей заряд 1+ на каждый присоединённый протон. Положительные заряды обычно локализуются на основных частях молекулы, таких, как амины, с образованием стабильных катионов. Пептиды часто ионизируются при помощи протонирования. Протонирование осуществляется при MALDI, ESI и APCI.
Депротонирование - механизм ионизации, при котором отрицательный заряд 1- получается при отрыве протона от молекулы. Такой механизм ионизации обычно осуществляется при MALDI, ESI и APCI и очень полезен для определения кислотных образцов, включая фенолы, карбоновые кислоты и сульфоновые кислоты.
Катионизация - механизм ионизации, в котором заряженный комплекс образуется при координационном присоединении положительно заряженного иона к нейтральной молекуле. В принципе, пртонирование тоже подпадает под это определение, поэтому катионизацией считается присоединение иона, отличного от протона, например щелочного металла или аммония. Кроме того, катионизацияприменима к молекулам, которые неспособны к протонированию. Связь катионов, в отличие от протонов, с молекулой менее ковалентна, поэтому заряд остаётся локализован на катионе. Это минимизирует размывание заряда и фрагментацию молекулы. Катионизация также может быть произведена при MALDI, ESI и APCI. Углеводы - лучшие вещества для такого механизма ионизации, с Na+ как обычным присоединённым катионом.
2.4.1 Прямой перенос заряженной молекулы в газовую фазу
Перенос соединений, уже заряженных в растворе, легко достигается при использовании десорбции или выбрасыванием заряженных частиц из конденсированной фазы в газовую. Обычно это осуществляется с использованием MALDI или ESI.
Циклотронно-резонансный масс-анализатор представлен на рисунке 16.

Рисунок 16 - Циклотронно-резонансный масс-анализатор.
Высокочастотное электрическое поле в области анализатора позволяет идентифицироватьионы с данной величиной m/е по резонансному поглощению энергии ионами при совпадении частоты поля и циклотронной частоты ионов.
2.4.2 Отрыв электрона
Как видно из названия механизма, отрыв электрона придаёт молекуле 1+ положи-тельный заряд при выбивании электрона, так что при этом часто образуются катион-ради-калы. Наблюдаемый, в основном, при электронной ионизации, отрыв электрона обычно применяется для относительно неполярных соединений с низкой молекулярной массой. Также известно, что он часто приводит к образованию значительных количеств фраг-ментарных ионов.
2.4.3 Захват электрона
При захвате электрона, отрицательный заряд 1- сообщается молекуле при присоединении электрона. Этот механизм ионизации в первую очередь наблюдается для молекул с большим сродством к электрону, таких как галогенсодержащие соединения.
2.5.4 Основы масс-спектрометрии
Масс-спектрометр определяет массу молекулы, измеряя отношение массы к заряду (m/z) её иона. Ионы генерируются при потере или получении заряда нейтральными частицами. После образования ионы электростатически направляются в анализатор массы, где они разделяются соответственно своемуm/z и, наконец, детектируются. Результатом ионизации молекул, разделения ионов и детектирования ионов является спектр, по которому можно определить молекулярную массу и даже некоторую информацию о строении вещества. Можно провести аналогию между масс-спектрометром и призмой. В призме свет разделяется на компоненты по длинам волн, которые затем определяются оптическим рецептором. Точно так же, в масс-спектрометре сгенерированные ионы разделяются в анализаторе массы, подсчитываются и определяются в детекторе ионов (таких, как, например, электронный умножитель).[9]
Выводы
Масс-спектрометрия становится важным методом анализа биологических и небиологических макромолекул. Она является одним из самых чувствительных и точных методов, способным определять всего лишь сотни молекул, уступая в этом только радиационным методам анализа. Разрешение некоторых методов достигает 30000, что означает точность порядка десятков ppm. Такая точность даёт возможность изотопного анализа макромолекул, таких, как белки, а также определения дефекта массы и расчёта брутто-формулы лёгких молекул и даже белков только по данным определения молекулярной массы и изотопного распределения.
Фрагментарная информация, особенно при использовании тандемной масс-спектрометрии даёт возможность определять структуру молекулы, а также, в ограниченных масштабах, механизмы газофазных реакций и реакционные центры исследуемых молекул.
Вместе с тем, масс-спектрометрия является одним из самых дорогих методов анализа, наряду с ЯМР-спектрометрией, уступая в этом только рентгеноструктурному анализу. Это обусловлено, главным образом, необходимостью организации высокого вакуума внутри прибора и связанных с этим трудностей при выборе оборудования.
Мною получено задание исследовать углеводородный состав неизвестной пробы методом хромато-масс-спектрометрии.
Эксперементальная часть
Масс-спектрометрическое исследование проводилось на приборе DFSThermoElectronCorporation (Германия). Метод ионизации: электронный удар. Энергия ионизирующих электронов составляла 70эВ, температура источников ионов 290°С. Использовалась капиллярная колонка ID-BPX5, длина -60 м, диаметр-0,32 мм. Газ-носитель – гелий. Обработка масс-спектральных данных проводилась с использованием программы «Xcalibur». Проба исследуемого образца перед вводом прибор разводилась в хроматографически чистом бензоле в концентрации -1 % масс.
Условия получения хроматограммы:
1. Температура инжектора – 250°С, деление потока (split) - 1:20;
2. Прогрев колонки осуществлялся в программном режиме:
Начальная температура – 120°С (1 мин), скорость нагрева 20 °С/мин, до 120 конечная температура – 280 °С (15 мин);
3. Поток газа-носителя через колонку – 2 мл/мин;
4. Температура устройства коммуникации с масс-спектрометром – 280°С;
5. Объем пробы 0,1 мкл.
Полученная в результате эксперимента хроматограмма, исследуемой неизвестной пробы, показана на рисунке 3.1.
Рисунок 3.1 – Хроматограмма, полученная в результате эксперимента


Рисунок 3.2 – Хроматограмма – Передний участок
Проводим интерпретацию полученного масс-спектраисследуемой пробы. Ниже приведены результаты обработки масс-спектральных данных на рисунках 3.3 – 3.17
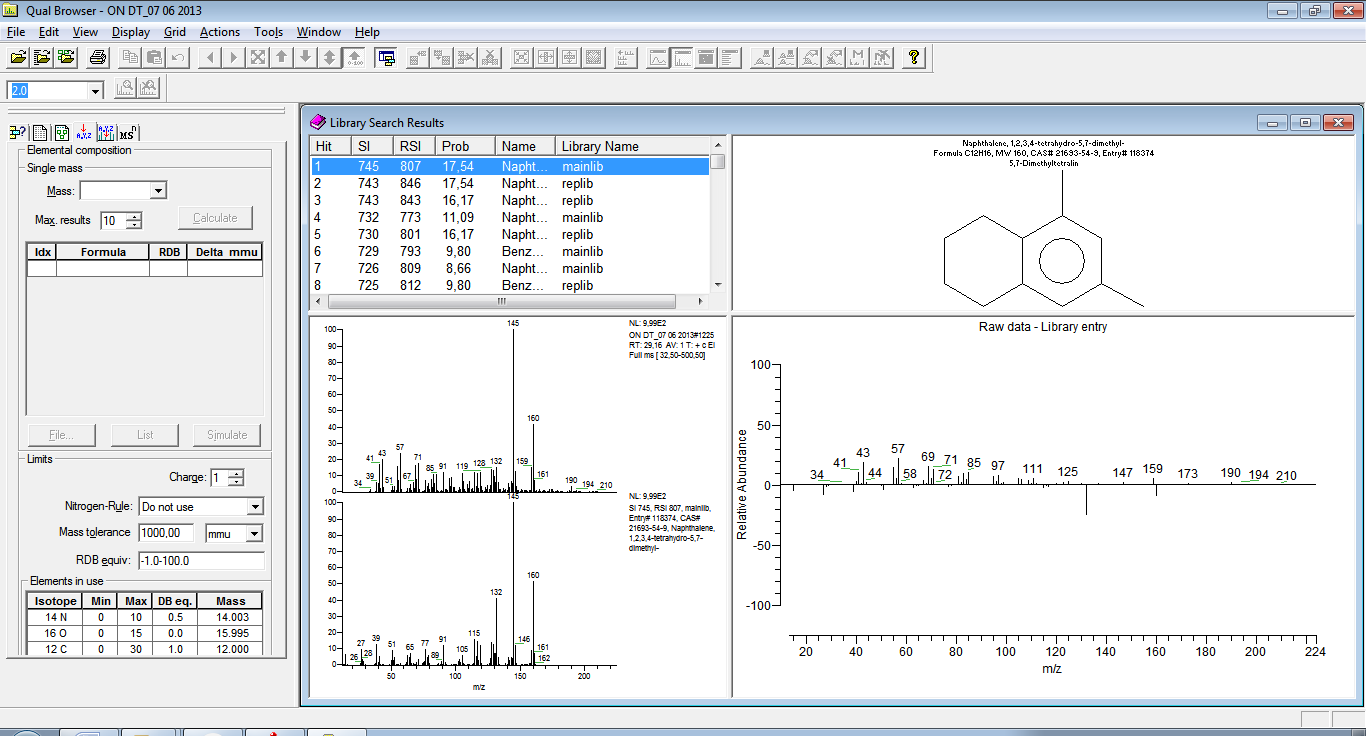
Рисунок 3.3 -Соединение С12Н16, полученный в результате выхода
из колонки на 29.16 min

Рисунок 3.4 -Соединение С17Н24О, полученный в результате вы<























