Физико-химические процессы
Горения и взрыва
Практикум
Часть 1
Пермь
ФГОУ ВПО «Пермская ГСХА»
2016
УДК 621.7.148
ББК 79.3
Физико-химические процессы горения и взрыва (ТЕКСТ): практикум сост. Л. В. Куслина, ФГОУ ВПО «Пермская ГСХА», 2010.-72.; 20см.- 50 экз.101с.
Практикум составлен Л. В. Куслиной.
Рецензенты:
Кафедра Безопасности жизнедеятельности Пермского государственного технического университета, заведующий кафедрой доктор технических наук, профессор В.А.Трефилов;
Кафедра физической химии Пермского государственного университета, кандидат химических наук, доцент кафедры физической химии С.П. Шавкунов.
Cборник практических занятий предназначен для студентов очного и заочного обучения инженерного факультета специальности 280101 «Безопасность жизнедеятельности в техносфере». Книга станет хорошим помощником в изучении дисциплины, при проведении практических занятий, подготовке к сдаче экзаменов и зачетов, в написании рефератов по дисциплине «Физико-химические процессы горения и взрыва». Данное учебное пособие соответствует государственному образовательному
Рекомендовано к изданию кафедрой «Безопасность жизнедеятельности» (протокол № от 25.06.2016) и методической комиссией инженерного факультета (протокол № от 25.06. 2016).
Оглавление
Введение …………………………………………………………………………..4
1.Материальный баланс процесса горения……………………...5
1.1.Практическое занятие №1 по теме: «Расчёт количества воздуха, необходимого для горения веществ»…………………………………….………7
1.2. Практическая работа№2 по теме: «Расчет объема и состава продуктов горения»…………………………………………………………………………..20
2.Тепловой баланс процессов горения ………………………….23
2.1Практическая работа№3 по теме: «Расчет теплоты сгорания веществ»….27
2.2.Практическая работа№4 по теме: «Расчет температуры горения»………32
3.Концентрационные пределы воспламенения………………40
3.1Практическая работа№5 по теме: «Концентрационные пределы воспламенения»………………………………………………………………….43
4Температурные параметры пожарной опасности веществ……………………………………………………………………….55
4.1.Практическая работа№6 по теме: «Расчет температурных пределов воспламенения» …………………………………………………………………61
4.2.Практическая работа№7 по теме: «Расчет температур вспышки
и воспламенения»……………………………………………………………….64
4.3.Практическая работа№8 по теме: «Расчет стандартной температуры самовоспламенения»…………………………………………………………….70
5.Потенциал горючести…………………………………………………77
5.1.Практическая работа№9 по теме: «Потенциал горючести»………………78
Перечень тем и разделов, которые рекомендуются для самостоятельного изучения………………………………………………………………………….83
Контрольные вопросы по курсу«Физико-химические основы горения и взрыва»…………………………………………………………………………...84
Список используемой литературы……………………………………………...88
Приложения……………………………………………………………………...89
Введение
Спецкурс ОПД 05 - «Физико-химические основы горения и взрыва», согласно государственному образовательному стандарту представляет собой совокупность следующих вопросов: физико-химические основы горения; теории горения: тепловая, цепная, диффузионная; виды пламени и скорости его распространения; условия возникновения и развития процессов горения; взрывы: типы взрывов, физические и химические взрывы, классификация взрывов по плотности вещества, по типам химических реакций, энергия и мощность, форма ударной волны, длительность импульса.
Данный практикум предназначен для формирования у студентов практических навыков по спецкурсу «Физико-химические основы горения и взрыва».
В практикуме представлены расчетные работы по следующим темам:
1. Материальный баланс процесса горения;
2. Тепловой баланс процессов горения;
3. Концентрационные пределы воспламенения;
4. Температурные параметры пожарной опасности;
5. Потенциал горючести.
Расход воздуха на горение
При горении происходит взаимодействие между молекулами горючего вещества и окислителя, при этом получаются продукты сгорания.
Горючее вещество + Окислитель = Продукты сгорания
Как правило, окислителем при горении выступает кислород воздуха. Схематично химическую реакцию сгорания одного моля вещества в воздухе можно представить уравнением:
ГВ + β(О2 + 3,76 N2) = ∑ ni·ПГi + β·3,76N2,
в котором символами ГВ, О2, N2, ПГi обозначены молекулы, соответственно горючего вещества, кислорода, азота и i-го продукта горения; ni — количество молекул i–го продукта горения, приходящееся на одну молекулу горючего; β — стехиометрический коэффициент реакции горения.
Это лишь суммарная реакция, но она достаточна для проведения практических расчетов и является обобщенной записью материального баланса реакции горения.
Минимальный объем воздуха, который необходим для полного сгорания единицы количества горючего вещества, называется удельным теоретическим объемом воздуха и обозначается V0в.В зависимости от единиц измерения количества горючего вещества (1 моль, 1 м³, 1 кг) удельный объем измеряется в м³/моль, м³/м³, м³/кг.
Действительное количество воздуха, который поступает в зону горения, отличается от теоретического. Соответствующий объем называется удельным действительным объемом воздуха и обозначается vв. Разность между количеством воздуха, который идет на горение и теоретически необходимым, называется избытком воздуха. Для характеристики процесса горения используют понятие коэффициент избытка воздуха - αв., который показывает, во сколько раз количество воздуха, который действительно поступает в зону горения, отличается от теоретически необходимого количества для полного сгорания единицы количества горючего вещества.
Таким образом, действительный удельный объем воздуха равняется:
Vв = v0в · αв.
Часть воздуха, неизрасходованная на горение, переходит в продукты горения.
В случае кинетического горения, при αв = 1, смесь горючего с воздухом является стехиометрической. Величина тепловыделения на единицу продуктов сгорания при этом максимальна, вследствие чего температура в зоне горения также максимальна.
При αв< 1 в смеси недостаток окислителя и излишек горючего вещества. Такая смесь называется богатой. Характерной особенностью процесса горения в этом случае является образование продуктов неполного сгорания.
При αв > 1 смесь называется бедной. В ней недостаток горючего вещества и излишек окислителя. При этом продукты горения включают в себя избыток воздуха.
Продукты горения - это газообразные, твердые и жидкие вещества, образующиеся в процессе горения.
Состав продуктов горения зависит от состава горючего вещества и условий протекания реакции горения. Продукты горения образуют дым.
Дым - дисперсная система, состоящая из твердых и жидких частиц (дисперсной фазы), находящихся в газовой дисперсионной среде.
Свойства дыма характеризуются следующими параметрами:
- Концентрация дыма - это масса продуктов горения, находящихся в единице объема. В зоне задымления концентрация продуктов горения находится в интервале от 1·10–4 до 5·10–3 кг/м³.
- Наличие конденсированной фазы обуславливает непрозрачность дыма. Степень снижения прозрачности зависит от концентрации, размера и природы частиц дисперсной фазы. Параметром, характеризующим оптические свойства дыма, является плотность задымления.
- Плотность задымления — отношение интенсивности света Iп, прошедшего через слой дыма, к интенсивности падающего света Ij.
- Dд = Iп/Iо
- Содержание кислорода. В обычных условиях содержание кислорода в воздухе составляет 21% (объемный). Снижение концентрации кислорода в воздухе приводит к кислородному голоданию людей. Так, при снижении концентрации ниже 16%, работа без индивидуальных средств защиты органов дыхания невозможна.
- Токсичность продуктов горения - способность продуктов горения вызвать отравления людей, находящихся без индивидуальных средств защиты органов дыхания.
- Температура дыма. Температура продуктов горения непосредственно возле зоны горения может достигать 1000°С, но в помещениях температура дыма обычно существенно ниже. Основным фактором, влияющим на температуру дыма, являются условия газообмена. При увеличении коэффициента избытка воздуха температура продуктов горения снижается. Опасной для людей, считается температура выше 70°С. Продолжительное пребывание людей при такой температуре, связано с риском для жизни из-за перегрева организма.
Стойкость дыма определяют такие параметры дымовых частиц, как:
- маленькая масса;
- высокая удельная поверхность;
- броуновское движение, в котором они находятся;
- наличие на их поверхности электрического заряда.
Продукты неполного сгорания, образующиеся при горении веществ и материалов в закрытых помещениях, при поступлении свежего воздуха могут образовывать горючую смесь. Горение при этом происходит в кинетическом режиме (взрыв).
Практическая работа №1
Тема: «Расчёт количества воздуха, необходимого для горения веществ»
Цель работы: Ознакомиться с классификацией процессов горения, сформировать представления про основные параметры, характеризующие пожарную опасность веществ в разных агрегатных состояниях, освоить способы определения этих параметров. Освоить расчеты необходимого количества воздуха для горения.
Примеры решения задач.
Пример №1.
Определить теоретическое количество воздуха, необходимого для горения 1м3 метана при нормальных условиях.
Решение: Горючее вещество является индивидуальным химическим соединением, поэтому для расчета его объема надо пользоваться формулой (1.3.а). Запишем уравнение химической реакции горения СН4 в воздухе:
СН4+ 2О2+2∙3,76N2=CО2+2Н2О+2∙3,76N2
Из уравнения находим: no2=2; nN2=2∙3,76=7,52; nCH2=1;тогда
V0B=  м3/ м3 или кмоль/кмоль
м3/ м3 или кмоль/кмоль
Пример №2
Определить объем теоретического количества воздуха, необходимого для горения 1кг бензола.
Решение: горючее – индивидуальное химическое соединение, поэтому для расчета по формуле (1.3.б) запишем уравнение химической реакции горения:
С2Н2+7,75O2+7,75∙3,76N2=6CO2+3H2O+7,75∙3,75N2 и найдем:
nО2=7,75; nN2=7,5∙3,76=28,2; nr=1,
Молекулярная масса бензола М=6∙12+6∙1=78 объем 1 кмоля газа при нормальных условиях составляет 22.4м3:
V0B=y m:val="p"/></m:rPr><w:rPr><w:rFonts w:ascii="Cambria Math" w:h-ansi="Times New Roman"/><wx:font wx:val="Cambria Math"/><w:color w:val="000000"/><w:sz w:val="28"/><w:sz-cs w:val="28"/></w:rPr><m:t>=10,3</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 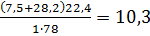 м3/кг
м3/кг
Пример №3
Определить объем воздуха, необходимого для горения 1кг органической массы состава: С-60%, О-25%, N-5%, W-%(влажность), если коэффициент избытка воздуха  а температура воздуха 305К, давление 995ГПа.
а температура воздуха 305К, давление 995ГПа.
Решение: Так как горючее вещество сложного состава, то теоретическое количество воздуха при нормальных условиях определим по формуле (1.4):
V0B=0,269( )=5,9 м3/кг
)=5,9 м3/кг
Из формулы (1.7) рассчитаем практическое количество воздуха при нормальных условиях:
V0B=  V0B=2,5∙5,9=14,75 м3/кг
V0B=2,5∙5,9=14,75 м3/кг
Находим количество воздуха, пошедшего на горение вещества при заданных условиях горения; используя формулу (1.6), получим:
VB(р,т)=  =16,8 м3/кг
=16,8 м3/кг
Пример №4.
Определить объем воздуха, необходимого для горения 5м3смеси газов, состоящих из 20% СН4, 10% СО, 5%N, 35%О2, если коэффициент избытка воздуха равен 1,8.
Решение: Горючее-смесь газов. Поэтому для расчета объема воздуха, пошедшего на сгорание, воспользуемся формулой (1.5). Для определения стехиометрических коэффициентов при кислороде nо2 запишем уравнение реакции горения горючих компонентов в кислороде:
СН4+2О2=СО2+2Н2О;
С 2Н2+2,5О2=2СО2+Н2О; СО+0,5О2=СО2 тогда
V0B=  =5,7 м3/кг
=5,7 м3/кг
Для горения 5м3 газовой смеси необходимый теоретический объем воздуха составит: V0B=5∙5,7 =32,5 м3 Практическое количество воздуха: V0B=1,8∙32,5=58,5 м3.
Пример №5
Определите коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1кг поступило 3 м3 воздуха.
Решение: Для определения коэффициента избытка воздуха по формуле (1.7) необходимо рассчитать его теоретическое количество. Молекулярная масса уксусной кислоты-60.
СН3СООН+2О2+2∙3,76N2=2СО2+2∙3,76 N2;
V0B=  м3/кг
м3/кг
тогда коэффициент избытка воздуха равен:


Горение протекало при недостатке воздуха.
Пример №6
Определить объем воздуха, пошедшего на окисление 1м3 аммиака:
NН3+0,75О2 +0,75 3,76 N2=1,5Н2О+0,5N2+0,75∙3,76N2,
тогда
V0B=  м3/кг
м3/кг
Для определения коэффициента избытка воздуха по формуле (1.10) необходимо рассчитать теоретическое количество продуктов горения 1м3аммиака (см. след параграф 1.2 формула (1.14)):
V0пр=  м3/кг
м3/кг
Пример №7
Определить объем окислительной среды, состоящей из 60%О2 и 40%N2,необходимый для горения 1 кг изопропилового спирта, если ее температура равна 295К, давление 620гПа.
Решение: так как окислительная среда отличается по составу от воздуха, определим по формуле (1.1) объемное соотношение кислорода и азота: 40:60+0,67
Уравнение реакции горения изопропилового спирта:
С3Н7ОН+4,5О2+4,5 0,67N2=3СО2+4Н2О+4,5⋅0,67 N2
Теоретический объем окислительной среды при нормальных условиях рассчитаем по формуле (1.3). Молекулярная масса горючего-60.
V0ос=  =2,8 м3/кг
=2,8 м3/кг
Объем окислительной среды при заданных условиях горения определим из формулы (1.6):
V0ос(рr)=  м3/кг
м3/кг
Пример № 8
Определить сколько кг динитротолуола сгорело в герметичном объеме 100м3, если содержание кислорода в продуктах сгорания составило 12%.
Решение: Так как в продуктах горения содержится кислород, то горение протекало в избытке воздуха, коэффициент избытка которого определим по формуле (1.10). Для этого запишем уравнение горения:
С7Н6(NO2)2+6,5O2+6,5∙3,76N2=7CO2+3H2O+N2+6,5∙3,76N2
Молекулярная масса горючего-182.Теоретический объем воздуха равен:
V0B=  =3,8 м3/кг
=3,8 м3/кг
Теоретический объем продуктов горения (формула1.14):
V0пr= 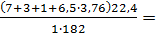 4,4 м3/кг
4,4 м3/кг

Практический объем воздуха, пошедший на горение:
VB= 2,55 ∙3.8=9,7 м3/кг
Тогда массу сгоревшего динитротолуола Р определим из соотношения:
Рr =  , Рr =
, Рr =  =10,3 кг
=10,3 кг
Контрольные задачи
1. Определить количество (теоретическое) воздуха, необходимое для горения 1кг: метилового, этилового, пропилового и амилового спиртов. Построить график зависимости объема воздуха от молекулярной массы спирта.
2. Определить теоретический объем воздуха, необходимого для горения 1м3: метана, этана, пропана, бутана и пентана. Построить график зависимости объема воздуха от положения вещества в гомологическом ряду (содержания углерода в молекуле вещества).
3. Определить теоретический объем воздуха, пошедший на горение 1кг: метана, метилового спирта. Объяснить причину влияния состава вещества на объем воздуха, требуемый для их горения.
4. Определить объем воздуха, пошедший на горение 1 кг древесины состава: С-47%, Н-8%, О-40%, W -5% если коэффициент избытка воздуха равен 2,8; давление 900ГПа, температура 285К.
5. Сколько воздуха поступило на горение 1кг углерода, если в продуктах горения содержание кислорода составило 17%?
6. Сколько воздуха требуется подать на сжигание 200м3 генераторного газа состава: СО-29%, Н2-14%, СН4-3%, СО2-6,5%, N 2 -45%, O 2 -2,5% если коэффициент избытка воздуха равен 2,5?
7. Определить количество сгоревшего толуола, кг. в помещении объемом 400 м3,если после пожаре при отсутствии газообмене установлено, что содержание кислорода снизилось до 17%.
8. Сколько м3хлора поступило на горение 300м3 водорода, если в продуктах горения избыток окислителя составил 80м3?
9. Определить избыток воздуха в продуктах горения газовой смеси состава: СО-15%, С4Н10-45%,О2-30%, N 2 -10% если коэффициент избытка равен 1,2;температура 265К; давление 850ГПа
10. Сколько м3 окислительной среды, состоящей из 50% кислорода, 50% азота, необходимо для горения 8кг этилацетата, если коэффициент избытка равен 1,2; температура 265К; давление 850 ГПа.
11. Определить коэффициент избытка окислительной среды, состоящей из 70% кислорода и 30% азота, если при горении серы содержание кислорода снизилось до 55%. Определить количество сгоревшей серы, кг, если объем помещения равен 180 м3.
12. Сколько антрацита (принять, что содержание углерода равно 100%) сгорело в помещении объемом 150м3, если прекращение горения наступило при снижении кислорода до 13%, газообмен не учитывать
Домашнее задание к теме: «Расчёт количества воздуха,
Практическая работа№2
Тема: «Расчет объема и состава продуктов горения»
Цель работы: изучить состав продуктов горения, методы и приборы для их изучения; научиться делать расчеты ТПВ для ряда химических веществ.
Существует несколько полуэмпирических методов расчета ТПВ, однако они мало отличаются друг от друга по точности.
Температурные пределы воспламенения жидкостей рассчитывают по температуре кипения:
t H ( B ) = Kt кип - 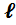 , (4.1.)
, (4.1.)
где tH ( B ) -нижний (верхний) температурный предел воспламенения оС;
t кип – температура кипения оС;
К и  - константы для определения групп (гомологических рядов) жидкостей. Их значения приведены в табл.6 приложения
- константы для определения групп (гомологических рядов) жидкостей. Их значения приведены в табл.6 приложения
Температурные пределы воспламенения могут быть определены по известным значениям концентрационных пределов:
Р (НВ)=  , (4.2.)
, (4.2.)
где Р (НВ) -давление насыщенного пара, соответствующее нижнему(верхнему) концентрационному пределу воспламенения;
 – нижний (верхний) концентрационный предел воспламенения;
– нижний (верхний) концентрационный предел воспламенения;
 Р0- атмосферное давление.
Р0- атмосферное давление.
По таблице 7 приложения определяем температуру вещества, при которой достигается данное давление. Она будет являться соответственно нижним (верхним) пределом воспламенения.
Примеры решения задач
Пример №1
Определить температурные пределы воспламенения (ТПВ)метилового спирта, если температура его кипения равна 65о.
Решение: Расчет производим по формуле (4.1), значение констант определяем по табл.6 для нормальных жирных спиртов:
tH=0,5746*65-33,7=3,6оС=276,6 К;
tB =0,6928*15,0=30 оС=303К.
Определим относительную ошибку расчета. По табл.5 приложения находим что ТПВ метилового спирта равны 280 +312 К:
∆Н= 
∆в= 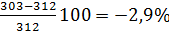
Следовательно, результаты расчета занижены менее чем на 3%
Пример № 2 Определить температурные пределы воспламенения (ТПВ) ацетона, если его концентрационные пределы в воздухе равны 2,2 +13%. Атмосферное давление- нормальное.
Решение: По формуле (4.2) определим давление насыщенного пара ацетона, соответствующее нижнему и верхнему пределам воспламенения:
РH= 
РВ= 
Из таблицы 7 приложения следует, что нижние температурные пределы вещества (НТПВ) находятся между температурами 241,9 и 252.2К. а верхние температурные пределы вещества (ВТПВ)- между 271,0 и 280,7К.
Линейной интерполяцией определим ТПВ:
Тн=241,9+ 
ТВ=  К
К
Зная справочные значения ТПВ ацетона (253+279К.см. приложение5), можно определить относительную ошибку расчета:
∆Н= 
∆В= 
Контрольные задачи
1. Определить температурные пределы воспламенения в гомологическом ряду жирных углеводородов:
| вариант
| 1
| 2
| 3
| 4
|
| углеводород
| Бутан
| Гексан
| Октан
| Пентан
|
| Т кипения (К)
| 273.6
| 309.0
| 398.7
| 304.7
|
2. Построить график изменения ТПВ от положения горючего в гомологическом ряду.
3. Сравнить температурные пределы воспламенения Н- бутиловых эфиров муравьиной и уксусной кислот. На основании полученных данных сделать вывод о их сравнительной пожарной опасности. Температура кипения бутилформиата равна 379.8К, а бутилацетата-399К.
4. Определить температурные пределы воспламенения бутилбензола по его концентрационным пределам. Значение последних рассчитать по аппроксимационной формуле.
5. По концентрационным пределам воспламенения, значение которых установить по аппроксимационной формуле, определить температурные пределы воспламенения ацетона и метилэтилкетона. По результатам расчета сделать вывод о сравнительной пожарной опасности этих веществ.
ОСНОВНЫЕ ПОНЯТИЯ ЭНЕРГЕТИЧЕСКОГО БАЛАНСА ПРОЦЕССА ГОРЕНИЯ
Под тепловым эффектом реакции понимают количество теплоты, которое выделяется или поглощается системой в ходе реакции.
В тех случаях, когда теплосодержание системы после реакции уменьшается (реакция идет с выделением энергии), реакция является экзотермической. Если теплосодержание конечных продуктов выше исходных (реакция идет с поглощением энергии), реакция является эндотермической.
Теплосодержание системы определяется теплотой образования компонентов системы (продуктов горения и исходного вещества). Таким образом тепловой эффект реакции можно записать:
ΔHг = ∑ ΔH 0fпг − ∑ ΔHofгв,
где ΔHofпг и ΔHofгв — теплота образования продуктов горения и исходных горючих веществ соответственно.
Теплота образования веществ определяется по справочникам или рассчитывается исходя из структуры вещества.
Теплотой сгорания называется количество тепла, выделяющееся при полном сгорании единицы количества вещества при условии, что начальные и конечные продукты находятся в стандартных условиях.
Различают:
молярную Q — для одного моля (кДж/моль),
массовую Q′ − для одного килограмма (кДж/кг),
объемную Q″ − для одного кубического метра вещества (кДж/м³) теплоту сгорания.
В зависимости от агрегатного состояния воды, образовавшейся в процессе горения, различают высшую Qв и низшую Qн теплоту сгорания.
Высшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества, включая тепло конденсации водяных паров.
Низшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества при условии, что вода в продуктах горения находится в газообразном состоянии.
Молярную теплоту сгорания рассчитывают в соответствии с законом Гесса:
Qгор=  I ∆H0 fгв, кДж/моль
I ∆H0 fгв, кДж/моль
Для расчета молярной теплоты сгорания Q в массовую Q′ можно использовать формулу:
Q 1`гор= 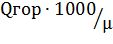 , кДж/моль
, кДж/моль
где μ - молярная масса горючего вещества, кг/кмоль.
Для веществ в газообразном состоянии при пересчете из стандартной теплоты сгорания Q в объемную Q″ используют формулу:
Q 2гор= 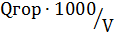 μ
μ
где Vμ - объем кило моля газа, который при стандартных условиях составляет 22,4 м³/кмоль.
Для сложных горючих веществ или смесей можно вывести формулу определения теплоты сгорания исходя из состава и процентного содержания компонентов.
Достаточно точные результаты дает формула Менделеева для высшей теплоты сгорания:
Qв′ = 339,4·φ С + 1256,8·φН + 108,9(φS − φO – φN),
где φO, φN, φS, φС, φН — процентное содержание кислорода, азота, серы, углерода, водорода в горючем веществе.
Для низшей теплоты сгорания:
Qн′ = Qв′ – 25,1(9·φН + W%), кДж/кг,
где W% − содержимое влаги в горючем веществе.
Теплота сгорания имеет большое практическое значение при расчете пожарной нагрузки и параметров пожара.
Под пожарной нагрузкой (Рпож) понимают количество тепла, которое может выделиться при сгорании веществ и материалов, приходящихся на один квадратный метр поверхности пола помещения, МДж/м².
Пожарная нагрузка является количественной характеристикой, определяющей тепловое влияние пожара на строительные конструкции. Пожарную нагрузку рассчитывают как сумму произведений масс всех горючих материалов на их низшую теплоту сгорания, отнесенную к единице поверхности пола по формуле:
P=  ∙10-3, МДж/м².
∙10-3, МДж/м².
Низшая теплота сгорания также используется для определения пожарной опасности горючих веществ. Экспериментально доказано, что вещества являются негорючими, если они не относятся к взрывоопасным и их низшая теплота сгорания меньше, чем 2100 кДж/кг или 1830 кДж/м³.
ТЕМПЕРАТУРА ГОРЕНИЯ
Тепло, выделяющееся в зоне горения, расходуется на нагревание продуктов горения и теплопотери (к последним относятся предварительный нагрев горючего вещества и излучение из зоны горения в окружающую среду).
Максимальная температура в зоне горения, до которой нагреваются продукты горения, называется температурой горения.
В зависимости от условий, в которых протекает процесс горения различают калориметрическую, теоретическую, адиабатическую и действительную температуры горения.
Под калориметрической температурой горения понимают температуру, до которой нагреваются продукты горения при соблюдении следующих условий:
1) все тепло, выделившееся в процессе реакции, идет на нагревание продуктов горения;
2) происходит полное сгорание стехиометрической горючей смеси, коэффициент избытка воздуха (αв =1);
3) в процессе образования продуктов горения не происходит их диссоциация;
4) горючая смесь находится при начальной температуре 273К и давлении 101,3 кПа.
Теоретическая температура горения отличается от калориметрической тем, что в расчетах учитываются тепло потери на диссоциацию продуктов горения.
Диссоциацию продуктов горения нужно учитывать при температурах выше 1700°С.
Адиабатическая температура горения определяется для не стехиометрической горючей смеси (αв ≠1).
Действительная температура горения - это температура, до которой нагреваются продукты горения в реальных условиях.
Температуру горения используют при расчетах давления взрыва, для определения площади легко сбрасываемых конструкций, температуры пожара и других параметров.
Практическая работа №3
Тема: «Расчет теплоты сгорания веществ».
Цель работы: Усвоить основные понятия энергетического баланса процессов горения. Научиться делать расчет теплоты сгорания для разного типа горючего вещества (индивидуальные вещества, сложные вещества, газы)
Расчетные формулы
При расчетах теплового баланса на пожаре определяют, как правило, низшую теплоту сгорания(табл.2.1):
QB - QH = Q ИС (2.1),
где QB -высшая теплота сгорания; QH-низшая теплота сгорания;
Q ИС - теплота испарения воды, выделяющейся при сгорании вещества.
Таблица 2.1.
| Тип горючего вещества
| Расчет теплоты сгорания
| Размерность
|
| Индивидуальное
вещество
|
Qн=  (2.2) (2.2)
| кДж/моль;
|
| Вещества сложного
Состава (формула Д.И.Менделеева)
|
Qн=339,4С+1257Н-108,9(О-S)-25,1(9H+W) (2.3)
|
кДж/кг
|
| Смесь газов
|
Qн=  Hi∙φri (2.4) Hi∙φri (2.4)
| кДж/моль;
кДж/м3
|
Где  - соответственно теплоты образования одного кмоля i-го конечного продукта горения и
- соответственно теплоты образования одного кмоля i-го конечного продукта горения и  исходного вещества;
исходного вещества;
 ,
,  - соответственно количество кмолей
- соответственно количество кмолей 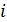 -гопродукта реакции и
-гопродукта реакции и  исходного вещества в уравнении реакции горения;
исходного вещества в уравнении реакции горения;
С, Н, S, W - соответственно содержание, % вес, углерода, серы, водорода, влаги в составе вещества;
О- сумма кислорода и азота,% вес
QHi -низшая теплота сгорания 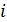 -го горючего компонента газовой смеси, кДж/моль; кДж/м3
-го горючего компонента газовой смеси, кДж/моль; кДж/м3
φri - содержание 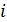 -го горючего компонента в газовой смеси,% об.
-го горючего компонента в газовой смеси,% об.
Расчет теплоты сгорания газовоздушных смесей проводят по формуле по формуле
Q см н =  Q н φr (2.5),
Q н φr (2.5),
где Q см н - теплота сгорания газовоздушной смеси, кДж/м3, кДж/м3
QH -низшая теплота сгорания горючего вещества, кДж/м3, кДж/м3
φri - концентрация горючего в смеси, % об.
Удельная скорость (интенсивность) тепловыделения при горении:
q = QH ∙ m (2.6)
q - удельная интенсивность тепловыделения,кВт/м3;
m - массовая скорость выгорания, кг/(м2∙с).
Скорость тепловыделения при горении:
Q= QH∙m (2.7), где Q -интенсивность тепловыделения, кВт;
F - площадь горения, м3.
Примеры решения задач
Пример №1 Определить низшую теплоту сгорания уксусной кислоты, если теплота ее образования 485,6 кДж/моль;
Решение: Для расчета по формуле (2.2) запишем уравнение горения уксусной кислоты в кислороде:
СН3СООН+2О2=2СО2+2Н2О;
QH=(2∙396,9+2∙242,2-1∙485,6)=792,6 кДж/моль=792,6∙103 кДж/моль;
Для расчета количества тепла, выделяющегося при горении 1кг горючего, необходимо полученную величину разделить на его молекулярную масса (64):
QH=792,6∙103/64=12384кДж/кг.
Пример №2
Рассчитать низшую теплоту сгорания органической массы состава:
С-62%, Н-8%, О-28%, S-2%.
Решение: По формуле Д.И.Менделеева (2.3)
QH=339,4∙62+1257∙8-108,9(28-2)-25,1∙9∙8=26460кДж/кг.
Пример №3
Определить низшую теплоту сгорания газовой смеси, состоящей из
СН4-40%, С4Н10-20%, О2-15%, Н2S-5%, NH3-10%, CO2-10%
Решение: Для каждого горючего компонента смеси по формуле (2.2) находим теплоты сгорания (табл.2.2)
Таблица 2.2.
| Уравнение реакции
| Теплота образования
горючего,
103 кДж/моль;
| Теплота сгорания,
10-3 кДж/моль;
|
| СН4+2О2=СО2+2Н2О
| 333,5
| QH=1∙396,9+2∙242,2-333,5=547,8
|
| C4H10+5,6O2=4CO2+5H2O
| 132,4
| QH=4∙396,9+5∙242,2-132,5=2666,1
|
| H2S+1,5O2=H2O+SO2
| 201,1
| QH=242,2+297,5=201,1=338,6
|
| NH3+0,75O2=1,4H2O+0,5N2
| 46,1
| QH=1,5∙242,2-46,1=317,2
|
По формуле (2.4) определим теплоту сгорания газовой смеси:
QH=1/100∙(547.8∙40+2666,1∙20+338,6∙5+317,2∙10)103=1020∙103 кДж/кг.
Для определения теплоты сгорания 1м3газовой смеси необходимо полученное значение разделить на объем, занимаемый 1 Кмолем газа при стандартных условиях(24,4м3):
QH=1020∙10 3/24,4=41803 кДж/кг.
Пример №4
Рассчитать теплоту сгорания 1м3 стехиометрической гексано - воздушной смеси.
Решение: Находим стехиометрический состав горючей смеси по уравнению реакции горения:
C6H14+9,5O2+9,5∙3,76N2=6CO2+7H2O=9,5∙3,76N
Весь объем вступивших в реакцию компонентов(1+9,5+9,5∙3,76) принимаем за 100%,а количество горючего (1кмоль) будет соответствовать стехиометрической концентрации:
Φст= 



 м3/ м3 или кмоль/кмоль
м3/ м3 или кмоль/кмоль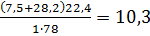 м3/кг
м3/кг а температура воздуха 305К, давление 995ГПа.
а температура воздуха 305К, давление 995ГПа. )=5,9 м3/кг
)=5,9 м3/кг V0B=2,5∙5,9=14,75 м3/кг
V0B=2,5∙5,9=14,75 м3/кг =16,8 м3/кг
=16,8 м3/кг =5,7 м3/кг
=5,7 м3/кг м3/кг
м3/кг

 м3/кг
м3/кг м3/кг
м3/кг =2,8 м3/кг
=2,8 м3/кг м3/кг
м3/кг =3,8 м3/кг
=3,8 м3/кг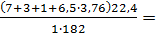 4,4 м3/кг
4,4 м3/кг
 , Рr =
, Рr =  =10,3 кг
=10,3 кг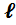 , (4.1.)
, (4.1.) - константы для определения групп (гомологических рядов) жидкостей. Их значения приведены в табл.6 приложения
- константы для определения групп (гомологических рядов) жидкостей. Их значения приведены в табл.6 приложения , (4.2.)
, (4.2.) – нижний (верхний) концентрационный предел воспламенения;
– нижний (верхний) концентрационный предел воспламенения; Р0- атмосферное давление.
Р0- атмосферное давление.
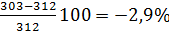



 К
К

 I ∆H0 fгв, кДж/моль
I ∆H0 fгв, кДж/моль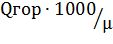 , кДж/моль
, кДж/моль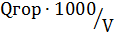 μ
μ ∙10-3, МДж/м².
∙10-3, МДж/м². (2.2)
(2.2)
 Hi∙φri (2.4)
Hi∙φri (2.4)
 - соответственно теплоты образования одного кмоля i-го конечного продукта горения и
- соответственно теплоты образования одного кмоля i-го конечного продукта горения и  исходного вещества;
исходного вещества; ,
,  - соответственно количество кмолей
- соответственно количество кмолей 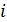 -гопродукта реакции и
-гопродукта реакции и  Q н φr (2.5),
Q н φr (2.5),



