Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний.
Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений.
Реальные процессы изменения состояния системы всегда происходят с конечной скоростью, поэтому не могут быть равновесными. Реальный процесс изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается, поэтому равновесные процессы называют квазистатическими.
Термодинами́ческие ци́клы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия), совпадают.
Цикл карно - обратимый круговой процесс, в котором совершается превращение теплоты в работу (или работы в теплоту). К. ц. состоит из последовательно чередующихся двух изотермических и двух адиабатных процессов.
К  . ц. осуществляется следующим образом: рабочее тело (например, пар в цилиндре под поршнем) при температуреT1 приводится в соприкосновение с нагревателем, имеющим постоянную температуру T1, и изотермически получает от него количество теплоты dQ1(при этом пар расширяется и совершает работу).На рис. 1 этот процесс изображен отрезком изотермы AB. Затем рабочее тело, расширяясь адиабатически (по адиабате BC), охлаждается до температуры T2. При этой температуре, сжимаясь изотермически (отрезок CD), рабочее тело отдаёт количество теплоты dQ2 холодильнику с температурой T2. Завершается К. ц. адиабатным процессом (DA на рис. 1), возвращающим рабочее тело в исходное термодинамическое состояние. При постоянной разности температур (T1 - T2) между нагревателем и холодильником рабочее тело совершает за один К. ц. работу
. ц. осуществляется следующим образом: рабочее тело (например, пар в цилиндре под поршнем) при температуреT1 приводится в соприкосновение с нагревателем, имеющим постоянную температуру T1, и изотермически получает от него количество теплоты dQ1(при этом пар расширяется и совершает работу).На рис. 1 этот процесс изображен отрезком изотермы AB. Затем рабочее тело, расширяясь адиабатически (по адиабате BC), охлаждается до температуры T2. При этой температуре, сжимаясь изотермически (отрезок CD), рабочее тело отдаёт количество теплоты dQ2 холодильнику с температурой T2. Завершается К. ц. адиабатным процессом (DA на рис. 1), возвращающим рабочее тело в исходное термодинамическое состояние. При постоянной разности температур (T1 - T2) между нагревателем и холодильником рабочее тело совершает за один К. ц. работу 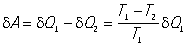
Билет №11
Вопрос №2
Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия идеального газа. Классическая МКТ теплоемкости идеального газа. Связь числа степеней свободы с показателем адиабаты.
Важной характеристикой термодинамической системы является ее внутренняя энергия U - энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц. К внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Число степеней свободы i - это число независимых координат, полностью определяющих положение тела в пространстве. Для одноатомных молекул газа (He, Ne, Ar) i=3, для двухатомных молекул газа (H2, O2, N2) с жесткой связью атомов i=5, для трех- и более атомных молекул газа с жесткой связью атомов (CO2, NH3) i=6.
Закон равномерного распределения энергии по степеням свободы: на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная kТ/2.
Следовательно, средняя кинетическая энергия молекулы, имеющей i степеней свободы, <Wk> = ikT/2.(1)
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (т.е. молекулы между собой не взаимодействуют), то внутренняя энергия U представляет собой кинетическую энергию его молекул.
Для одного моля  ,(2)
,(2)
для произвольной массы m газа 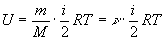 , где М - масса моля, n=m/M - число молей.
, где М - масса моля, n=m/M - число молей.
Таким образом, внутренняя энергия идеального газа пропорциональна температуре газа и зависит от числа степеней свободы его молекул.
Согласно классической молекулярно-кинетической теории теплоемкости
идеального газа
CV= iR/2
Cp= (i + 2)R/2
Показатель адиабаты 
Билет №12
Вопрос №1



 . ц. осуществляется следующим образом: рабочее тело (например, пар в цилиндре под поршнем) при температуреT1 приводится в соприкосновение с нагревателем, имеющим постоянную температуру T1, и изотермически получает от него количество теплоты dQ1(при этом пар расширяется и совершает работу).На рис. 1 этот процесс изображен отрезком изотермы AB. Затем рабочее тело, расширяясь адиабатически (по адиабате BC), охлаждается до температуры T2. При этой температуре, сжимаясь изотермически (отрезок CD), рабочее тело отдаёт количество теплоты dQ2 холодильнику с температурой T2. Завершается К. ц. адиабатным процессом (DA на рис. 1), возвращающим рабочее тело в исходное термодинамическое состояние. При постоянной разности температур (T1 - T2) между нагревателем и холодильником рабочее тело совершает за один К. ц. работу
. ц. осуществляется следующим образом: рабочее тело (например, пар в цилиндре под поршнем) при температуреT1 приводится в соприкосновение с нагревателем, имеющим постоянную температуру T1, и изотермически получает от него количество теплоты dQ1(при этом пар расширяется и совершает работу).На рис. 1 этот процесс изображен отрезком изотермы AB. Затем рабочее тело, расширяясь адиабатически (по адиабате BC), охлаждается до температуры T2. При этой температуре, сжимаясь изотермически (отрезок CD), рабочее тело отдаёт количество теплоты dQ2 холодильнику с температурой T2. Завершается К. ц. адиабатным процессом (DA на рис. 1), возвращающим рабочее тело в исходное термодинамическое состояние. При постоянной разности температур (T1 - T2) между нагревателем и холодильником рабочее тело совершает за один К. ц. работу 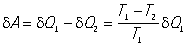
 ,(2)
,(2)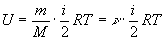 , где М - масса моля, n=m/M - число молей.
, где М - масса моля, n=m/M - число молей.



