

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
Топ:
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Фармакогнозия
Методические указания
Занятие №2. ФАРМАКОГНОСТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ
Фармакопейные методы определения подлинности цельного ЛРС
Фармакопейные методы определения числовых показателей и примесей ЛРС
Список условных сокращений
БАВ – биологически активное вещество
ГФ РБ – Государственная фармакопея Республики Беларусь. В трех томах.
ЛР – лекарственное растение
ЛРС – лекарственное растительное сырье (или лекарственное сырье растительного происхождения)
ЛС – лекарственное средство
НД – нормативный документ, нормативная документация
ПФ – подвижная фаза
ТСХ – тонкослойная хроматография
УФ - ультрафиолетовый
ФС – фармакопейная статья
Учебные цели
Теоретические основы темы
Фармакогностический анализ – это комплекс методов анализа ЛРС, сырья животного происхождения и их продуктов, устанавливающий его подлинность и доброкачественность по всем параметрам НД.
Подлинность (идентичность) – соответствие исследуемого образца тому наименованию, под которым оно поступило для анализа. Подлинность исследуемого ЛРС устанавливается путем: 1) макроскопического анализа; 2) микроскопического анализа; 3) качественного химического анализа (качественные реакции, в т.ч. использование явления люминесценции); 4) тонкослойной хроматографии.
Доброкачественность – соответствие ЛРС требованиям всех разделов НД (содержание примесей, степень измельчения (для цельного ЛРС), потеря в массе при высушивании, содержание золы, действующих веществ и др.).
|
|
I. Цель, задачи и техника макроскопического анализа ЛРС
Макроскопический анализ - вид фармакогности-ческого анализа, основанный на определении морфологических признаков сырья. Макроскопический анализ ЛРС проводится в соответствии с 2.8.23 ГФ РБ II, т.1.
Цель макроскопического анализа – установление подлинности и определение доброкачественности ЛРС (по показателю «Внешние признаки»).
В ходе макроскопического анализа необходимо:
а) определить форму (сравнительно с простейшей геометрической);
б) охарактеризовать цвет;
в) установить наличие и характер запаха;
г) определить в кус (неядовитого ЛРС);
е) определить размеры ЛРС (длину, ширину, диаметр).
Техника макроскопического анализа сводится к изучению внешнего вида ЛРС невооруженным глазом или с помощью лупы (×10), измерению отдельных его частей, проведению органолептических проб, руководствуясь разделом «Внешние признаки» соответствующей НД.
Первую аналитическую пробу ЛРС, предназначенную для определения подлинности, измельченности и содержания примесей, раскладывают на специальную доску, матовое стекло или клеенку и внимательно рассматривают невооруженным глазом или с помощью лупы, обращая внимание на морфологические признаки сырья.
Размеры ЛРС определяют с помощью миллиметровой линейки или раскладывая сырье на миллиметровой бумаге. Для объективного суждения о размерах частей сырья для ЛРС размером более 3 см проводят 10-15 измерений, для ЛРС размером менее 3 см – 20-30 измерений.
Цвет ЛРС определяют при дневном освещении. При этом отмечают цвет с поверхности, а также в изломе или на разрезе.
Запах ЛРС определяют при растирании или изломе, для твердых объектов делают соскоб скальпелем или растирают сырье в ступке. Методика определения запаха описана в 2.3.4 ГФ РБ II, т.1 (Приложение 2).
|
|
Вкус ЛРС определяют на последнем этапе анализа, когда выяснено, что анализируемое сырье не ядовито. Для этого, взяв в рот небольшие кусочки сырья, осторожно жуют их, не проглатывая, и, определив вкус, выплевывают и ополаскивают полость рта водой. Для ядовитых образцов вкус не определяют!
II. Микроскопический анализ цельного ЛРС
Микроскопический анализ ЛРС является одним из методов установления его подлинности.
Микроскопы
Микроскопы позволяют получать увеличенное изображение мелких объектов и необходимы для изучения анатомического строения растений. Наиболее широкое применение находят визуальные микроскопы, в которых изображение рассматривается непосредственно в микроскоп. Микроскоп состоит из трех основных частей: оптических приборов, осветительной системы и штатива (Рис. 1).
К оптическим приборам микроскопа относятся объективы и окуляры, которые участвуют в построении изображения и обеспечивают необходимое увеличение предмета; разрешающая способность микроскопа зависит исключительно от объектива; окуляр служит для дальнейшего увеличения полученного изображения.

Рис. 1. Микроскоп для морфологических исследований МИКМЕД-1 с бинокулярной насадкой и зеркалом в качестве осветителя: 1 – окуляры, 2 – бинокулярная насадка, 3 – револьверное устройство, 4 – объектив, 5 – предметный столик, 6 – конденсор, 7 – зеркало, 8 – рукоятка перемещения кронштейна конденсора, 9 – рукоятка тонкой фокусировки, 10 – рукоятка грубой фокусировки, 11 – тубусодержатель, 12 – винт для крепления насадки.
Объектив представляет собой систему оптических стекол, вставленных в металлическую оправу. Существует несколько категорий объективов. В биологической практике наиболее часто используют объективы-ахроматы, которые представляют собой системы, исправленные в отношении хроматической и сферической аберрации и дающие плоское изображение. Они пригодны для большинства работ как с окрашенными, так и с неокрашенными объектами, а также в микрофотографии. Объектив дает действительное, увеличенное, обратное изображение предмета. Для обозначения объективов введено стандартное обозначение, состоящее из цифр и букв, которые выгравированы на оправе объектива; первая цифра обозначает собственное увеличение объектива, вторая — нумерическую апертуру (апертура - характеристика оптического прибора, описывающая его способность собирать свет и противостоять дифракционному размытию деталей изображения); если на объективе указана еще третья цифра, то она обозначает толщину покровного стекла, на которую рассчитан объектив. Обычно объективы рассчитаны на покровное стекло толщиной 0,17 мм. Буквы обозначают тип оптической коррекции (ПЛАН — объективы-ахроматы с плоским полем (представляют собой сложные линзы, состоящие из рассеивающей и собирающей линз, чаще всего склеенных между собой оптическим клеем), АПО — объективы-апохроматы (подтип ахроматов)).
|
|
 Окуляр состоит из двух плоско-выпуклых линз, вставленных в металлическую оправу цилиндрической формы. Назначение окуляра – в дальнейшем увеличении того действительного изображения, которое получено от объектива; при этом получается прямое, увеличенное и мнимое воспроизведение того изображения, которое дает объектив. Поэтому в итоге изображение, получаемое в микроскопе, является обратным, мнимым и увеличенным.
Окуляр состоит из двух плоско-выпуклых линз, вставленных в металлическую оправу цилиндрической формы. Назначение окуляра – в дальнейшем увеличении того действительного изображения, которое получено от объектива; при этом получается прямое, увеличенное и мнимое воспроизведение того изображения, которое дает объектив. Поэтому в итоге изображение, получаемое в микроскопе, является обратным, мнимым и увеличенным.
Осветительная система микроскопа состоит из зеркала, диафрагмы и конденсора. Зеркало микроскопа имеет две поверхности – плоскую и вогнутую. Диафрагма пропускает определенный конус лучей, соответствующий апертуре объектива.Существуют пластинчатые, цилиндрические и ирисовые диафрагмы; наиболее распространены последние. Конденсор состоит из двух или трех линз. Назначение конденсора – обеспечить освещение объектива широко расходящимся пучком лучей, что дает возможность более полно использовать численную (нумерическую) апертуру оптически сильных систем.
Штатив служит основой для оптической и осветительной части микроскопа. Основные части штатива: основание (или башмак), тубусодержатель, тубус, снабженный револьвером, механизмы грубого и микрометрического движения тубуса, предметный столик.
Тубус служит для размещения объективов и окуляра. Револьвер имеет три или четыре гнезда для ввинчивания объективов, что позволяет при исследовании быстро переходить от одного увеличения к другому. Объективы центрированы с револьвером так, что при последовательном переходе от более слабого к более сильному объективу точка, находящаяся в центре поля зрения более слабого объектива, не должна выходить за пределы поля зрения. Механизмы передвижения тубуса служат для наведения на фокус. Грубая фокусировка осуществляется с помощью кремальеры. Более тонкая фокусировка достигается микрометрической установкой. Головка (барабан) микрометрической установки в некоторых микроскопах имеет шкалу, которая показывает высоту поднятия или глубину опускания тубуса, поэтому может быть использована для измерения толщины исследуемого объекта. Наиболее распространены монокулярные тубусы, выпускаются также бинокулярные тубусы, применение которых дает возможность производить наблюдение препарата двумя глазами и избежать преждевременного утомления глаз.
|
|
Предметный столик служит для размещения исследуемого объекта. Имеются столики неподвижные и вращающиеся, последние облегчают плавное передвижение объекта в горизонтальной плоскости. На предметный столик микроскопа может быть установлен специальный прибор для передвижения исследуемого объекта — препаратоводитель.
Правила пользования микроскопом:
♦ Микроскоп необходимо тщательно оберегать от пыли.
♦ Перед началом работы микроскоп помещают на рабочее место, для этого его берут за изогнутую часть штатива, держа в вертикальном положении, и осторожно ставят на рабочее место.
♦ Затем налаживают освещение препарата, используя вогнутое зеркало. Плоское зеркало используют при работе с объективами, требующими применения конденсора.
♦ Искать источник света надо с объективом слабого увеличения или совсем без объектива. Слишком яркого освещения следует избегать, так как оно может ослепить глаз и на некоторое время лишить его чувствительности. Интенсивность освещения можно ослабить с помощью матового стекла, которое накладывается на кольцо под конденсором.
♦ Следует приучить себя смотреть в окуляр микроскопа одним глазом, другой оставлять открытым. В противном случае глаза быстро устают. Удобнее смотреть в микроскоп левым глазом, а тетрадь для рисования помещать с правой стороны.
♦ Исследование препарата начинают со слабого (малого) увеличения. После изучения общего вида препарата переходят к сильному (большому) увеличению. Для этого, поместив в центр поля деталь, которую хотят рассмотреть при сильном увеличении, поворотом револьвера сменяют объектив. Объективы в микроскопе (кроме иммерсионного) подогнаны так, что при переходе от одного к другому не приходится пользоваться механизмом грубой фокусировки.
♦ Изучая препарат при большом увеличении, правую руку следует все время держать на рукоятке микрометрического винта, чтобы фокусировать необходимую часть поля зрения.
|
|
♦ Во время работы надо следить за чистотой объективов, не допускать попадания жидкости на линзу объектива. Окончив изучение препарата, необходимо поднять тубус на значительное расстояние, и только после этого снять препарат со столика.
Стереомикроскопы
Основным достоинством стереомикроскопа является то, что он позволяет видеть предметы объемными и дает прямое изображение. Стереомикроскоп позволяет наблюдать предметы как в проходящем свете (прозрачные объекты и срезы), так и в отраженном (непрозрачные объекты и поверхность сухих частей растения). Благодаря большому полю зрения (до 44 мм) и рабочему расстоянию (до 100 мм) стереомикроскопы удобны для препарирования исследуемых объектов. При исследовании ЛРС с помощью стереомикроскопа изучают различные трихомы (волоски, железки) на поверхности листьев и других частей растений, мелкие цветки, плоды, семена и др.
Лупа
Лупу чаще используют при макроскопическом анализе ЛРС, когда надо определить наличие и характер опушенности, наличие железок и т.п., а также при исследовании мелких объектов — семян, цветков, плодов сельдерейных и т.д. Лупа состоит из одной простой или сложной положительной (увеличивающей) линзы. Рассматриваемый предмет должен находиться в передней фокальной плоскости или несколько ближе.
Осветители
При работе с микроскопами препарат может быть освещен естественным светомили искусственным – с помощью осветителя. Наиболее простым является осветитель для проходящего света. Его устанавливают вместо зеркала под конденсором микроскопа. Источником света служит лампа накаливания, питающаяся непосредственно от электросети.
Микрометры
Для измерения различных деталей препарата под микроскопом (кристаллов, крахмальныхзерен, волосков, железок, пыльцы и др.) служит окулярный микрометр, который предварительно должен быть калиброван при помощи объективного микрометра.
Объективный микрометр представляет собой предметное стекло с нанесенной на него шкалой в 1 мм, разделенной на 100 частей. Таким образом, каждое деление такого микрометра равно 10 мкм. Окулярный микрометр представляет собой круглую стеклянную пластинку с делениями. Пластинку вкладывают в окуляр микроскопа. При калибровке деления окулярного микрометра совмещают с делениями объективного микрометра. Калибровка должна проводиться при том увеличении, при котором будут вести измерение.
Измерение анатомических элементов под микроскопом обычно ведется при большом увеличении. Элемент или деталь препарата, которая подлежит измерению, передвигают в центр поля зрения и совмещают со шкалой окулярного микрометра. Определяют, сколько делений шкалы укладывается на длине или ширине измеряемого элемента. Зная цену деления окулярного микрометра, выражают размеры элемента в микрометрах. Существуют и другие типы окулярных микрометров.
Бритва
Для получения срезов применяют обыкновенную остро отточенную бритву, которую держат правой рукой. Перед изготовлением срезов поверхность лезвия надо смочить водой, чтобы срезы не прилипали к бритве. Объект, с которого делают срезы, берут в левую руку, зажимая его между большим и указательным пальцами так, чтобы поверхность его лишь немного выступала над уровнем пальцев. Предварительно поверхность объекта выравнивают с помощью острого скальпеля или ножа. При изготовлении среза бритву ведут легким, скользящим движением наискось от верхушки лезвия. Каждый срез должен быть сделан одним движением; нельзя, делая срезы, «пилить», так как в этом случае срезы получаются неровными. Срезы не должны быть большими; чем меньше срез, тем легче сделать его тонким и ровным.
Срез через всю толщину корня или корневища делают редко, обычно достаточно срезать сравнительно узкую полоску, проходящую через наружные и внутренние ткани органа (по радиусу поверхности разреза). При этом тонкие и наиболее ровные срезы получаются, если срез начинают не от края объекта, а положив лезвие бритвы на поверхность разреза. Делают несколько срезов и для дальнейшего исследования под микроскопом выбирают лучшие.
Микротом
С помощью микротома получают одинаковые и очень тонкие срезы в виде непрерывного ряда. Существуют различные типы микротома, наиболее распространенным и универсальным является тип санных (или салазочных) микротомов.
Микроскопический анализ кор
Корой в фармацевтической практике называют наружную часть стволов, ветвей и корней деревьев и кустарников, расположенную к периферии от камбия.
Готовят срезы предварительно размягченного сырья. При определении обращают внимание на наружную кору, располагающуюся к периферии от окончания сердцевинных лучей и состоящую из первичной коры (если сохранилась) и перидермы, и на внутреннюю (флоэму), расположенную от камбия до окончания сердцевинных лучей. Также обращают внимание на толщину, окраску и характер пробки, наличие колленхимы, соотношение толщины первичной и вторичной коры, ширину сердцевинных лучей.
Диагностическими признаками коры являются механические элементы — лубяные волокна (стереиды) и каменистые клетки (склереиды), их количество, расположение и строение. Располагаются механические элементы одиночно или группами, рассеянно или поясами. Стенки лубяных волокон или каменистых клеток обычно сильно утолщены и лигнифицированы. Диагностическое значение имеют также включения оксалата кальция, млечники, клетки с эфирным маслом. Кристаллы оксалата кальция имеют разную форму (друзы и одиночные кристаллы). Одиночные кристаллы часто встречаются в отдельных клетках паренхимы или в клетках паренхимы, окружающих лубяные волокна, образуя кристаллоносную обкладку. Крахмальные зерна, встречающиеся в коре, мелкие и диагностического значения не имеют.
Методика приготовления микропрепаратов кор описана в статье «Макроскопический и микроскопический анализ лекарственного растительного сырья», 2.8.23, ГФ РБ II, т. 1 (Приложение 3).
Люминесцентная микроскопия
Метод люминесцентной микроскопии применяется для определения подлинности ЛРС. Преимуществом метода является возможность его применения для изучения сухого растительного материала, из которого готовят толстые срезы или препараты порошка, и рассматривают их в падающем свете, при освещении препарата сверху, через опак-иллюминатор или объектив.
Люминесцентная микроскопия выполняется с помощью люминесцентных микроскопов, снабженных специальными люминесцентными осветителями.
Методики приготовления микропрепаратов для люминесцентной микроскопии описаны в статье «Макроскопический и микроскопический анализ лекарственного растительного сырья», 2.8.23, ГФ РБ II, т. 1 (Приложение 3).
Алкалоиды.
Для обнаружения алкалоидов в растительном сырье чаще всего проводят общие реакции (реакции осаждения алкалоидов) и хроматографию. Для обнаружения какой-либо определенной группы алкалоидов проводят специфические цветные реакции, люминесцентный хроматографический анализ и используют другие методы.
Общие реакции на алкалоиды.
Они основаны на способности алкалоидов образовывать нерастворимые в воде соединения с солями тяжелых металлов, с комплексными йодидами, комплексными кислотами и другими соединениями кислотного характера. Эти реакции позволяют установить наличие алкалоидов даже при незначительном их содержании.
Реакции проводят с неочищенным извлечением из ЛРС. Обязательным условием является кислая среда (в щелочной среде осадки не образуются или же образуются за счет разрушения реактивов). Алкалоиды из ЛРС извлекают 1-5% раствором хлористоводородной кислоты или серной кислоты. Реакции проводят с капельно-минимальным количеством реактивов (!): избыток их приводит к растворению осадка.
При добавлении соответствующих реактивов в присутствии алкалоидов тотчас или через некоторое время образуется осадок. Обилие осадка зависит как от количественного содержания алкалоидов, так и от чувствительности их к реактиву. Однако, следует учитывать, что с общими реактивами образуют осадки еще и некоторые другие органические соединения, которые могут содержаться в неочищенных извлечениях (холин, бетаин, белки, продукты их разложения и др.) Поэтому, чтобы получить более достоверные результаты, общие реакции проводят еще и с очищенными извлечениями.
В методическом плане осадочные реакции удобнее всего осуществлять на предметном стекле.
В методологическом отношении осадочные реакции имеют так называемое «отрицательное значение», т.е. позволяют делать выводы об отсутствии алкалоидов в сырье в случае отрицательной реакции с несколькими реактивами.
Наиболее часто используются следующие реактивы:
 ). С большинством алкалоидов в слабокислых растворах эти реактивы образуют бурые осадки.
). С большинством алкалоидов в слабокислых растворах эти реактивы образуют бурые осадки. ). Многие алкалоиды в кислых растворах дают оранжево-красные или кирпично-красные осадки.
). Многие алкалоиды в кислых растворах дают оранжево-красные или кирпично-красные осадки.
Специфические реакции на алкалоиды.
Если необходимо установить присутствие определенного алкалоида или определенной группы алкалоидов в растительном сырье, проводят специфические реакции (цветные) и микрокристаллоскопические реакции.
Специфические реакции проводят с индивидуальными алкалоидами или с очищенной суммой алкалоидов.
Алкалоиды из ЛРС извлекают 1-5% раствором какой-либо кислоты (хлористоводородной, серной и др.). Кислотное извлечение подщелачивают раствором аммиака (или натрия гидроксида), а затем алкалоиды извлекают органическими растворителями (хлороформом, дихлорэтаном и др.). Органический растворитель отгоняют или выпаривают в фарфоровой чашке и с остатком проводят соответствующие реакции. В качестве специфических реактивов на алкалоиды при проведении реакций окрашивания довольно часто используют:
- серную кислоту,
- азотную кислоту,
- серную кислоту с формалином (реактив Марки),
- серную кислоту с молибдатом аммония (реактив Фреде) и др.
Кроме того, алкалоиды, выделенные из ЛРС, обнаруживают на хроматограммах после проявления реактивом, дающим с алкалоидами окрашивание. В качестве проявителя, как правило, используют реактив Драгендорфа с добавлением аскорбиновой кислоты. При опрыскивании этим раствором хроматограмм алкалоиды на них проявляются в виде серо-бурых пятен. При проявлении хроматограмм спиртовыми растворами фосфорновольфрамовой (фосфорномолибденовой) кислоты либо обработкой парами йода (J2) алкалоиды на хроматограммах проявляются в виде бледно-желтых или бурых пятен.
VIII. Общая зола
В ЛРС определяют два вида золы: золу общую и золу, нерастворимую в 10% растворе хлористоводородной кислоты. Оба эти показателя регламентируются по верхнему пределу, т.е. «не более … (в процентах)».
Общая зола – несгораемый остаток, полученный при сжигании ЛРС при 600˚С до постоянной массы. Представляет собой сумму минеральных веществ, свойственных растению, и посторонних минеральных примесей (песок, земля, мелкие камешки), попавших в сырье при сборе и сушке.
Методика определения общей золы описана в ГФ РБ II, т. 1, 2.4.16.
Фарфоровый, кварцевый или платиновый тигель нагревают при красном калении (около 500˚С) в течение 30 минут, охлаждают в эксикаторе и взвешивают. Если нет других указаний в частной статье, 1,00 г измельченного в порошок ЛРС помещают в тигель и равномерно распределяют по дну тигля. Высушивают при температуре от 100°С до 105°С в течение 1 ч и затем сжигают до постоянной массы в муфельной печи при температуре (600±25)˚С, выдерживая тигель в эксикаторе после каждого сжигания. Во время проведения анализа в тигле не должно появляться пламя. Если после длительного сжигания зола все еще содержит темные частицы, содержимое тигля количественно переносят горячей водой на беззольный фильтр и сжигают остаток на фильтре вместе с фильтровальной бумагой. Фильтрат объединяют с золой, осторожно выпаривают до сухого остатка и сжигают до постоянной массы.
Содержание общей золы в ЛРС, %, рассчитывают по формуле:
 ,
,
где m  - масса навески ЛРС, г,
- масса навески ЛРС, г,
m 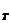 - масса тигля, г,
- масса тигля, г,
m  - масса тигля с общей золой после прокаливания, г,
- масса тигля с общей золой после прокаливания, г,
W – потеря в массе при высушивании ЛРС,%.
Работа на занятии
Объекты для лабораторного изучения: образцы цельного лекарственного растительного сырья различных морфологических групп.
ЗАДАНИЕ 1. Получить образец ЛРС морфологической группы «листья». Заполнить в рабочей тетради таблицу:
| Наименование ЛРС | Описание 1 | Описание 2 |
Описать сырье по схеме (см. Приложение 1) в графе «Описание 1» таблицы. Сравнить свое описание с описанием внешних признаков данного сырья в НД (заполнить графу «Описание 2»). Сделать вывод о правильности, лаконичности и точности сделанного Вами описания, дать заключение о подлинности и качестве ЛРС по внешним признакам.
ЗАДАНИЕ 2. Получить образец ЛРС морфологической группы «травы». Заполнить в рабочей тетради таблицу:
| Наименование ЛРС | Описание 1 | Описание 2 |
Описать сырье по схеме (см. Приложение 1) в графе «Описание 1» таблицы. Сравнить свое описание с описанием внешних признаков данного сырья в НД (заполнить графу «Описание 2»). Дать заключение о подлинности и качестве ЛРС по внешним признакам.
ЗАДАНИЕ 3. Получить образец ЛРС морфологической группы «плоды» или «семена». Заполнить в рабочей тетради таблицу:
| Наименование ЛРС | Описание 1 | Описание 2 |
Описать сырье по схеме (см. Приложение 1) в графе «Описание 1» таблицы. Сравнить свое описание с описанием внешних признаков данного сырья в НД (заполнить графу «Описание 2»). Дать заключение о подлинности и качестве ЛРС по внешним признакам.
ЗАДАНИЕ 4. Получить образец ЛРС морфологической группы «цветки». Заполнить в рабочей тетради таблицу:
| Наименование ЛРС | Описание 1 | Описание 2 |
Описать сырье по схеме (см. Приложение 1) в графе «Описание 1» таблицы. Сравнить свое описание с описанием внешних признаков данного сырья в НД (заполнить графу «Описание 2»). Дать заключение о подлинности и качестве ЛРС по внешним признакам.
ЗАДАНИЕ 5. Получить образец листьев мяты перечной:
1) приготовить поверхностный препарат;
2) изучить микроскопические признаки, принимая во внимание описание, приведенное в НД, и рис. I;
3) зарисовать, указать основные диагностические признаки на рисунке.

Рис. I. Препарат листа мяты перечной (×280). А – эпидермис верхней стороны листа, Б – эпидермис нижней стороны листа: 1 – железки, 2 – устьице, 3 – головчатые волоски, 4 – складчатость кутикулы, 5 – простой волосок.
Приложение 1
Схема анализа листьев
Листья - Folia – высушенные или свежие листья, или отдельные листочки сложного листа.
1. Тип листа (простой или сложный).
2. Черешковый или сидячий.
3. Форма (линейная, ланцетная и т.д.).
4. Размеры листа и листочков, черешка.
5. Край листа.
6. Характер жилкования, цвет жилок.
7. Опушение.
8. Цвет верхней и нижней сторон.
9. Запах.
10. Вкус.
Схема анализа цветков
Цветки – Flores – высушенные отдельные цветки или соцветия, а также отдельные их части.
1. Тип соцветия или одиночные цветки.
2. Форма цветка.
3. Размеры соцветия или цветка.
4. Отсутствие или наличие цветоноса (форма, размеры).
5. Опушение.
6. Цвет.
7. Запах.
8. Вкус.
Схема анализа плодов
Плоды – Fructus – простые и сложные, а также ложные плоды, соплодия и их части.
1. Тип плодов (сухой, сочный).
2. Форма.
3. Размеры (длина, толщина, диаметр).
4. Характер околоплодника.
5. Строение околоплодника.
6. Количество косточек или семян, их форма и строение, структура поверхности.
7. Цвет.
8. Запах.
9. Вкус.
Схема анализа семян
Семена – Seminа – цельные семена и отдельные семядоли.
1. Форма.
2. Размеры.
3. Характер поверхности.
4. Семенное ядро, размеры и форма.
5. Цвет.
6. Запах.
7. Вкус.
Схема анализа почек
Почки – Gemmae – зачаточный, еще не развившийся побег, защищенный чешуйками.
1. Одиночные, в мутовках, группами.
2. Форма.
3. Характер сложения чешуек.
4. Размеры.
5. Поверхность.
6. Цвет.
7. Запах.
8. Вкус.
Схема анализа кор
Кора – Cortex – высушенная наружная часть стволов, ветвей, корней деревьев и кустарников, расположенная к периферии от камбия.
1. Форма.
2. Размеры (толщина).
3. Характер наружной и внутренней поверхностей. Цвет пробки, форма чечевичек.
4. Характер излома.
5. Запах.
6. Вкус.
Приложение 3
Приложение 4
Приложение 5
Фармакогнозия
Методические указания
Занятие №2. ФАРМАКОГНОСТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ
Фармакопейные методы определения подлинности цельного ЛРС
Фармакопейные методы определения числовых показателей и примесей ЛРС
Список условных сокращений
БАВ – биологически активное вещество
ГФ РБ – Государственная фармакопея Республики Беларусь. В трех томах.
ЛР – лекарственное растение
ЛРС – лекарственное растительное сырье (или лекарственное сырье растительного происхождения)
ЛС – лекарственное средство
НД – нормативный документ, нормативная документация
ПФ – подвижная фаза
ТСХ – тонкослойная хроматография
УФ - ультрафиолетовый
ФС – фармакопейная статья
Учебные цели
Теоретические основы темы
Фармакогностический анализ – это комплекс методов анализа ЛРС, сырья животного происхождения и их продуктов, устанавливающий его подлинность и доброкачественность по всем параметрам НД.
Подлинность (идентичность) – соответствие исследуемого образца тому наименованию, под которым оно поступило для анализа. Подлинность исследуемого ЛРС устанавливается путем: 1) макроскопического анализа; 2) микроскопического анализа; 3) качественного химического анализа (качественные реакции, в т.ч. использование явления люминесценции); 4) тонкослойной хроматографии.
Доброкачественность – соответствие ЛРС требованиям всех разделов НД (содержание примесей, степень измельчения (для цельного ЛРС), потеря в массе при высушивании, содержание золы, действующих веществ и др.).
|
|
|

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!