Цель работы: научится определять кинетические характеристики различных реакций.
Вопросы для подготовки к занятию:
- понятие константы скорости химической реакции
- кинетическая классификация химических реакций
- дифференциальные и интегральные уравнения для константы скорости реакции 1 и 2 порядка
- период полураспада
Ход работы
I. Теоретическая часть
Основные понятия и расчетные формулы
1. Реакции первого порядка (Схема реакции: А  …)
…)
k1  (1)
(1)
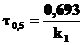 (2)
(2)
где:
k1- константа скорости реакции первого порядка, 1/с
 -время реакции, с
-время реакции, с
СО, С  - начальные и конечные концентрации реагирующих веществ, моль/л
- начальные и конечные концентрации реагирующих веществ, моль/л
 - период полураспада, с
- период полураспада, с
2. Реакции второго порядка (Схемы реакции: 2А →… или А + В → …)
k2=  (3)
(3)
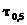 =
=  (4)
(4)
где:
k2-const скорости реакции второго порядка, л/моль•с
! Данные формулы можно применять, если количества исходных веществ одинаковы.
II. Практическая часть.
II.1 Примеры решения задач
1. Реакция разложения диоксида углерода первого порядка. Найти константу скорости реакции и период полураспада, если за 20 минут разлагается 90% исходного количества диоксида углерода.

 Дано: СИ Решение:
Дано: СИ Решение:
 =20 мин. 1200с 1)Найти конечную концентрацию реагирующих веществ: С
=20 мин. 1200с 1)Найти конечную концентрацию реагирующих веществ: С  -?
-?
∆С=90%С0 СО - 100%
С  - (100%-∆С)=10%
- (100%-∆С)=10%
 Найти: С
Найти: С  =
=  = 0,1 СО
= 0,1 СО
k1,  -? 2)Найти константу скорости реакции по соответствующей
-? 2)Найти константу скорости реакции по соответствующей
 формуле (для реакции 1 или 2 порядка): k1-?
формуле (для реакции 1 или 2 порядка): k1-?
k1 
 1 =
1 =  ==1, 92•10-3•
==1, 92•10-3•  10-3 •
10-3 •  •10-3(1/c)
•10-3(1/c)
3)Найти период полураспада по соответствующей формуле (для реакции 1 или 2 порядка):  -?
-?

 =
=  =359(с)
=359(с)  6(мин)
6(мин)
Ответ:  1=
1=  •10-3(1/c);
•10-3(1/c);  =6(мин)
=6(мин)
2. Реакция гидратация этилена второго порядка. Исходные вещества взяты в равных количествах с начальной концентрацией равной 0,4 моль/л. Найти константу скорости реакции и период полураспада, если за 30 минут реагирует 80% исходного этилена.
Дано СИ Решение
СО=0,4 моль/л 1) Найти конечную концентрацию реагирующих веществ: С  -
-
 = 30 мин 1800с СО-100%
= 30 мин 1800с СО-100%
∆С=80% СО С  -20%
-20%
 Найти: С
Найти: С  =
=  =0,2•0,4=0,008 моль/л
=0,2•0,4=0,008 моль/л
 k2;
k2;  -? 2)Найти скорости реакции по соответствующей формуле (для реакции 1 или 2 порядка): k2-?
-? 2)Найти скорости реакции по соответствующей формуле (для реакции 1 или 2 порядка): k2-?
k2= 
k2=  = 0,056л/моль•с
= 0,056л/моль•с
3)Найти период полураспада по соответствующей формуле (для реакции 1 или 2 порядка):
 -?
-?
 =
=  =
=  = 446(с)
= 446(с)
Ответ:  = 446(с); k2=0,056 л/моль•с
= 446(с); k2=0,056 л/моль•с
3. Реакция дегидрирование бутана первого порядка. Найти константу скорости реакции, если за 50 минут реагирует 50% исходного вещества. Найти время, за которое реагирует 80% бутана.
Дано: СИ Решение:
 =50 мин. 3000с 1)Найти константу скорости реакции по периоду полураспада,
=50 мин. 3000с 1)Найти константу скорости реакции по периоду полураспада,
 ∆С=80% СО используя необходимую формулу (для реакции 1 или 2
∆С=80% СО используя необходимую формулу (для реакции 1 или 2
Найти: порядка): k1-?

 1;
1;  -?
-? 

k1=  (1/с)
(1/с)
2)Найти конечные концентрации реагирующих веществ: С  -?
-?
СО - 100%
С  - 20%
- 20%
С  =
= 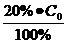 = 0,2 СО
= 0,2 СО
3)Найти время реакции по соответствующей формуле (для 1 или 2 порядка):  -?
-?
k1 
 (с)
(с)
Ответ:  =7000(с); k1==
=7000(с); k1==  (1/с)
(1/с)
II.2 Примеры для самостоятельной работы:
1. Разложение этана реакция первого порядка. Найти константу скорости реакции и период полураспада, если за 40 минут реагирует 80% этана.
2. Реакция окисления эфира второго порядка. Начальная концентрации исходных веществ равны и составляют 0,005 моль/л. Найти константы скорости реакции, если за 30 минут реагирует 50% исходного эфира. Какое время необходимо для распада 90% эфира?
3. Окисление эфира – реакция второго порядка. Концентрации исходных веществ равны и в начале реакции составляли 0,025моль/л. Константа скорости реакции составляет 2,36. Найти за какое время прореагирует 50% и 80% эфира.
4. *.Найти константу скорости реакции и период полураспада для реакции разложения бромэтана на этилен и бромоводород при 200 С0. Найти начальную скорость реакции, если исходная концентрация бромэтана равна 2моль/л. Для решения используйте данные Приложения, Таблица 6.
Оформление отчета:
Отчет должен содержать:
1. Тему и цель работы.
2. Основные расчетные формулы (1-4).
3. Примеры расчетных задач (1-3).
4. Выполненное задание для самостоятельной работы (задачи со знаком *выполняются по желанию на дополнительную оценку).
Практическое занятие №12



 …)
…) (1)
(1)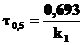 (2)
(2) -время реакции, с
-время реакции, с - период полураспада, с
- период полураспада, с (3)
(3)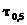 =
=  (4)
(4)
 Найти: С
Найти: С  = 0,1 СО
= 0,1 СО формуле (для реакции 1 или 2 порядка): k1-?
формуле (для реакции 1 или 2 порядка): k1-?
 1 =
1 =  ==1, 92•10-3•
==1, 92•10-3•  10-3 •
10-3 •  •10-3(1/c)
•10-3(1/c)
 =359(с)
=359(с)  6(мин)
6(мин) •10-3(1/c);
•10-3(1/c); 
 Найти: С
Найти: С  =0,2•0,4=0,008 моль/л
=0,2•0,4=0,008 моль/л k2;
k2; 
 = 0,056л/моль•с
= 0,056л/моль•с =
=  = 446(с)
= 446(с)
 ∆С=80% СО используя необходимую формулу (для реакции 1 или 2
∆С=80% СО используя необходимую формулу (для реакции 1 или 2

 (1/с)
(1/с)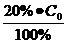 = 0,2 СО
= 0,2 СО
 (с)
(с) (1/с)
(1/с)


