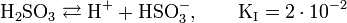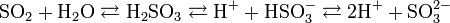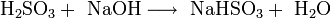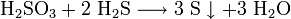Структура формулы серной кислоты:
Получение: основным методом производства серной кислоты из SO3 является контактный метод. Вначале получают диоксид серы SO2 (сжигание серы и др.). Самый распространенный способ получения – обжиг серного колчедана FeS2, затем диоксид серы SO2 окисляют в триоксид серы SO3 контактным методом. Полученный три-оксид серы SO3 направляют на стадию поглощения, которую проводят концентрированной серной кислотой. Раствор SO3 в H2SO4 называется олеум. Контактным методом получают 92,5 %-ную серную кислоту. При нитрозном методе H2SO4 получают, окисляя SO2 в сернокислотном растворе, для этого в качестве катализатора используют смесь оксидов азота NO и NO2. Нитрозным методом получают 75 %-ную серную кислоту.
Чтобы приготовить раствор серной кислоты, ее необходимо выливать в воду тонкой струйкой, сильно перемешивая, при этом в воде образуются гидраты и происходит выделение теплоты.
Физические свойства: Серная кислота – бесцветная вязкая жидкость, имеющая температуру плавления 10 °C, температура кипения 296 °C (с разложением на H2O и SO3). Серная кислота – сильная кислота. Концентрированная серная кислота в большом количестве поглощает пары воды, поэтому ее используют для осушения газов.
Химические свойства.
1. Концентрированная серная кислота является сильным окислителем. Окислительно-восстановительные реакции требуют нагревания, а продуктом реакции в основном является SO2.
2. С металлами вступает в реакцию по-разному в зависимости от концентрации. Разбавленная серная кислота взаимодействует со всеми металлами, стоящими в ряду напряжений до водорода. Концентрированная серная кислота окисляет все металлы, стоящие в ряду напряжений, и серебро в том числе.
3. Разбавленная серная кислота взаимодействует с основаниями, основными и амфотерными оксидами, солями.
Серная кислота образует два вида солей: средние (сульфаты) и кислые (гидросульфаты).
Применение: серная кислота относится к главным продуктам химической промышленности. Ее используют для изготовления фосфорных и азотных удобрений, искусственных волокон, моющих средств, взрывчатых веществ, лекарственных препаратов. С ее помощью получают другие кислоты, сульфаты, очищают нефтепродукты, применяют как электролит в свинцовых аккумуляторах, подготавливают поверхность металлов для гальванических покрытий.
Серную кислоту применяют:
§ в производстве минеральных удобрений;
§ как электролит в свинцовых аккумуляторах;
§ для получения различных минеральных кислот и солей;
§ в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
§ в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
§ в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
§ в промышленном органическом синтезе в реакциях:
§ дегидратации (получение диэтилового эфира, сложных эфиров);
§ гидратации (этанол из этилена);
§ сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
§ алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Серни́стая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Химическая формула  .
.
Химические свойства
Кислота средней силы:
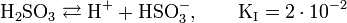

Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
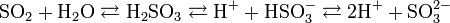
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
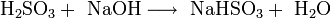
и средние — сульфиты (в избытке щёлочи):

Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:

При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
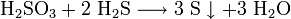
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:

слабая двухосновная кислота, отвечающая степени окисления серы +4
Применение
Сернистая кислота и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей. Гидросульфит кальция (сульфитный щелок, Са(HSO3)2) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).



 .
.