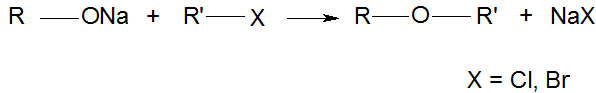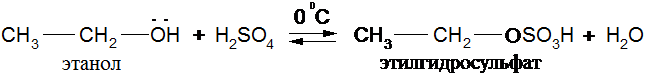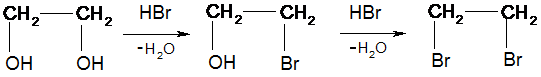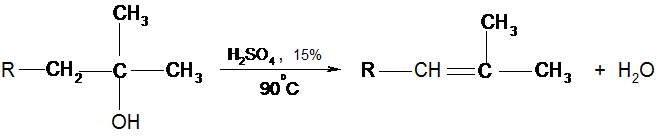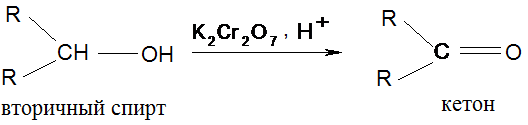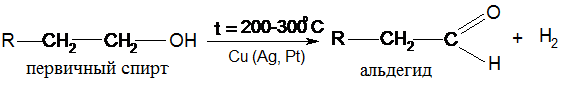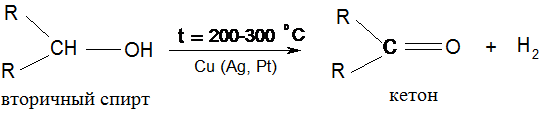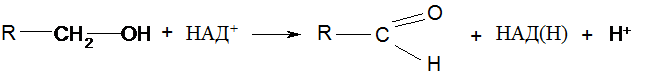1. О – алкилирование (образование простых эфиров):
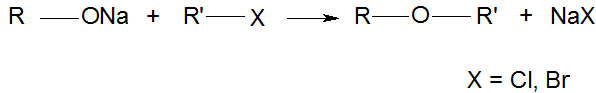
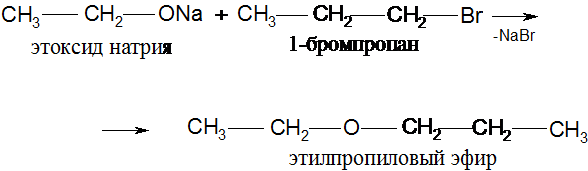
2. О-ацилирование (образование сложных эфиров).
С неорганическими кислотами без осложнения реагируют только первичные спирты:
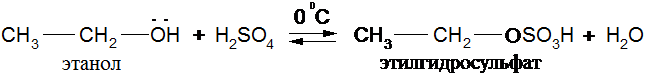
Вторичные и третичные спирты при нагревании с Н2SО4 дегидратируются.
Образование эфиров азотной кислоты:

Тринитрат глицерина используется в производстве динамита; В виде таблеток при стенокардии.
С органическими кислотами и их производными:
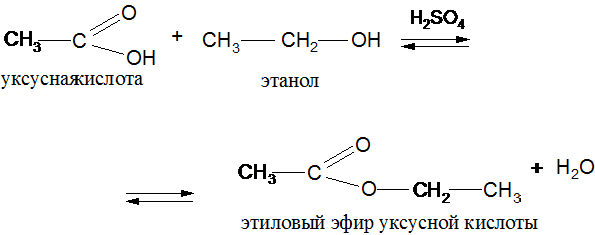
ІІІ. Реакции с участием электрофильного центра.
В рез-те происходит разрыв связи С-О и замещение ОН-группы.
Один из способов замещения ОН –гр. на галоген является реакция спиртов с галогенводородами

Условия реакции зависят от строения спирта и природы галогенводорода.
Реакционная способность галогенводородов падает в последовательности
HI > HBr > HCl,
Что связано с уменьшением силы кислоты.
Наиболее активны в этой реакции третичные спирты, а также спирты аллильного и бензильного типа.
С увеличением у/в радикала реакционная способность спиртов каждого типа понижается.
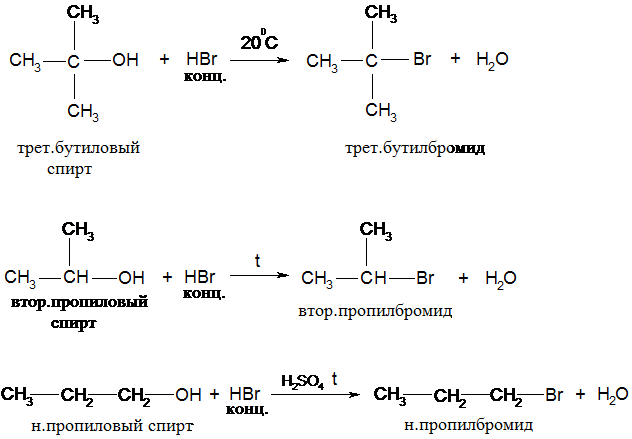
НСl – кислота легко реагирует при комн. темп-ре только с третичными спиртами; вторичные и третичные спирты – использование катализатора – ZnCl2, темп-ра – 1500С.
Первичные спирты реагируют по механизму SN2, третичные - SN1; вторичные - SN2 и SN1.
Более удобным для синтеза галогенпроизводных из спиртов является использование галогенидов фосфора:

Более активен РСl5.
Аналогично протекают реакции у многоатомных спиртов
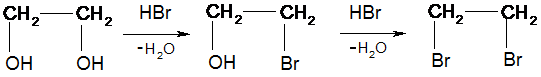
ІV. Реакции, с участием СН – кислотного центра (элиминирование).
Реакции отщепления воды от спиртов протекают в присутствии кислот или над катализаторами при повышенной температуре.
Легкость элиминирования возрастает при переходе от первичных к третичным спиртам.
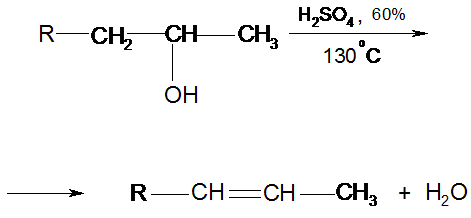
Отщепление воды протекает согласно эмпирическому правилу Зайцева (предпочтительно водород отщепляется от наименее гидрогенизированного β-углеродного атома).
1. Дегидратация первичных спиртов протекает в жестких условиях:

2. Дегидратация вторичных спиртов:
3. Дегидратация третичных спиртов:
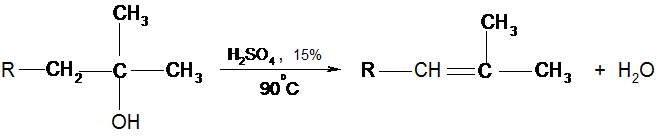
V. Окисление (окислители – КМnО4, К2Сr2О7 в кислой среде)
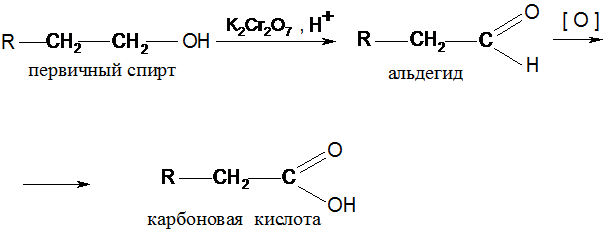
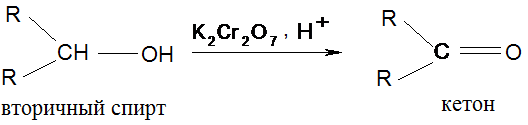
Окисление третичных спиртов требует более жестких условий, они устойчивы к окислению в нейтральной и щелочной средах.
Окисление полиолов явл-ся многофакторным процессом и редко приводит к индивидуальным продуктам.
Так, окисление азотной кислотой или СrО3 этиленгликоля протекает через стадии:
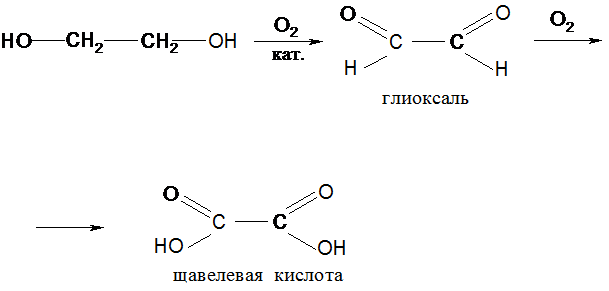
VІ. Дегидрирование спиртов:
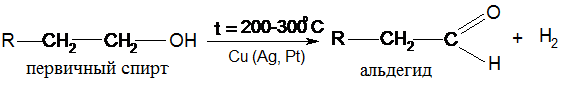
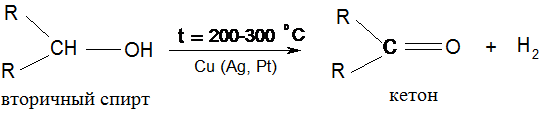
Третичные спирты не дегидрируются. В организме дегидрирование спиртов происходит под действием дегидрогеназ с соответств. коферментами, но свободный водород при этом не выделяется
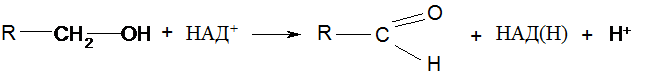
Применение:
Спирты производятся в большом количестве и используются в качестве полупродуктов для синтеза различных орг. соединений.