

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
 Чтобы понять как происходит переход твёрдой фазы в жидкую, а затем в газообразную при нагревании при постоянном давлении, рассмотрим поведение
Чтобы понять как происходит переход твёрдой фазы в жидкую, а затем в газообразную при нагревании при постоянном давлении, рассмотрим поведение  при P=const для различных фаз (см. рис.)
при P=const для различных фаз (см. рис.)
Как уже указывалось, устойчивой является фаза с самым низким химическим потенциалом.
Если 2 или большее число фаз имеют одинаковый µ, то они сосуществуют в положении равновесия: это, например, Ткип и Тпл. Ниже Тпл самый низкий потенциал µ у твёрдой фазы и поэтому она устойчива (*). Выше точки кипения самый низкий µ у газовой фазы (**), устойчивой в этих условиях. Между Ткип и Тпл устойчивой является жидкая фаза (***). Из рисунка видно, что фазовые превращения происходят не постепенно, а сразу и пока Т не достигла точки перехода, ни что на графике не указывает на существенные изменения в системе.
Наклон линий выражается:
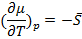
(3.4)
S вещества больше нуля, поэтому наклон отрицателен. Поскольку  , следовательно графики должны иметь именно тот вид, как показан на рисунке.
, следовательно графики должны иметь именно тот вид, как показан на рисунке.
При более низком давлении линии, выражающие зависимости µ(Т) оказываются смещёнными.
Влияние давления на химический потенциал чистого вещества при Т = const выражается

 всегда, значит µ уменьшается всегда при уменьшении P при постоянной температуре.
всегда, значит µ уменьшается всегда при уменьшении P при постоянной температуре.
Известно что  => этот эффект снижения µ для газа значительно больше, чем для жидкости или твёрдого тела.
=> этот эффект снижения µ для газа значительно больше, чем для жидкости или твёрдого тела.
Можно ожидать, что уменьшение давления понизит точку кипения значительно больше, чем понизит точку плавления, т.к.  , а
, а  .
.
В результате снижается диапазон температур, в котором жидкость является устойчивой фазой.
 Очевидно, что при достаточно низком давлении кривая µ для газа пересечёт кривую µ для твёрдого тела ниже той температуры, где µтв.т = µж и µтв.т= µгаз.
Очевидно, что при достаточно низком давлении кривая µ для газа пересечёт кривую µ для твёрдого тела ниже той температуры, где µтв.т = µж и µтв.т= µгаз.
|
|
Это означает, что при такой температуре твёрдое тело не плавиться а возгоняться (пример - сухой лёд).
В пределе при определении p кривая µ для твёрдого тела, жидкости и пара пересекутся в одной точке. Сочетание T и P, при котором сосуществуют 3 фазы, называется тройной точкой.
 3.6 Фазовые переходы в однокомпонентной системе.
3.6 Фазовые переходы в однокомпонентной системе.
Согласно критериям равновесия выраженным через интенсивные величины 3.2 при равновесии химические потенциалы компонента во всех фазах одинаковы, т.е. для однокомпонентной системы µα= µβ. Пусть α, β - равновесные фазы, это соответствует набору µ(Т) кривых при любом постоянном давлении.
Или
µα(Т,P)= µβ(T,P)
Это есть уравнение для функциональной зависимости P=f(T).
Состояние однокомпонентной системы изображается в координатах в виде фазовой диаграммы. Приходим к фазовой диаграмме. Решение уравнений даёт точки на кривых 1, 2, 3 рисунка. Это линии равновесия, вдоль которых сосуществуют 2 фазы.
1 - кривая сублимации (возгонки) равновесие твёрдой и газообразной фаз.
2 - кривая испарения, (оканчивается в критической точке) равновесие жидкой и газовой фаз (насыщенный пар).
3 - кривая плавления (равновесие твёрдоё и жидкой фаз).
Каждая кривая равновесия разделяет две смежные однофазные области, в которых система бивариантна. Изменение её состояния, происходящее вдоль линии, которая пересекает кривую равновесия, соответствует фазовому превращению - это фазовый переход первого рода.
Покажем, что фазовые переходы первого рода соответствуют превращениям вещества типа жидкость-газ, твердое тело - жидкость и т.д., всегда сопровождаются тепловым эффектом с изменением мольного объёма.
Пусть P=const.
Изобразим температурную зависимость химических потенциалов одного и того же вещества, находящегося в двух фазах α и β при постоянном давлении.
Учтём реальныё ход зависимости µ(Т) и 
 Точка пересечения µ потенциалов даёт Т фазового перехода, при которой в соответствии с µα(Т,P)= µβ(T,P) две фазы α и β находятся при P=const.
Точка пересечения µ потенциалов даёт Т фазового перехода, при которой в соответствии с µα(Т,P)= µβ(T,P) две фазы α и β находятся при P=const.
|
|
Если изменяется P, то температура Тф.п. изменяется по кривым 1, 2, 3 диаграммы P-T.
При Т≠ Тф.п., устойчивой является та фаза, которая имеет наименьший химический потенциал.
В однокомпонентной системе n=const, что обеспечивает минимальность свободной энергии Гиббса G=µ*n.
Фаза α существует при Т< Тф.п. - низкотемпературная фаза.
Фаза β существует при Т> Тф.п. - высокотемпературная фаза.
Результирующий ход µ описывается нижними частями кривых µ(T).
В точке фазового перехода имеется излом хода µ(T).
Причём

или
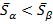
Рассмотрим увеличение температуры:
Фазовый переход  , который возникает при увеличении температуры и сопротивляется изменениям мольной энтропии скачком на величину
, который возникает при увеличении температуры и сопротивляется изменениям мольной энтропии скачком на величину  .
.
Так как переход происходит равновесным образом, то есть s w:val="24"/><w:lang w:fareast="RU"/></w:rPr><m:t>S</m:t></m:r></m:e></m:acc></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></wx:sect></w:body></w:wordDocument>">  =>
=> 
И изменение энтальпии

(3.5)
То есть появляется в виде поглощаемой теплоты называется скрытая теплота фазового перехода.
Термин означает, что поглощение тепла не приводит к изменению температуры системы. Куда оно расходуется? Оно расходуется на перестройку структуры вещества при Тф.п.=const.
Очевидно, что при уменьшении температуры:
для обратного перехода  при понижении температуры мы имеем
при понижении температуры мы имеем 
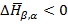 теплота выделяется.
теплота выделяется.
Таким образом имеем скачок энтальпии и энтропии при Тплавлении-кристализации(аналогично Ткип).
Пусть теперь зафиксируем µ(P) при этом  , наклон >0. Тогда в (.) фазового перехода Тф.п. µα(P)= µβ(P),
, наклон >0. Тогда в (.) фазового перехода Тф.п. µα(P)= µβ(P),
при этом:

или
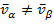
Таким образом, фазовый переход  всегда сопровождается изменением мольного объёма на величину
всегда сопровождается изменением мольного объёма на величину

(3.5')
Для процессов испарения и сублимации, конечное состояние вещества газообразное, тогда

Значит всегда 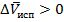 .
.
Определение
Фазовый переход первого рода характеризуется скачком первой производной µ по T и P.
Наряду с этим в природе наблюдаются физические ситуации, когда в точке фазового перехода µ пересекаются с одновременным касанием. Это означает (обеспечивает) непрерывность первых производных. при этом вторые частные производные могут меняться скачком. Это фазовый переход второго рода.
|
|
В силу отсутствия скачка первых производных


(3.6)
 При этом физические величины, выражающиеся через вторые частные производные претерпевают резкие изменения:
При этом физические величины, выражающиеся через вторые частные производные претерпевают резкие изменения:
Изобарный коэффициент теплового расширения

(3.7)
изотермическая сжимаемость

(3.7)'
изобарная теплоёмкость

(3.7)''
Фазовые переходы второго рода наблюдаются, как правило, в твёрдой фазе и связанны с изменением симметрии твёрдого тела:
ферромагнетик - парамагнетик
сегнетоэлектрик - параэлектрик.
3.7 Уравнение Клапейрона
(применяем к фазовым переходам первого рода)
µα= µβ
Когда две фазы чистого вещества находятся в равновесии их µ одинаковы при данных T и P const.
Пусть P=const, T меняется или при T=const, P меняется, то одна из фаз исчезнет (например, жидкая фаза при уменьшении P).
Пусть P, T изменяются так, что µα= µβ, тогда существуют обе фазы.
Клапейрон вывел уравнение для  .
.
Пусть α, β - фазы, находящиеся в равновесии =>
µα= µβ или  (парциальные мольные пробарные потенциалы)
(парциальные мольные пробарные потенциалы)
(3.7)

Если P,T изменяются так, что равновесие сохраняется => скорости изменения
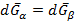
Так как G(P,T) полный дифференциал, перепишем:


или
 - ур-е Клапейрона
- ур-е Клапейрона
(3.8)
Это уравнение можно применять к испарению, возгонке, плавлению или взаимному превращению 2 твёрдых фаз чистого вещества (полиморфизм).
При данной температуре существует соотношение:

т.к. количество теплоты, необходимое для испарения данного количества твёрдого вещества есть const независимо от того как проводится процесс непосредственно или нет.
[H]=[PΔV]
Уравнение Клазиуса - Клапейрона
Клазиус упростил уравнение Клайперона применив его к испарению и возгонке, предложив
1) пар - идеальный газ.
2)  .
.

(3.9)
Этим уравнением удобно пользоваться, если изменения T и P малы.
Можно внести поправку в Tкип при колебаниях Pатм.

Преобразуем уравнение (3.9), поделив на Р:

Пусть 


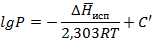
Таким образом, зависимость lgP(1/T) линейная, что подтверждается экспериментально для испарения и возгонки водяного пара.
В широком диапазоне Т наблюдаются отклонения.
|
|
1) результаты расчёта не более точны, чем предположение об идеальном газе и используемого уравнения 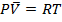 .
.
2) 
По этому уравнению можно расчитать теплоту испарения или возгонки.
Мольная энтропия испарения в стационарной точке (Ткип при 1 атм) для многих жидкостей постоянна 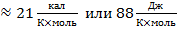
 - уравнение Трутона
- уравнение Трутона
(3.10)
Оно полезно для оценки мольной теплоты испарения жидкости с известной температурой кипения.
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!