

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
Топ:
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Теперь обратимся к диаграмме PV, являющейся проекцией трёхмерной диаграммы для воды на плоскости P-V при любой температуре.
 При достаточно низких температурах любой газ можно превратить в жидкость, приложив внешнее давление:
При достаточно низких температурах любой газ можно превратить в жидкость, приложив внешнее давление:  , молекулы сближаются, силы притяжения достаточны, чтобы вызвать конденсацию.
, молекулы сближаются, силы притяжения достаточны, чтобы вызвать конденсацию.
Критерий критического состояния для чистого вещества:
Критическому состоянию соответствует T и P при которых газообразная и жидкая фазы становятся настолько близкими по свойствам, что не могут существовать как отдельные фазы (применимо и к смесям).
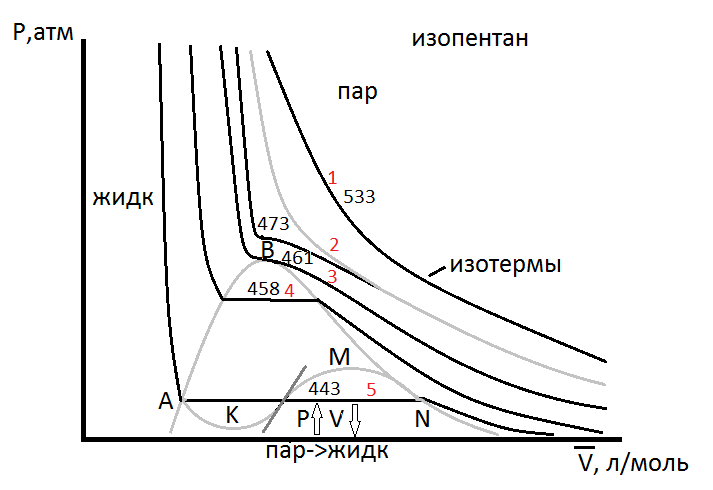
На рисунке показан характер кривых P-V вблизи критической температуры. График изображает зависимость давления пара изопентана от мольного объёма при нескольких температурах.
На рисунке представлены изотермы.
Кривые, соответствующие высоким температурам (>503K) – гиперболы - полная аналогия с идеальными газом. (1)
Кривая при T=473K(2), свидетельствуют, что молекулы уже притягиваются друг к другу и 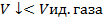 .
.
Кривые ниже T=461K (3) имеют горизонтальный участок.
Горизонтальные линии (4 и 5) показывают, что бесконечно малое увеличение давления вызывает сильное уменьшение объёма вследствие превращения газа в жидкость.
На диаграмме отмечены области существования всех фаз.
Поскольку жидкость сжимается труднее чем газ – изотермы для неё идут круче.
Вдоль горизонтальных линий сосуществуют одновременно жидкость и газ (газ в равновесии с жидкостью - пар).
На рисунке отмечена область существования пара и жидкости, охватывающая диапазон нахождения горизонтальных участков изотерм. Давления пара изопентана при любой температуре представлены горизонтальными линиями.
Точки максимума B позволяют определить критическую температуру Tк, Vк, Pк.
|
|
(Волнообразную кривую NMLKA рассмотрим позднее).
(Вещество вблизи критической точки вещество сильно рассеивает свет, это явление называют критической опалесценцией)
В 1879 году Ван-дер-Ваальс предложил своё толкование неидеального поведения газов, которое помогло понять и критические явления.
Большую сжимаемость реальных газов он он объяснил взаимным притяжением молекул.
Силы приводящие к конденсации до сих пор называются силами Ван-дер-Ваальса.
Происхождение таких сил было впервые объяснено Лондоном в 1930 г.
Ван-дер-Ваальс ввёл поправку на межмолекулярное притяжение, прибавив к измеряемому давлению в уравнении состояния член 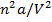 , где a – константа Ван-дер-Ваальса, n – число молей газа.
, где a – константа Ван-дер-Ваальса, n – число молей газа.
При достаточно высоком давлении реальные газы занимают больший объём, чем идеальные газы. Чтобы учесть это явление Ван-дер-Ваальс ввёл в уравнение состояния действительный объём, в котором движутся молекулы, его получают, вычитая из измеренного объёма V исключаемый объём nb
Полное уравнение Ван-дер-Ваальса:
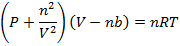
Или

(3.1)
Когда мольный объём велик, b и  становятся пренебрежимо малы. Из уравнения Ван-дер-Ваальса вытекает закон идеального газа
становятся пренебрежимо малы. Из уравнения Ван-дер-Ваальса вытекает закон идеального газа 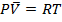 .
.
Константы можно рассчитать из экспериментально измеренных значений P, 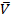 , T или из критических констант газа.
, T или из критических констант газа.
Вообще говоря, можно оценить исключаемый объём, допуская, что при достаточно низком давлении молекулы сближаются только попарно, а группы по три молекулы и более можно не принимать во внимание.
Объём, исключаемый для 1 молекулы, можно вычислить если рассматривать молекулы как жесткие сферы.
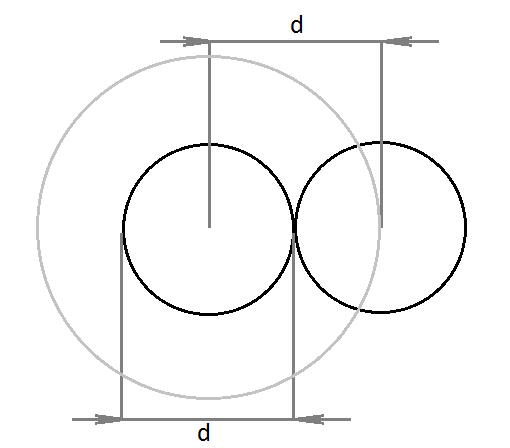 Для одной пары исключается
Для одной пары исключается 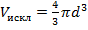
Для одной молекулы - 
Объём одной молекулы 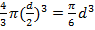 , т.е.
, т.е.
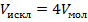
В расчёте на одну молекулу.
В первом приближении константа
b=4 
Уравнения Ван-дер-Ваальса в виде

Раскроем скобки и запишем по убывающим степеням  :
:

(3.1)’
При T<Tк это уравнение имеет три действительных корня. Графически уравнение может быть представлено в виде волнообразной кривой NMLKA на изотерме 443К.
|
|
Точки пересечения N,L,A на горизонтальной линии (P=const) дают три действительных значения  .
.
Рассчитанная кривая даёт как бы непрерывный переход из газообразной фазы в жидкость, но такого нет, а есть существование газа и жидкости вдоль горизонтальных прямых.
Теоретическая линия NMLKA не соответствует физическим представлениям.
При критической Tк (461K для пентана) и критическом давлении Pк уравнение (3.1)’ имеет только один действительный корень 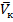 .
.
Значение констант a и b в уравнении Ван-дер-Ваальса можно рассчитать из критических констант газа.
Критическая точка – точка перегиба на кривой PV, т.е. 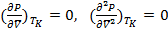
Критические явления наблюдаются для жидких растворов, биополимеров, жидких кристаллов, сплавов, сверхпроводников и ферромагнетиков.
|
|
|

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!