Нефтяной газ – газообразная фаза пластовой нефти, в которой содержание газообразных компонентов при соответствующих термобарических условиях, является преобладающим. Индивидуальный компонентный состав нефтяного газа при атмосферных условиях представлен следующими веществами:
Состав нефтяного газа
| Компоненты
|
| Неуглеводородные
| Углеводородные
|
| N2
| CO2
| H2S
| CH4
| C2H6
| C3H8
| iC4H10
| nC4H10
|
| | | | | | | | |
В нефтяном газе в виде паров могут присутствовать другие компоненты пластовой нефти – нормальный и изо-пентан, а так же более тяжелые компоненты С6-С10. Состав паров нефти в нефтяном газе является функцией не только состава пластовой нефти, но и термобарических условий разгазирования. Из неуглеводородных компонентов в нефтяном газе всегда присутствуют пары воды.
Все углеводороды нефтяного газа имеют линейное строение и считаются неполярными. Его можно рассматривать как идеальный газ, так как силами взаимодействия между молекулами можно пренебречь. К нефтяному попутному газу можно применять законы физики для идеальных систем. С точки зрения математики к расчету физико-химических свойств нефтяного попутного газа, как многокомпонентной системы, применим принцип аддитивности. Это означает, что каждый компонент газа в смеси ведет себя так, как если бы он был один. Для оценки макроскопических свойств нефтяного попутного газа (Псм) в нормальных и стандартных условиях применяются аддитивные методы расчета:
 , (1.13)
, (1.13)
где Ni – молярная доля i –го компонента; gi – весовая доля i –го компонента; Vi – объемная доля i –го компонента; Пi – физико-химический параметр i –го компонента
Плотность нефтяного газа – первичная характеристика, определяющая массу газа, заключенную в 1 м3, при 0оС и атмосферном давлении. Плотность нефтяного газа в соответствии с формулой (1.13) определяется как:
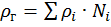 1.14
1.14
где Ni – молярная доля i –го компонента; ρi – плотность i –го компонента
Относительная плотность газа – отношение массы газа, заключенной в определенном объеме при данных термобарических условиях, к массе сухого воздуха в том же объеме, при тех же условиях.
Вязкость газа характеризует его состояние исходя из некоторых положений кинетической теории. При низких давлениях и температурах динамическая вязкость газа оценивается из теории соударения частиц и зависит от средней длины пробега молекул ( , от средней скорости движения молекул (
, от средней скорости движения молекул (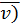 и от плотности газа (ρ)
и от плотности газа (ρ)
 1.15
1.15
Из формулы (1.15) следует, что с увеличением температуры вязкость газа увеличивается, так как увеличиваются средние скорость движения и длина свободного пробега молекул.
Повышение давления от 0,1 до 1,2 МПа не влияет на величину вязкости газа, поскольку уменьшение средней длины пробега молекулы и средней ее скорости движения компенсируется увеличением плотности. При давлении выше 1,2 МПа эти закономерности изменяются. Вязкость УВ газа при нормальных условиях невелика и не превышает 10 мкПа·с. Неуглеводородные компоненты газа более вязкие (0,01-0,025 мПа·с). Наибольшее влияние на величину вязкости нефтяного попутного газа оказывает азот. При содержании азота более 5% следует учитывать его влияние и оценивать вязкость газа, как средневзвешенную вязкость смеси по принципу аддитивности.
Молярная масса нефтяного газа, как многокомпонентной смеси, определяется суммой произведений молярной массы индивидуальных компонентов на их молярную долю.
Молярный объем нефтяного газа, как и любого другого, при стандартных условиях (20оС и атм. давлении) равен постоянной величине и составляет 24 м3/кмоль (22,4м3/кмоль - при нормальных условиях: 0оС и атм. давлении). Отсюда – плотность газа может быть рассчитана как отношение молярной массы этого газа к его молярному объему: ρг=Мг/22,4 кг/м3.
Уравнение состояния – аналитическая зависимость между параметрами, описывающими изменение состояния вещества. В качестве таких параметров используются давление, температура, объём. Состояние газа при нормальных и стандартных условиях описывается уравнением Менделеева-Клапейрона:
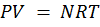 , (1.16)
, (1.16)
где Р – абсолютное давление, Па; V – объём, м3; N – количество вещества, моль; R – универсальная газовая постоянная, Па·м3/(моль-град); Т – абсолютная температура, К;.
На основе уравнения состояния газа можно рассчитывать многие параметры нефтяного газа: плотность, мольный объём, количество молекул, парциальные давления и другие.
В прикладных расчётах уравнение состояния имеет граничные условия. Оно справедливо при давлениях, близких к атмосферному (от 0,1 до 1,0-1,2 МПа) и при температурах 0-20 °С. При повышенном давлении газ сжимается. Его состояние отличается от поведения идеальных газов. Молекулы газов становятся склонными к межмолекулярному взаимодействию. Для учёта этого взаимодействия в инженерной практике для реальных газов используется уравнение Менделеева–Клапейрона, содержащее коэффициент сжимаемости Z, учитывающий отклонения поведения реального газа от идеального состояния:
 , (1.17)
, (1.17)
где N – количество вещества, моль; Z – коэффициент сжимаемости газа.

Физический смысл коэффициента сжимаемости заключается в расширении граничных условий уравнения Менделеева–Клапейрона для высоких давлений.
Коэффициент Z зависит от давления и температуры, приведенных давлений и температур, природы газа:
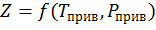 , (1.18)
, (1.18)
где Т прив – приведенная температура; Рприв – приведенное давление.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа: температура, давление, объём, плотность и другие больше или меньше критических.
 (1.19)
(1.19)
Для смесей газов приведённые параметры характеризуют отношения действующих (реальных) параметров (температура, давление и др.) к средне критическим параметрам смеси:
Критическая температура (Т кр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии:

 (1.20)
(1.20)
Если газ нагрет выше критической температуры его сжижение при любой степени сжатия невозможно.
Критическое давление – давление паров вещества (или смеси веществ) в его критическом состоянии. При давлении ниже критического система может распадаться на две равновесные фазы — жидкость и пар. При критическом давлении теряется физическое различие между жидкостью и паром, вещество переходит в однофазное состояние. Поэтому критическое давление можно определить ещё как предельное (наивысшее) давление насыщенного пара в условиях сосуществования жидкой фазы и пара. Критическое давление представляет собой физико-химическую константу вещества.
 , где
, где 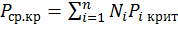 (1.21)
(1.21)
При температуре ниже Тк газ, находящийся под давлением Рк, может быть сжижен
При низких давлениях растворимость газов в углеводородных жидкостях подчиняется закону Генри: вес газа, растворенного в данном количестве жидкости при заданной температуре пропорционален давлению газа, и мало зависит от молекулярного веса жидкости.
 или
или 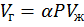
где  – объем растворенного газа при данной температуре; К – константа Генри (К= f (α)); α – коэффициент растворимости газа; V ж – объем жидкости растворителя
– объем растворенного газа при данной температуре; К – константа Генри (К= f (α)); α – коэффициент растворимости газа; V ж – объем жидкости растворителя
Коэффициент растворимости газа (α) показывает, какое количество газа (V г) растворяется в единице объёма жидкости (V ж) при данном давлении:
 (1.22)
(1.22)
Коэффициент растворимости зависит от природы газа и жидкости, давления, температуры.
Растворимость, выраженная в объеме газа на массу углеводорода обратно пропорциональна молекулярному весу углеводорода. Это положение справедливо и для растворимости газа в нефти. Растворимость метана в углеводородах уменьшается при переходе от парафиновых к нафтеновым и ароматическим. Растворимость метана, выраженная в нормальных объемах газа на массу нефти, уменьшается не только с увеличением молекулярного веса нефти, но и с увеличением содержания в ней нафтеновых и ароматических углеводородов.
Для ориентировочной оценки мольной растворимости различных газов в углеводородных жидкостях можно использовать уравнение Рауля-Дальтона: мольная растворимость при парциальном давлении газового компонента 1атм. в любом растворителе, образующем с газом идеальный раствор, равна обратной величине давления пара растворенного компонента.
 1.23
1.23
Рост температуры приводит к увеличению давления паров растворяемого вещества и, следовательно, к уменьшению растворимости. Растворимость углеводородных газов в нефти уменьшается по абсолютной величине при увеличении температуры.
Растворимость газовых компонентов в пластовой воде значительно меньше, чем в нефти, но она представляет интерес с точки зрения технологии добычи, сбора и подготовки продукции скважин. Растворимость тех или иных газов в воде характеризуется их содержанием в воде, находящейся в фазовом равновесии с газовой средой. По растворимости в воде газы можно разбить на три группы.
К первой группе относятся газы неполярные с критической температурой значительно ниже 0оС. из компонентов нефтяного газа к этой группе относятся гелий, водород, азот, аргон и метан. Указанные газы характеризуются относительно низкой растворимостью. Растворимость газов этой группы интенсивно возрастает с увеличением давления.
Ко второй группе относятся неполярные газы с критической температурой выше 0оС. Эти газы могут сжижаться при повышении давления в области температур выше 0оС и ниже критической температуры соответствующих компонентов. К этой группе относятся этан, пропан и бутаны. Растворимость газов этой группы с повышением давления возрастает не столь интенсивно. По мере приближения к давлению, при котором газ сжижается, рост растворимости замедляется. При давлениях, превосходящих давление сжижения газа, равновесие газ – вода заменяется равновесием сжиженный газ – вода. При этом растворимость сжиженного газа медленно увеличивается с повышением давления.
К третьей группе относятся хорошо растворимые в воде газы – сероводород, двуокись углерода. Критические температуры их выше 0оС. Рост растворимости резко замедляется при приближении к давлению сжижения
Принимая во внимание, что нефтяной газ в основном состоит из метана, а содержание в нем других компонентов очень невелико, растворимость нефтяного газа в воде практически не зависит от его состава. Исключением являются газы некоторых нефтяных месторождений, содержащие азот в количестве, превышающем 50%. Растворимость в воде гомологов метана из их смесей с азотом выше, чем из смесей с метаном. Различие тем больше, чем выше молекулярный вес гомолога, выше давление и ниже температура.
Растворенные в воде соли резко уменьшают растворимость газов в воде (рис. 1.9). Зависимость растворимости газа от концентрации растворенных в воде солей описывается уравнением Сеченова
 , (1.24)
, (1.24)
где N i*1 – мольная доля растворенного в солевом растворе компонента находящегося в равновесии с газом; N i1 – мольная доля растворенного в чистой воде компонента, находящегося в равновесии с газом; k i – коэффициент Сеченова, характеризующий влияние данной соли на растворимость газового компонента i; n - концентрация растворенной в воде соли г-экв/кг.
Коэффициент растворимости газов в воде изменяется в широких пределах и достигает величины порядка 4-5·10-5 м3/(м3Па).
Равновесная газовая фаза всегда содержит пары воды. Содержание водяных паров в газе называется влагосодержанием. Растворенные в воде соли влияют и на влагосодержание газа. Чем выше минерализация воды, тем ниже влагосодержание.
Влагосодержание газов тесно связано с процессом гидратообразования. Гидраты – твердые соединения, в которых молекулы газа заполняют структурные пустоты кристаллической решетки, образованной молекулами воды, с помощью прочной водородной связи. Гидраты – химические соединения строго определенного состава, молекулярного типа, возникающие за счет ван-дер-ваальсовых (межмолекулярного притяжения) сил. Строение молекул гидратов выражается формулами: СН4·5,75Н2О; С3Н8·17Н2О; С4Н8·17Н2О.

Рис. 1.6. Кривые растворимости газа в чистой и соленой воде при различных температурах и давлениях: 1,2- дистиллированная вода; 3,4 -2 М раствор NaCl



 , (1.13)
, (1.13)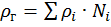 1.14
1.14 , от средней скорости движения молекул (
, от средней скорости движения молекул (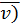 и от плотности газа (ρ)
и от плотности газа (ρ) 1.15
1.15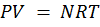 , (1.16)
, (1.16) , (1.17)
, (1.17)
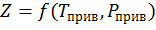 , (1.18)
, (1.18) (1.19)
(1.19)
 (1.20)
(1.20) , где
, где 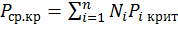 (1.21)
(1.21) или
или 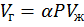
 – объем растворенного газа при данной температуре; К – константа Генри (К= f (α)); α – коэффициент растворимости газа; V ж – объем жидкости растворителя
– объем растворенного газа при данной температуре; К – константа Генри (К= f (α)); α – коэффициент растворимости газа; V ж – объем жидкости растворителя (1.22)
(1.22) 1.23
1.23 , (1.24)
, (1.24)



