Аналитическая реакция – реакция нейтрализации
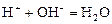 .
.
1 этап. В растворе присутствует только сильная кислота, рН раствора определяется её концентрацией:
 ,
,
где С K – нормальная концентрация кислоты.
2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью:
 .
.
рН вычисляется по уравнению:
 ,
,
где V K – объём пробы кислоты, взятый для титрования (аликвота), С Щ – нормальная концентрация раствора щёлочи, V Щ – объём раствора щёлочи, добавленного в процессе титрования.
3 этап. Точка эквивалентности. В системе находится только негидролизующаяся соль. рН = 7. На нейтрализацию кислоты затрачен эквивалентный объём щелочи V Э.
4 этап. Добавление избытка титранта после точки эквивалентности. рН определяется только количеством добавленной щёлочи и вычисляется по уравнению:
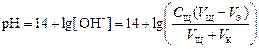 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. соляной кислоты 0,1 н. раствором гидроксида натрия.
| V NaOH, мл
| Система
| Расчётная формула
| рН
|
|
| 0,1 н. раствор HCl
| 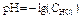
| 1,00
|
|
| Титрование соляной кислоты.
| 
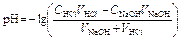
| 1,09
|
|
| 1,48
|
|
| 1,75
|
|
| 2,28
|
| 9,5
| 2,59
|
| 9,9
| 3,30
|
|
| NaCl
| Точка эквивалентности, V Э = 10 мл, V Σ = 20 мл
| 7,00
|
| 10,1
| Избыток щёлочи
| 
| 10,70
|
|
| 11,68
|
|
| 11,96
|
|
| 12,30
|
|
| 12,52
|

Кривая титрования сильной кислоты щелочью
Точка эквивалентности соответствует объёму титранта 10 мл. Обращает внимание резкий скачок величины рН в этой области. Объём одной капли раствора обычно составляет 0,01-0,02 мл. В области эквивалентной точки при добавлении капли щёлочи рН возрастает на 3-6 единиц. Поэтому эквивалентную точку можно определить с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10.
Кривая титрования сильного основания кислотой
Аналитическая реакция – реакция нейтрализации
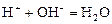 .
.
1 этап. В растворе присутствует только щёлочь и рН раствора определяется её концентрацией:
 .
.
2 этап. Процесс титрования. Происходит постепенная нейтрализация щелочи кислотой:
 .
.
рН вычисляется по уравнению:
 .
.
3 этап. Точка эквивалентности. В системе находится только негидролизующаяся соль. рН = 7. На нейтрализацию кислоты затрачен эквивалентный объём кислоты V Э.
4 этап. После точки эквивалентности рН определяется только количеством добавленной кислоты и вычисляется по уравнению:
 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. гидроксида натрия 0,1 н. раствором соляной кислоты.
| V NaOH, мл
| Система
| Расчётная формула
| рН
|
|
| 0,1 н. раствор NaOH
| 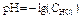
| 13,00
|
|
| Титрование гидроксида натрия.
| 

| 12,91
|
|
| 12,52
|
|
| 12,25
|
|
| 11,72
|
| 9,5
| 11,41
|
| 9,9
| 10,70
|
|
| NaCl
| Точка эквивалентности, V Э = 10 мл, V Σ = 20 мл
| 7,00
|
| 10,1
| Избыток кислоты
| 
| 3,30
|
|
| 2,32
|
|
| 2,04
|
|
| 1,70
|
|
| 1,48
|

Кривая титрования сильного основания кислотой
Кривая титрования щёлочи кислотой является зеркальным отражением кривой титрования сильной кислоты щёлочью. Эквивалентную точку можно определить с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10.



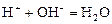 .
. ,
, .
. ,
,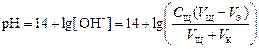 .
.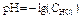

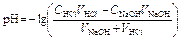


 .
. .
. .
.





