

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
В растворах слабых электролитов процесс диссоциации протекает обратимо, поэтому к нему можно применить закон действия масс. Так в растворе уксусной кислоты процесс диссоциации обратим:
CH3COOH ⇄ CH3COO¯ + H +
константа равновесия равна:

Константу равновесия для процесса диссоциации называют константой диссоциации и обозначают К д. Константы диссоциации кислот и оснований приводятся в справочной литературе.
Многоосновные кислоты диссоциируют ступенчато; на каждой ступени отщепляется один ион водорода, поэтому число ступеней диссоциации равно основности кислоты. Каждая ступень характеризуется своей константой диссоциации:
I ступень диссоциации угольной кислоты:
H2CO3 ⇄ H+ + HCO3¯

II ступень диссоциации угольной кислоты:
HCO3−⇄ H+ + CO32−

Первый ион водорода отрывается от молекулы легче, чем следующие, т.к. возрастает отрицательный заряд кислотного остатка, константа диссоциации по первой ступени больше, чем по второй и третей ступенях – 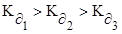 .
.
Диссоциация слабых оснований также протекает по ступеням; на каждой ступени отщепляется один гидроксид-ион, поэтому число ступеней диссоциации равно кислотности основания. Каждая ступень характеризуется своей константой диссоциации:
I ступень диссоциации гидроксида железа (II):
Fe(OH)2 ⇄ FeOH + + OH¯

II ступень диссоциации гидроксида железа (II):
FeOH + ⇄ Fe 2+ + OH¯

Ступенчатой диссоциацией объясняется способность оснований многовалентных металлов образовывать основные соли, например Fe(OH)2Cl, FeOHCl2.
Произведение растворимости
Понятие «произведение растворимости» (ПР), рассматривается для малорастворимых соединений (абсолютно нерастворимых веществ нет).
|
|
Запишем закон действия масс для гетерогенной системы – насыщенному раствору малорастворимого соединения:
АxBy ⇄ xAy+ + yBx−
При постоянной температуре количество АxBy в растворе неизменно, т.к. соль очень плохо растворяется в воде, поэтому добавление новых количеств этой соли не меняет ее концентрацию в растворе. В системе устанавливается равновесие между раствором и твердой фазой, т.е. в раствор переходит столько же ионов, сколько их возвращается в осадок.
 ,
,
т.к. концентрация АxBy является величиной постоянной, то можно объединить две константы в одну:


В насыщенном растворе малорастворимого соединения произведение концентрации его ионов в степени их стехиометрических коэффициентов есть величина постоянная, называемая произведением растворимости – ПР.Значения ПР приводятся в таблице 5.1.
Для однотипных трудно растворимых веществ: чем больше произведение растворимости вещества, тем больше оно растворяется в воде.
Условие выпадения и растворения осадка:
Соединение выпадает в осадок если:
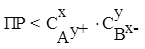
Соединение растворяется если:

Таблица 5.1
Произведение растворимости (ПР) некоторых соединений
(температура 298К, S-растворимость, г/100 г воды)
| Вещество | ПР | S |
| AgCl | 1,77·10−10 | 1,90·10−4 |
| Ag2CrO4 | 4,05·10−12 | 3,30·10−3 |
| Ag3 PO4 | 1,46·10−21 | 1,14·10−4 |
| Ag2S | 5,70·10−51 | 1,13·10−17 |
| Ag2SO4 | 7,70·10−5 | 0,84 |
| Al(OH)3 | 5,10·10−33 | 3,71·10−9 |
| BaCO3 | 8,10·10−9 | 1,80·10−3 |
| BaCrO4 | 2,40·10−10 | 3,90·10−4 |
| Ba F2 | 1,70·10−6 | 0,13 |
| BaSO4 | 1,08·10−10 | 2,40·10−4 |
| CaCO3 | 9,30·10−9 | 9,80·10−4 |
| CaF2 | 3,40·10−11 | 1,60·10−3 |
| Ca(OH)2 | 5,47·10−6 | 8,21·10−2 |
| Ca3(PO4)2 | 1,00·10−25 | 1,20·10−4 |
| CaSO4 | 6,10·10−5 | 0,10 |
| Co(OH)2 | 1,60·10−18 | 6,80·10−6 |
| CoS | 3,10·10−23 | 5,57·10−12 |
| Cu(OH)2 | 2,20·10−20 | 1,47·10−6 |
| CuS | 3,20·10−38 | 1,79·10−19 |
| FeCO3 | 2,10·10−11 | 5,30·10−5 |
| Fe(OH)2 | 1,65·10−15 | 6,20·10−5 |
| Fe(OH)3 | 3,80·10−38 | 1,94·10−10 |
| FeS | 3,70·10−19 | 6,08·10−10 |
| Hg S | 4,00·10−53 | 6,32·10−27 |
| MgCO3 | 2,00·10−4 | 0,12 |
| Mg(OH)2 | 5,50·10−12 | 6,40·10−4 |
| Mn(OH)2 | 1,30·10−18 | 6,10·10−6 |
| Mn S | 7,00·10−16 | 2,30·10−7 |
| Ni(OH)2 | 1,60·10−14 | 1,50·10−4 |
| Ni S | 3,00·10−21 | 5,48·10−11 |
| PbCl2 | 2,40·10−4 | 1,08 |
| PbCrO4 | 1,80·10−14 | 4,30·10−6 |
| PbS | 3,40·10−28 | 1,84·10−14 |
| PbSO4 | 1,60·10−8 | 3,80·10−3 |
| Sn(OH)2 | 5,00·10−26 | 3,30·10−8 |
| SnS | 1,00·10−27 | 3,16·10−16 |
| Zn(OH)2 | 1,30·10−17 | 1,40·10−5 |
| ZnS | 7,40·10−27 | 8,60·10−14 |
|
|
|
|
|

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!