Процессы взаимодействия жидкого металла с расплавленным шлаком имеют большое техническое значение и протекают во многих металлургических агрегатах. Производительность этих агрегатов, а также качество готового металла в значительной степени определяются скоростью и полнотой перехода тех или иных элементов через границу фаз.
Одновременное протекание значительного числа физических и химических процессов в различных фазах, высокие температуры, наличие гидродинамических и тепловых потоков затрудняют экспериментальное изучение процессов взаимодействия фаз в производственных и лабораторных условиях. Столь сложные системы обычно исследуют с привлечением моделей, которые отражают отдельные, но наиболее существенные стороны рассматриваемого объекта. В настоящей работе математическая модель процессов, протекающих на границе металл – шлак, позволяет проанализировать изменение объемных концентраций компонентов и скорости их перехода через межфазную границу в зависимости от времени.
Восстановление марганца из оксидного расплава происходит по электрохимической полуреакции:
1. (Mn2+) + 2e = [Mn].
Сопутствующие процессы должны быть процессами окисления. Очевидно, это может быть процесс окисления железа
2. [Fe] = (Fe2+) + 2e
или примесей в составе стали, например, кремния. Поскольку четырехзарядный ион кремния не может находиться в шлаке этот процесс сопровождается образованием кремнекислородного тетраэдра в соответствии с электрохимической полуреакцией:
3. [Si] + 4(O2–) = (SiO44–) + 4e.
Независимое протекание только одной из приведенных электродных полуреакций невозможно, т.к. это приводит к накоплению зарядов в двойном электрическом слое на границе раздела фаз, препятствующему переходу вещества.
Состояние равновесия по каждой из них характеризуется равновесным электродным потенциалом (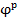 )
)
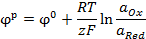
| (18.1)
|
где 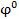 – стандартный потенциал,
– стандартный потенциал, 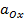 и
и  – активности окисленной и восстановленной форм вещества, z – число электронов, участвующих в электродном процессе, R – универсальная газовая постоянная, F – постоянная Фарадея, Т – температура.
– активности окисленной и восстановленной форм вещества, z – число электронов, участвующих в электродном процессе, R – универсальная газовая постоянная, F – постоянная Фарадея, Т – температура.
Восстановление марганца из шлака в металл реализуется в результате совместного протекания не менее двух электродных полуреакций. Скорости их устанавливаются такими, чтобы не происходило накопления зарядов на межфазной границе. В этом случае потенциал металла принимает стационарное значение, при котором скорости генерации и ассимиляции электронов одинаковы. Разность между фактическим, т.е. стационарным, потенциалом и его равновесным значением, называется поляризацией (перенапряжением) электрода,  . Поляризация характеризует степень удаления системы от равновесия и определяет скорость перехода компонентов через границу фаз в соответствии с законами электрохимической кинетики.
. Поляризация характеризует степень удаления системы от равновесия и определяет скорость перехода компонентов через границу фаз в соответствии с законами электрохимической кинетики.
С позиций классической термодинамики в системе в том или ином направлении происходят процессы восстановления марганца из шлака растворенным в железе кремнием
4. (MnO) + ½[Si] = [Mn] + ½(SiO2) DН = –30 кДж/моль
и самим растворителем (железом)
5. (MnO) + [Fe] = [Mn] + (FeO) DН = 132 кДж/моль.
Обратите внимание, что реакции имеют разный знак теплового эффекта, если в реакции 4 тепло выделяется, то реакция 5 сопровождается поглощением большого количества тепла. Поэтому о том, какая реакция получает наибольшее развитие можно судить просто по изменению температуры до тех пор, пока не будет реализована добавка оксида марганца в шлак, что сопровождается включением системы автоматического регулирования температуры.
С позиций формальной кинетики скорость реакции 4, определяемая, например, по изменению содержания кремния в металле, должна зависеть от произведения поверхностных концентраций оксида марганца в шлаке и кремния и марганца в металле в некоторых степенях, в первом приближении равных стехиометрическим множителям:
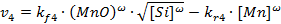
| (18.2)
|
Здесь kf 4 и kr 4 – константы скоростей прямой и обратной реакций, причем в последнюю включена и практически постоянная поверхностная концентрация оксида кремния в шлаке. Для бесконечно разбавленных растворов концентрации реагентов в поверхностном слое пропорциональны их концентрациям в так называемом «приповерхностном» слое – на границе между диффузионным и поверхностным слоями. В свою очередь последние определяются исключительно характеристиками диффузии реагентов и могут быть описаны в простейшем случае соотношениями:
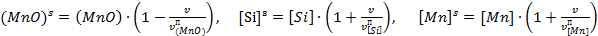 .
.
Предельные скорости диффузии выражаются уравнениями вида:

После несложных преобразований, справедливых, если для всех диффузионных этапов v << v п, приходим к следующему выражению:

Теперь его можно упрощать для отдельных частных случаев. Если в знаменателе можно пренебречь всеми слагаемыми по сравнению с единицей, то реализуется кинетический режим. Уравнение связи в этом случае имеет вид:

| (18.3)
|
Применимость этого уравнения можно проверить, определив методом наименьших квадратов значения констант скоростей прямой и обратной реакции. Очевидно, что по своему физическому смыслу все входящие в формулу величины кроме скорости должны быть положительны. Если это основное условие выполняется, то это является свидетельством, что реакция происходит в кинетическом режиме, иначе в процессе существенна роль диффузионных затруднений. О надежности такого вывода можно судить по коэффициенту корреляции, вычисляемому наряду с другими значениями при использовании метода наименьших квадратов в электронных таблицах.
Кинетическое уравнение реакции 5 имеет вид
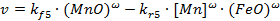
С учетом связи объемных концентраций с поверхностными и приповерхностными приходим к соотношению вида:
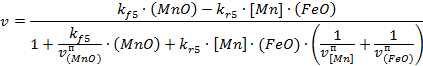
В кинетическом режиме оно приводится к виду:
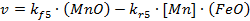
| (18.4)
|
Здесь следует воспользоваться таким же вариантом анализа, как для уравнения (18.3).
Константа равновесия реакции 5, выраженная через активности
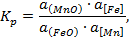
| (18.5)
|
является функцией только температуры.
Отношение равновесных концентраций марганца в шлаке и металле
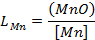
| (18.6)
|
называют коэффициентом распределения марганца, который, в отличие от 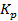 , зависит от состава фаз и служит количественной характеристикой распределения этого элемента между шлаком и металлом.
, зависит от состава фаз и служит количественной характеристикой распределения этого элемента между шлаком и металлом.



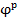 )
)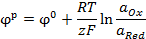
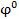 – стандартный потенциал,
– стандартный потенциал, 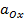 и
и  – активности окисленной и восстановленной форм вещества, z – число электронов, участвующих в электродном процессе, R – универсальная газовая постоянная, F – постоянная Фарадея, Т – температура.
– активности окисленной и восстановленной форм вещества, z – число электронов, участвующих в электродном процессе, R – универсальная газовая постоянная, F – постоянная Фарадея, Т – температура. . Поляризация характеризует степень удаления системы от равновесия и определяет скорость перехода компонентов через границу фаз в соответствии с законами электрохимической кинетики.
. Поляризация характеризует степень удаления системы от равновесия и определяет скорость перехода компонентов через границу фаз в соответствии с законами электрохимической кинетики.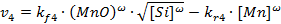
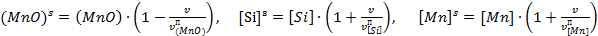 .
.


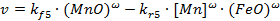
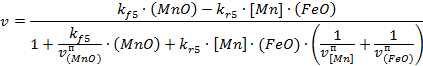
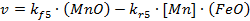
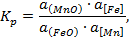
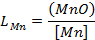
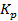 , зависит от состава фаз и служит количественной характеристикой распределения этого элемента между шлаком и металлом.
, зависит от состава фаз и служит количественной характеристикой распределения этого элемента между шлаком и металлом.

