концентрационный элемент используется для определения рН,
коэффициентов активности ионов,
растворимости электролитов
Элемент Якоби-Даниэля
элемент Якоби-Даниэля состоит из двух электродов, погруженных в растворы своих солей:
цинкового электрода, погруженного в раствор соли цинка, например, ZnSO4
медного электрода, погруженного в раствор соли меди, например, CuSO4
на электродах идет окислительно-восстановительная реакция
Zn + Cu2+ ® Zn2+ + Cu DG=-212 КДж
на цинковом электроде идет окисление цинка и растворение цинкового электрода
Zn ® Zn2+ + 2е- DG=-146 КДж
энергия гидратирования катиона Zn2+ расходуется на разрыв связей катиона Zn2+ в кристаллической решетке
энергия гидратирования катиона Zn2+ больше энергии связей катиона Zn2+ в кристаллической решетке
самопроизвольно идет процесс растворения цинкового электрода
на медном электроде идет восстановление ионов меди и осаждение меди на электроде
Cu2+ + 2е- ® Cu DG= -66 КДж
энергия связей Cu2+ в кристаллической решетке расходуется на разрыв связей Cu2+ в гидратированном ионе
энергия связей катиона Cu2+ в кристаллической решетке больше энергии связей Cu2+ в гидратированном ионе
самопроизвольно идет процесс осаждение меди
в результате реакции медный электрод приобретает (+)электродный потенциал, цинковый электрод (-)потенциал
если электроды соединить проводником, то из-за разности потенциалов в нем возникнет электрический ток
электроны в проводнике будут двигаться от (-)цинкового электрода к (+)медному электроду
особенность окислительно-восстановительной реакции в гальванических элементах –
электроны от восстановителя Zn к окислителю Cu2+ движутся по внешней цепи
потенциалы на электродах и разность потенциалов будут поддерживаться
- дальнейшим процессом выхода катионов Zn2+ в раствор – растворением (+)цинкового электрода
- дальнейшим процессом входа катионов Cu2+ в кристаллическую решетку – осаждением меди на медном электроде
если электрический ток от внешнего источника пропустить в обратном направлении,
то направление окислительно-восстановительной реакции изменится на обратное
Zn2+ + Cu ® Zn + Cu2+ DG=212 КДж
медный электрод будет растворяться, цинк будет осаждаться
поэтому, элемент Якоби-Даниэля – обратимый элемент
если растворы солей оставить разделенными, то в р-ре ZnSO4 накопятся ионы Zn2+, в р-ре CuSO4 ионы SO42-
избыток ионов Zn2+ и SO42- в растворах будет препятствовать выходу катионов Zn2+ в р-р и осаждению Cu2+
можно устранить избыток ионов, соединив растворы солей электролитным мостиком
движение ионов Zn2+ и SO42- по мостику уравняет заряды ионов в растворах солей,
но из-за различной подвижности ионов Zn2+ и SO42- возникнет диффузионный потенциал
диффузионный потенциал будет препятствовать выходу катионов Zn2+ в р-р и осаждению Cu2+
можно устранить диффузионный потенциал, соединив растворы солевым мостиком с раствором KCl
ионы K и Cl имеют одинаковую подвижность и не вызовут диффузионный потенциал
итак, при замыкании цепи с элементом Якоби-Даниэля возникнут два потока зарядов:
- поток электронов в проводнике внешней цепи от (-)цинкового электрода к (+)медному электроду
- поток катионов и анионов в растворах солей и по солевому мостику
элемент Якоби-Даниэля используют как источник электрического тока, источник электрической энергии
источник электрической энергии – хим.реакция окисления цинка и восстановления меди
Zn + Cu2+ ® Zn2+ + Cu
эдс в элемента Якоби-Даниэля рассчитывают по уравнению Нернста
а) работа по переносу заряда рассчитывается по формуле A = n E F,
где n - заряд катиона, Е – эдс элемента, F – число Фарадея
работа по переносу заряда равна изменению изобарно-изотермического потенциала элемента Якоби-Даниэля
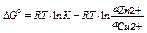 изменение изобарно-изотермического потенциала элемента Якоби-Даниэля рассчитывается по формуле
изменение изобарно-изотермического потенциала элемента Якоби-Даниэля рассчитывается по формуле
итого,
б) эдс цепи из электродов зависит от электродных потенциалов и рассчитывается по формуле
Е = jCu – jZn
если учитывать диффузионный потенциал, то эдс рассчитывается по формуле
Е = jCu – jZn + jD
если учитывать контактный потенциал между контактом медного и цинкового электродов во внешней цепи,
то эдс рассчитывается по формуле
Е = jCu – jZn + jD + jСu-Zn
378) водородный электрод
379)стандартный водородный электрод
380)электроды сравнения
для измерения электродных потенциалов из двух разных электродов собирают гальванический элемент
гальванический элемент включают в электрическую цепь и измеряют ток в цепи
в качестве второго электрода используют электрод сравнения
ПР: стандартный водородный электрод
электрод состоит из U-образной стеклянной трубки,
один конец трубки введен электрод из губчатой платины
трубка заполнена раствором соляной кислоты, через трубку пропускают водород
газообразный водород адсорбируется на губчатой платине и диссоциирует на ионы водорода
идет окисление-восстановление катионов водорода Н+
Н2Û2Н+ + 2е-
водородный электрод обратим по одному иону в растворе – это электрод I рода
потенциал водородного электрода зависит
от активности катионов Н+ или концентрации катионов Н+(концентрации раствора соляной кислоты),
от концентрации Н2(давления газообразного водорода рН2)
от температуры
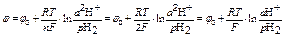 потенциал водородного электрода рассчитывают по формуле
потенциал водородного электрода рассчитывают по формуле
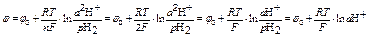 если давление газообразного водорода рН2=101 Кпа, то уравнение принимает вид
если давление газообразного водорода рН2=101 Кпа, то уравнение принимает вид
если lnaH+= ln[H+]=2,303lg[H+]=-2,303pH, то уравнение принимает вид
для стандартного водородного потенциала используют Н2 под давлением 1 атм в 1М HCl при Т=25°С
стандартный водородный потенциал применяют как электрод сравнения – его потенциал принимают за нулевой
ПР: каломельный электрод
электрод состоит из стеклянного сосуда, послойно заполненного
металлической ртутью Hg (потенциал снимается со ртути),
малорастворимой солью ртути (в виде пасты), например, Нg2Cl2
раствором растворимой соли той же кислоты, что и малорастворимая соль ртути, например, КCl
идет восстановление катионов ртути
Нg+ + е- ® Hg
катионы ртути образуются при диссоциации малорастворимой соли ртути – каломели Нg2Cl2
Нg2Cl2 Û 2Нg+ + 2Cl-
диссоциация каломели зависит от ионов Cl-, которые образуются при диссоциации растворимой соли
КCl ® К+ + Cl-
каломельный электрод обратим по двум ионам в растворе – это электрод II рода
потенциал каломельного электрода зависит
от концентрации ионов Cl- (концентрации растворимой раствора соли),
от температуры
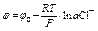 потенциал каломельного электрода рассчитывают по формуле
потенциал каломельного электрода рассчитывают по формуле
чем концентрированнее раствор растворимой соли, тем меньше диссоциация каломели, тем меньше потенциал
как правило, пользуются насыщенным р-ром соли (его легче готовить), например, насыщенным р-ром КCl
каломельный потенциал применяют как электрод сравнения
ПР:
383)хлорсеребрянный электрод
электрод состоит серебряной проволоки, покрытой AgCl и погруженной в раствор KCl
идет восстановление катионов серебра(осаждение) и окисление труднорастворимой соли AgCl(растворение)
Ag+ + е- ® Ag
AgCl + е- Û Ag + Cl-
окисление соли AgCl зависит от ионов Cl-, которые образуются при диссоциации растворимой соли
КCl ® К+ + Cl-
хлорсеребряный электрод обратим по двум ионам в растворе – это электрод II рода
потенциал хлорсеребряного электрода зависит
от концентрации ионов Cl- (концентрации раствора соли),
от температуры
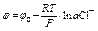 потенциал хлорсеребряного электрода рассчитывают по формуле
потенциал хлорсеребряного электрода рассчитывают по формуле
чем концентрированнее раствор соли, тем меньше потенциал
как правило, пользуются насыщенным раствором соли, например, насыщенным раствором КCl
хлорсеребряный потенциал применяют как электрод сравнения
384)Понятие об окислительно-восстановительных(редокс-системах),электродах и потенциалах.
386)Типы окислительно-восстановительных(редокс-системах)систем.
раствор, содержащий окисленную и восстановленную форму вещества, образует редокс-систему
в редокс-системе окисленная и восстановленная формы находятся в динамическом равновесии
ПР: Fe3+ + e- Û Fe2+
различают редокс-системы по механизму окисления-восстановления
- в редокс-системах I типа окисление-восстановление идет путем передачи е-
ПР: Fe3+ + e- Û Fe2+
- в редокс-системах II типа окисление-восстановление идет путем передачи е- и протонов
ПР:
индифферентный электрод (Au Pt..) в растворе с редокс-системой зафиксирует потенциал редокс-системы:
индифферентный электрод не будет участвовать в реакциях, выполняя только роль проводника е-
на границе электрод-раствор электрод будет отдавать е- катионам Fe3+ и будет получать е- от Fe2+
при избытке окисленной формы Fe 3+ электрод больше отдаст е- и приобретет (+)заряд
заряд на электроде приведет к образованию двойного электрического слоя
возникшее электрическое поле будет препятствовать дальнейшей отдаче е-, установится новое равновесие
при избытке восстановленной формы Fe 2+ электрод больше получит е- и приобретет (-)заряд
образуется двойной электрический слой
возникшее электрическое поле будет препятствовать дальнейшему присоединению е-, установится новое равновесие
при равной концентрации катионов Fe 3+ и Fe 2+ катионы Fe3+ будут активнее,
электрод больше отдаст е- и преобретет (+)заряд..
388)уравнению Нернста-Петерса для различных редокс-систем.
редокс-потенциал рассчитывается по уравнению Нернста-Петерса
в редокс-системах I типа
,
где n - число е-, участвующих в окислительно-восстановительной реакции,
j0 - стандартный редокс-потенциал при одинаковой активности(концентрации) окислителя и восстановителя,
F - число Фарадея F =96500 Кл/моль,
R – газовая постоянная R =8,31 Дж/моль×К,
T – абсолютная температура в К,
а(окислитель) – активность окислителя
для разбавленных растворов активность окислителя равна концентрации окислителя а[окислитель]
а(восстановитель) – активность восстановителя
для разбавленных растворов активность восстановителя равна концентрации восстановителя а[восстановитель]
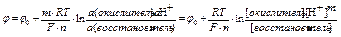 в редокс-системах II типа
в редокс-системах II типа
,
где n - число е-, участвующих в окислительно-восстановительной реакции
m - число протонов, участвующих в окислительно-восстановительной реакции
j0 - стандартный редокс-потенциал при одинаковой активности окислителя и восстановителя и аН+=1
анализ уравнения Нернста-Петерса
– редокс-потенциал зависит от природы редокс-системы (зависит от j0),
от соотношения концентраций окислителя-восстановителя,
от активности Н+ для редокс-систем II типа
- редокс-потенциал не зависит от индифферентного электрода
если соединить электроды двух редокс-систем в цепь, то образуется окислительно-восстановительная цепь
в цепи будут идти окислительно-восстановительные реакции,
сопровождающиеся переносом е- от электрода с низким редокс-потенциалом к электроду с высоким потенциалом
эдс окислительно-восстановительной цепи рассчитывают по формуле
Е = j 1 – j2
редокс-потенциалы рассчитывают по уравнению Нернста-Петерса..



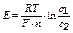
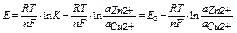
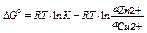 изменение изобарно-изотермического потенциала элемента Якоби-Даниэля рассчитывается по формуле
изменение изобарно-изотермического потенциала элемента Якоби-Даниэля рассчитывается по формуле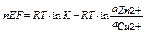
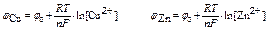
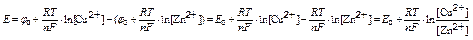
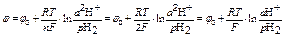 потенциал водородного электрода рассчитывают по формуле
потенциал водородного электрода рассчитывают по формуле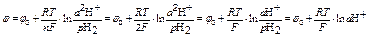 если давление газообразного водорода рН2=101 Кпа, то уравнение принимает вид
если давление газообразного водорода рН2=101 Кпа, то уравнение принимает вид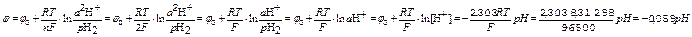
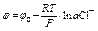 потенциал каломельного электрода рассчитывают по формуле
потенциал каломельного электрода рассчитывают по формуле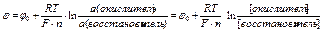
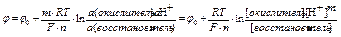 в редокс-системах II типа
в редокс-системах II типа


