Атом водорода является простейшим атомом, он представляет собой связанную кулоновским притяжением систему из протона и электрона. Поэтому анализ его спектров излучения и поглощения удобен для изучения проявлений законов квантовой законов физики в областях нанометрового размера [1-8]. Частоты 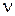 и длины волн
и длины волн 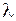 испускаемого или поглощаемого атомом (молекулой) света определяются значениями (уровнями) энергии
испускаемого или поглощаемого атомом (молекулой) света определяются значениями (уровнями) энергии 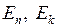 начального и конечного стационарного состояния атома (молекулы)
начального и конечного стационарного состояния атома (молекулы)
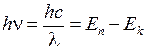 , (5.1)
, (5.1)
где 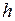 – постоянная Планка,
– постоянная Планка, 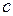 – скорость света.
– скорость света.
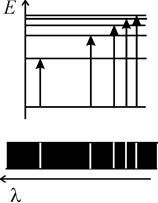
Набор длин волн излучения, поглощаемого при переходе атома (молекулы) из основного состояния (с наименьшей энергией) в возбужденные состояния образует серию в спектре поглощения и выглядит как группа “вырезанных” линий на фоне сплошного спектра (см. рис. 5.1а).
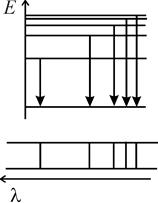
| Рис. 5.1. Переходы между уровнями энергии атома (вверху), приводящие к образованию серии спектральных линий (внизу) в спектре поглощения (а) и излучения (б). Показаны негативные изображения спектров на фотопластинках, подобные используемым в работах 5, 6, 10.
|   а б
а б
|
Эта серия обычно называется главной, для атома водорода она находится в дальней ультрафиолетовой области и была названа серией Лаймана*1. Группа переходов в одно из состояний атома из вышележащих состояний (рис. 5.1б) с некоторым общим свойством, например, одинаковым азимутальным (орбитальным) квантовым числом, также образует серию линий в спектре излучения (рис. 5.1б).
В спектрах излучения атомов обычно присутствует несколько серий, часто перекрывающихся друг с другом (см. работу 6). Спектр излучения атомарного водорода в оптической и ближней ультрафиолетовой областях содержит лишь одну серию, названную серией Бальмера*2. Целью работы является проверка формулы Бальмера для длин волн образующих эту и другие серии
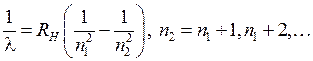 , (5.2)
, (5.2)
где 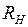 – постоянная Ридберга*3,
– постоянная Ридберга*3, 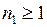 ,
,  – целые числа. Изучение закономерностей расположения линий в сериях позволяет определять энергии и другие свойства атомных состояний. В частности, из формулы Бальмера и формулы (5.1) следует формула для уровней энергии атома водорода
– целые числа. Изучение закономерностей расположения линий в сериях позволяет определять энергии и другие свойства атомных состояний. В частности, из формулы Бальмера и формулы (5.1) следует формула для уровней энергии атома водорода
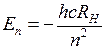 или
или 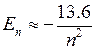 эВ. (5.3)
эВ. (5.3)
где 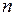 – целые числа и за
– целые числа и за 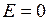 принято значение энергии взаимодействия протона и электрона, когда расстояние между ними бесконечно.
принято значение энергии взаимодействия протона и электрона, когда расстояние между ними бесконечно.
Первоначально экспериментальная формула (5.3) для уровней энергии атома водорода по мере развития квантовой теории получила теоретическое объяснение. В атоме водорода электрон движется в электростатическом поле ядра – протона, который можно считать точечным зарядом. Потенциальная энергия взаимодействия электрона с протоном (в системе единиц СИ)
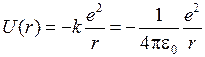 , (5.4)
, (5.4)
где 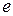 – элементарный заряд,
– элементарный заряд,  – расстояние между электроном и протоном,
– расстояние между электроном и протоном, 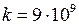 м/Ф. Качественное представление о поведении единственного электрона в водородоподобном атоме дает модель Бора*1, основанная на трех постулатах [1-7]. В этой модели электрон движется по так называемым “разрешенным” круговым орбитам с радиусами
м/Ф. Качественное представление о поведении единственного электрона в водородоподобном атоме дает модель Бора*1, основанная на трех постулатах [1-7]. В этой модели электрон движется по так называемым “разрешенным” круговым орбитам с радиусами
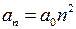 ,
, 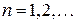 , (5.5)
, (5.5)
где 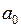 – боровский радиус (точнее первый боровский радиус),
– боровский радиус (точнее первый боровский радиус), 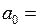 0.0529 нм,
0.0529 нм, 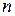 – главное квантовое число, а для энергии атома водорода получается формула (5.3) со значением постоянной Ридберга
– главное квантовое число, а для энергии атома водорода получается формула (5.3) со значением постоянной Ридберга
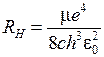 , (5.6)
, (5.6)
где 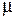 – приведенная масса электрона и протона
– приведенная масса электрона и протона
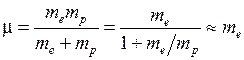 , (5.7)
, (5.7)
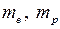 – массы электрона и протона. Формулу Бальмера (5.2) записывают также для частот в виде
– массы электрона и протона. Формулу Бальмера (5.2) записывают также для частот в виде
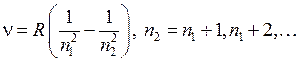 , (5.8)
, (5.8)
с постоянной Ридберга
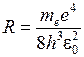 . (5.9)
. (5.9)
В разработанной позднее более сложной модели Бора-Зоммерфельда*2 у электрона с энергией 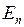 возможны
возможны 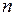 различных орбит – эллипсов с одной и той же большой полуосью
различных орбит – эллипсов с одной и той же большой полуосью 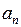 (5.5) и различными малыми полуосями
(5.5) и различными малыми полуосями
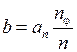 , (5.10)
, (5.10)
где 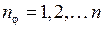 – так называемое побочное квантовое число. Этим орбитам соответствуют
– так называемое побочное квантовое число. Этим орбитам соответствуют 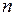 значений момента импульса электрона
значений момента импульса электрона 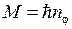 , где
, где 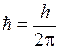 , причем круговой боровской орбите соответствует максимальное значение момента импульса
, причем круговой боровской орбите соответствует максимальное значение момента импульса 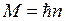 . Три орбиты модели Бора-Зоммерфельда для
. Три орбиты модели Бора-Зоммерфельда для 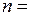 3 показаны на рис. 5.2 вместе с принятыми в атомной физике обозначениями s, p, d для состояний с азимутальным (орбитальным) квантовым числом
3 показаны на рис. 5.2 вместе с принятыми в атомной физике обозначениями s, p, d для состояний с азимутальным (орбитальным) квантовым числом 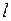 =0,1,2,
=0,1,2, 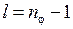 .
.
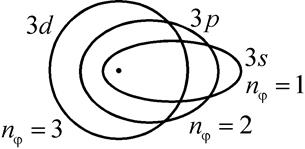
| Рис. 5.2. Три орбиты электрона в модели Бора-Зоммерфельда атома водорода для главного квантового числа 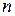 =3 =3
|
Модели Бора и Бора-Зоммерфельда явились определенными историческими этапами на пути понимания строения атома водорода. Полное квантовое описание атома водорода было дано Э.Шредингером* в 1926 г. Согласно квантовой теории, одним из основных уравнений которой является уравнение Шредингера для волновой функции 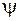 , к микрочастицам и, в частности, к электрону не применимо понятие траектории (орбиты). Поэтому орбитальные модели Бора и Бора-Зоммерфельда дают лишь качественные наглядные картины, условно передающие некоторые свойства состояний электрона в атоме водорода. Условной эллиптической орбите с побочным квантовым числом
, к микрочастицам и, в частности, к электрону не применимо понятие траектории (орбиты). Поэтому орбитальные модели Бора и Бора-Зоммерфельда дают лишь качественные наглядные картины, условно передающие некоторые свойства состояний электрона в атоме водорода. Условной эллиптической орбите с побочным квантовым числом 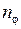 соответствует точное квантовое состояние с азимутальным (орбитальным) квантовым числом
соответствует точное квантовое состояние с азимутальным (орбитальным) квантовым числом 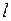
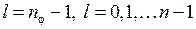 , (5.11)
, (5.11)
и квадратом момента импульса
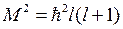 . (5.12)
. (5.12)
В атоме водорода 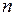 состояний электрона с различными значениями квантового числа
состояний электрона с различными значениями квантового числа 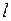 (5.11) имеют одну и ту же энергию (5.3), такая ситуация в квантовой теории называется вырождением.
(5.11) имеют одну и ту же энергию (5.3), такая ситуация в квантовой теории называется вырождением.
Решение уравнения Шредингера
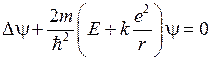 . (5.13)
. (5.13)
дает для состояний электрона в атоме водорода те же энергии (5.3), (5.6), что и модель Бора, и волновые функции 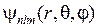 , называемые атомными орбиталями (АО)
, называемые атомными орбиталями (АО)
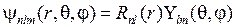 . (5.14)
. (5.14)
Здесь 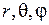 – сферические координаты,
– сферические координаты, 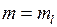 – магнитное орбитальное квантовое число,
– магнитное орбитальное квантовое число,
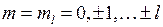 . (5.15)
. (5.15)
Функции 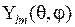 называются сферическими гармониками (или сферическими функциями), в случае
называются сферическими гармониками (или сферическими функциями), в случае 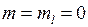 они выражаются через так называемые многочлены (полиномы) Лежандра
они выражаются через так называемые многочлены (полиномы) Лежандра
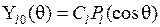 . (5.16)
. (5.16)
Радиальные части 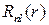 находятся путем решения радиального уравнения Шредингера. Для атома водорода они имеют следующие свойства:
находятся путем решения радиального уравнения Шредингера. Для атома водорода они имеют следующие свойства:
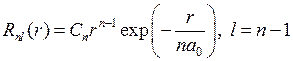 , (5.17)
, (5.17)
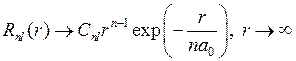 ,
, 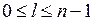 . (5.18)
. (5.18)
Радиальная плотность вероятности обнаружения электрона на расстоянии  от ядра
от ядра
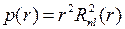 , (5.19)
, (5.19)
у состояний с максимальным 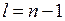 , которым соответствуют круговые боровские орбиты, максимальна на расстоянии от ядра
, которым соответствуют круговые боровские орбиты, максимальна на расстоянии от ядра
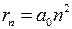 , (5.20)
, (5.20)
равном радиусу орбиты (5.5).
2. Методика эксперимента.
Для наблюдения спектров газов обычно применяют разрядные трубки, содержащие исследуемый газ при малом давлении. Электрический разряд происходит между электродами, впаянными по концам трубки. Наибольшая интенсивность излучения происходит в средней, капиллярной, части трубки. Спектр атомарного водорода получают с помощью газоразрядной гейсслеровской* трубки, наполненной молекулярным водородом Н2 под давлением 0,7 – 1,3 кПа (5-10 мм. рт. ст.). Благодаря наличию на медных электродах окиси меди при разряде в трубке образуется атомарные кислород О и водород Н, молекулы воды Н2О и нестабильные молекулы (радикалы) ОН (см. Прил. 2).
Измерительная установка состоит из излучателя и монохроматора МУМ. Блок излучателя содержит Н-образную разрядную трубку ТВС-15 (Тлеющая Водородная Спектральная), заполненную водородом, устройство ее питания и юстировочный узел. Наибольшая интенсивность линий достигается, если источником света служит торец горизонтальной части трубки (капилляра). Трубка заполняется до давления 5-10 Тор (1 Тор = 1 мм. рт. ст. = 1.33-102 Па).
В исходном состоянии излучатель отъюстирован. Вертикальная юстировка осуществляется перемещением держателя в рейтере. Горизонтальная юстировка позволяет перемещать центр области свечения лампы относительно оси излучателя по горизонтали от 0 до 3 мм для лучшего совмещения с выходным окном излучателя.
Высокое напряжение, создаваемое блоком питания лампы ТВС-15, поддерживает в ней электрический разряд. При неупругих столкновениях электронов с атомами водорода атомы переходят на высшие энергетические уровни (см. работу 7). Через время порядка 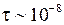 с, атомы переходят на более низкие энергетические уровни с испусканием фотонов. Частота и длина волны излучения определяется формулой (5.1). В объективе монохроматора можно наблюдать четыре линии атомарного водорода, входящих в серию Бальмера и имеющие обозначения
с, атомы переходят на более низкие энергетические уровни с испусканием фотонов. Частота и длина волны излучения определяется формулой (5.1). В объективе монохроматора можно наблюдать четыре линии атомарного водорода, входящих в серию Бальмера и имеющие обозначения 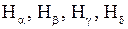 . Наибольшую интенсивность обычно имеет красная линия
. Наибольшую интенсивность обычно имеет красная линия 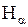 , которая обычно и определяет цвет излучения трубки. В спектре водородной трубки присутствуют также линии молекулярного водорода, которые имеют очень слабую интенсивность по сравнению с линиями атомарного водорода.
, которая обычно и определяет цвет излучения трубки. В спектре водородной трубки присутствуют также линии молекулярного водорода, которые имеют очень слабую интенсивность по сравнению с линиями атомарного водорода.



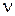 и длины волн
и длины волн 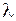 испускаемого или поглощаемого атомом (молекулой) света определяются значениями (уровнями) энергии
испускаемого или поглощаемого атомом (молекулой) света определяются значениями (уровнями) энергии 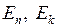 начального и конечного стационарного состояния атома (молекулы)
начального и конечного стационарного состояния атома (молекулы)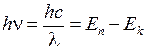 , (5.1)
, (5.1)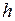 – постоянная Планка,
– постоянная Планка, 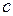 – скорость света.
– скорость света.
 а б
а б
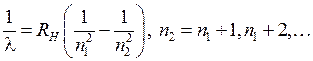 , (5.2)
, (5.2)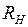 – постоянная Ридберга*3,
– постоянная Ридберга*3, 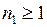 ,
,  – целые числа. Изучение закономерностей расположения линий в сериях позволяет определять энергии и другие свойства атомных состояний. В частности, из формулы Бальмера и формулы (5.1) следует формула для уровней энергии атома водорода
– целые числа. Изучение закономерностей расположения линий в сериях позволяет определять энергии и другие свойства атомных состояний. В частности, из формулы Бальмера и формулы (5.1) следует формула для уровней энергии атома водорода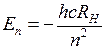 или
или 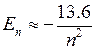 эВ. (5.3)
эВ. (5.3)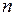 – целые числа и за
– целые числа и за  принято значение энергии взаимодействия протона и электрона, когда расстояние между ними бесконечно.
принято значение энергии взаимодействия протона и электрона, когда расстояние между ними бесконечно.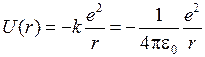 , (5.4)
, (5.4)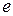 – элементарный заряд,
– элементарный заряд,  – расстояние между электроном и протоном,
– расстояние между электроном и протоном, 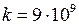 м/Ф. Качественное представление о поведении единственного электрона в водородоподобном атоме дает модель Бора*1, основанная на трех постулатах [1-7]. В этой модели электрон движется по так называемым “разрешенным” круговым орбитам с радиусами
м/Ф. Качественное представление о поведении единственного электрона в водородоподобном атоме дает модель Бора*1, основанная на трех постулатах [1-7]. В этой модели электрон движется по так называемым “разрешенным” круговым орбитам с радиусами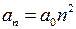 ,
, 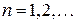 , (5.5)
, (5.5)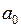 – боровский радиус (точнее первый боровский радиус),
– боровский радиус (точнее первый боровский радиус), 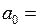 0.0529 нм,
0.0529 нм, 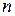 – главное квантовое число, а для энергии атома водорода получается формула (5.3) со значением постоянной Ридберга
– главное квантовое число, а для энергии атома водорода получается формула (5.3) со значением постоянной Ридберга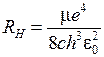 , (5.6)
, (5.6)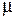 – приведенная масса электрона и протона
– приведенная масса электрона и протона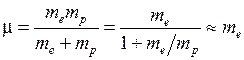 , (5.7)
, (5.7)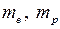 – массы электрона и протона. Формулу Бальмера (5.2) записывают также для частот в виде
– массы электрона и протона. Формулу Бальмера (5.2) записывают также для частот в виде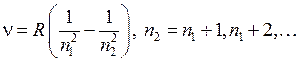 , (5.8)
, (5.8)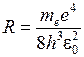 . (5.9)
. (5.9)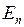 возможны
возможны 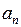 (5.5) и различными малыми полуосями
(5.5) и различными малыми полуосями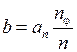 , (5.10)
, (5.10)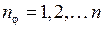 – так называемое побочное квантовое число. Этим орбитам соответствуют
– так называемое побочное квантовое число. Этим орбитам соответствуют 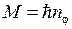 , где
, где 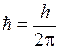 , причем круговой боровской орбите соответствует максимальное значение момента импульса
, причем круговой боровской орбите соответствует максимальное значение момента импульса 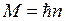 . Три орбиты модели Бора-Зоммерфельда для
. Три орбиты модели Бора-Зоммерфельда для 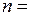 3 показаны на рис. 5.2 вместе с принятыми в атомной физике обозначениями s, p, d для состояний с азимутальным (орбитальным) квантовым числом
3 показаны на рис. 5.2 вместе с принятыми в атомной физике обозначениями s, p, d для состояний с азимутальным (орбитальным) квантовым числом 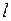 =0,1,2,
=0,1,2, 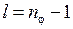 .
.
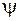 , к микрочастицам и, в частности, к электрону не применимо понятие траектории (орбиты). Поэтому орбитальные модели Бора и Бора-Зоммерфельда дают лишь качественные наглядные картины, условно передающие некоторые свойства состояний электрона в атоме водорода. Условной эллиптической орбите с побочным квантовым числом
, к микрочастицам и, в частности, к электрону не применимо понятие траектории (орбиты). Поэтому орбитальные модели Бора и Бора-Зоммерфельда дают лишь качественные наглядные картины, условно передающие некоторые свойства состояний электрона в атоме водорода. Условной эллиптической орбите с побочным квантовым числом 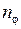 соответствует точное квантовое состояние с азимутальным (орбитальным) квантовым числом
соответствует точное квантовое состояние с азимутальным (орбитальным) квантовым числом 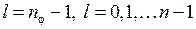 , (5.11)
, (5.11)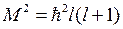 . (5.12)
. (5.12)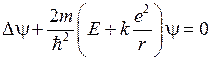 . (5.13)
. (5.13)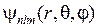 , называемые атомными орбиталями (АО)
, называемые атомными орбиталями (АО)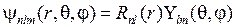 . (5.14)
. (5.14)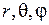 – сферические координаты,
– сферические координаты, 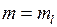 – магнитное орбитальное квантовое число,
– магнитное орбитальное квантовое число,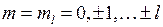 . (5.15)
. (5.15)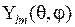 называются сферическими гармониками (или сферическими функциями), в случае
называются сферическими гармониками (или сферическими функциями), в случае 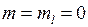 они выражаются через так называемые многочлены (полиномы) Лежандра
они выражаются через так называемые многочлены (полиномы) Лежандра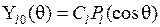 . (5.16)
. (5.16) находятся путем решения радиального уравнения Шредингера. Для атома водорода они имеют следующие свойства:
находятся путем решения радиального уравнения Шредингера. Для атома водорода они имеют следующие свойства: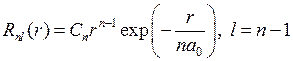 , (5.17)
, (5.17)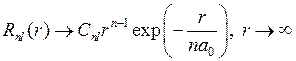 ,
, 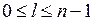 . (5.18)
. (5.18)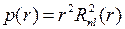 , (5.19)
, (5.19)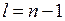 , которым соответствуют круговые боровские орбиты, максимальна на расстоянии от ядра
, которым соответствуют круговые боровские орбиты, максимальна на расстоянии от ядра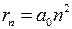 , (5.20)
, (5.20)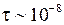 с, атомы переходят на более низкие энергетические уровни с испусканием фотонов. Частота и длина волны излучения определяется формулой (5.1). В объективе монохроматора можно наблюдать четыре линии атомарного водорода, входящих в серию Бальмера и имеющие обозначения
с, атомы переходят на более низкие энергетические уровни с испусканием фотонов. Частота и длина волны излучения определяется формулой (5.1). В объективе монохроматора можно наблюдать четыре линии атомарного водорода, входящих в серию Бальмера и имеющие обозначения 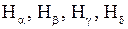 . Наибольшую интенсивность обычно имеет красная линия
. Наибольшую интенсивность обычно имеет красная линия 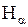 , которая обычно и определяет цвет излучения трубки. В спектре водородной трубки присутствуют также линии молекулярного водорода, которые имеют очень слабую интенсивность по сравнению с линиями атомарного водорода.
, которая обычно и определяет цвет излучения трубки. В спектре водородной трубки присутствуют также линии молекулярного водорода, которые имеют очень слабую интенсивность по сравнению с линиями атомарного водорода.

