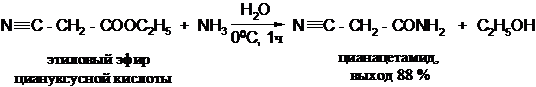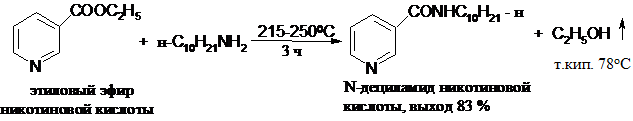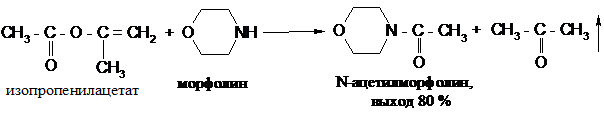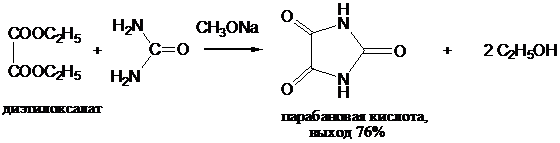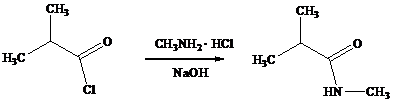М. Ю. СКОМОРОХОВ, А. К. ШИРЯЕВ, Ю. Н. КЛИМОЧКИН
АЦИЛИРОВАНИЕ
Методическое пособие
Самара 2005
ОГЛАВЛЕНИЕ
| Введение…………………………………………………………………………................
1. Методы получения сложных эфиров карбоновых кислот (О-ацилирование)...
1.1. Реакции этерификации карбоновых кислот……………………...…. …...................
1.2. Ацилирование спиртов и фенолов хлорангидридами кислот…………...................
1.3. Ацилирование спиртов и фенолов ангидридами кислот…………………………...
1.4. Реакция переэтерификации (алкоголиз сложных эфиров)…………………………
2. Методы получения амидов карбоновых кислот (N -ацилирование)…………….
2.1. Ацилирование аммиака и аминов галогенангидридами и ангидридами
карбоновых кислот……………………………………………………………...........
2.2. Аммонолиз сложных эфиров……………………………………………....................
3. С-Ацилирование……………………………………………………………..................
3.1. Ацилирование ароматических соединений (реакция Фриделя-Крафтса)…………
3.2. синтез карбоциклических систем внутримолекулярным ацилированием по
реакции Фриделя-Крафтса………………………………………………....................
3.3. Ацилирование непредельных соединений………………………………..................
3.4. Ацилирование b -дикарбонильных соединений……………………...…………...
4. Экспериментальная часть……………………………………………………………
Библиографический список……………………………………………………..............
| 4
5
6
13
15
16
17
17
21
24
24
32
33
34
35
44
|
ВВЕДЕНИЕ
Реакции ацилирования органических соединений являются важнейшими методами современной синтетической органической химии. При помощи этих реакций могут быть синтезированы различные типы органических соединений, например, сложные эфиры, первичные, вторичные и третичные амиды карбоновых кислот, алифатические и ароматические кетоны, карбоциклические системы и многие другие органические соединения.
Ацилированием в органическом синтезе называют реакции введения ацильной группы (RCO-) в молекулы органических соединений путем замещения атома водорода. В более широком смысле ацилированием называют замещение любого атома или группы атомов на ацильную группу. В зависимости от типа атома, к которому присоединяется ацильная группа, различают С-ацилирование, N-ацилирование, О-ацилирование. Реакции, при которых вводится ацетильная группа (СН3СО-), называются ацетилированием, бензоильная группа (С6Н5СО-) – бензоилированием и т.д. Наиболее распространенные ацилирующие агенты - хлорангидриды и ангидриды карбоновых кислот (табл. 1, 2).
Таблица 1. Основные производные насыщенных карбоновых кислот
| Карбоновая кислота
| HCOOH
Муравьиная
| CH3COOH
Уксусная
| CH3CH2COOH
Пропионовая
| CH3CH2CH2COOH
Масляная
|
| Ацильный остаток
|  Формил
Формил
|  Ацетил
Ацетил
|  Пропионил
Пропионил
|  Бутирил
Бутирил
|
| Хлорангидрид
кислоты
| -
|  Ацетилхлорид
Ацетилхлорид
|  Пропионилхлорид
Пропионилхлорид
|  Бутирилхлорид
Бутирилхлорид
|
| Ангидрид
кислоты
| -
|  Уксусный ангидрид
Уксусный ангидрид
|  Пропионовый ангидрид
Пропионовый ангидрид
|  Масляный ангидрид
Масляный ангидрид
|
| Первичный амид кислоты
|  Формамид
Формамид
| 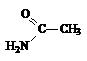 Ацетамид
Ацетамид
|  Пропиоамид
Пропиоамид
|  Бутирамид
Бутирамид
|
| Этиловый эфир кислоты
| HCOOC2H5
Этилформиат
| CH3COOC2H5
Этилацетат
| CH3CH2COOC2H5
Этилпропионат
| CH3CH2CH2COOC2H5
Этилбутират
|
Таблица 2. Основные производные ненасыщенных и ароматических карбоновых кислот
| Карбоновая кислота
|  Акриловая
Акриловая
|  Метакриловая
Метакриловая
|  Бензойная
Бензойная
|  1-Нафтойная
1-Нафтойная
|
| Ацильный остаток
|  Акрилоил
Акрилоил
|  Метакрилоил
Метакрилоил
|  Бензоил
Бензоил
|  1-Нафтоил
1-Нафтоил
|
| Хлор - ангидрид
кислоты
|  Акрилоилхлорид
Акрилоилхлорид
|  Метакрилоил-хлорид
Метакрилоил-хлорид
|  Бензоилхлорид
Бензоилхлорид
|  1-Нафтоилхлорид
1-Нафтоилхлорид
|
| Первичный амид кислоты
|  Акриламид
Акриламид
|  Метакриламид
Метакриламид
|  Бензамид
Бензамид
| 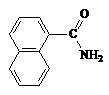 1-Нафтамид
1-Нафтамид
|
| Этиловый эфир кислоты
|  Этилакрилат
Этилакрилат
|  Этилметакрилат
Этилметакрилат
|  Этилбензоат
Этилбензоат
|  Этил-1-нафтоат
Этил-1-нафтоат
|
КИСЛОТ (О-ацилирование)
Спирты могут реагировать с образованием сложных эфиров не только с карбоновыми кислотами, но и с некоторыми функциональными производными кислот: хлорангидридами, ангидридами, сложными эфирами (RCOZ).
| Чем больше отрицательный индукционный эффект (-I-эффект) и чем меньше положительный мезомерный эффект (+М-эффект) группы Z, тем больше будет частичный положительный заряд (d+) на атоме углерода карбонильной группы и тем с
| 
|
большей скоростью протекает реакция ацилирования спиртов. По способности ацилировать спирты и фенолы производные кислот можно расположить в следующий ряд:

Азеотропная этерификация
Смешивают 1 моль карбоновой кислоты, 1,75 моля абсолютного спирта на каждую карбоксильную группу кислоты, 0,05 моля концентрированной серной кислоты (или п -толуолсульфокислоты, нафталинсульфокислоты) и 100 мл растворителя – бензола, толуола, хлороформа или тетрахлорметана.
Реакционную смесь кипятят при перемешивании с обратным холодильником и насадкой Дина-Старка (см. рисунок), до прекращения выделения воды.
При этерификации оксикислот, a, b -непредельных кислот, а также при этерификации вторичными спиртами применение в качестве катализатора концентрированной серной кислоты нежелательно вследствие возможных побочных реакций.
Азеотропный метод этерификации с кислотными катализаторами позволяет значительно снизить количество добавляемых минеральных кислот. При этом их часто заменяют алкил- или арилсульфокислотами (например п -толуолсульфокислотой), вследствие чего уменьшаются побочные процессы. Однако третичные спирты не этерифицируются и таким методом.

Аминокислоты образуют сложные эфиры только при взаимодействии со спиртами в присутствии сухого газообразного хлористого водорода. Роль хлористого водорода здесь не ограничивается катализом реакции или сдвигом равновесия за счет связывания воды. В присутствии HCl аминокислоты, находящиеся в форме внутренней соли, превращаются в хлористоводородные соли аминокислот, причем карбоксильная группа из неактивной формы аниона переходит в реакционную форму – СООН:

В результате этерификации в этих условиях эфиры аминокислот образуются в виде солей.
В последнее время для проведения реакции этерификации используют дициклогексилкарбодиимид (ДЦК). При взаимодействии эквимолярных количеств карбоновой кислоты, спирта и ДЦК в подходящем растворителе при комнатной температуре образуется сложный эфир с практически количественным выходом» 95-99%. ДЦК связывает выделяющуюся воду с образованием N,N'-дициклогексилмочевины, что позволяет достичь высоких степеней конверсии:

Одним из эффективных методов, позволяющих получать сложные эфиры в мягких условиях, является реакция Мицунобу, заключающаяся во взаимодействии карбоновой кислоты и спирта с трифенилфосфином и диэтилазодикарбоксилатом (DEAD):


Аммонолиз сложных эфиров
Действие аммиака, первичных или вторичных аминов на сложные эфиры карбоновых кислот приводит, обычно в довольно мягких условиях, к образованию амидов карбоновых кислот.
В реакции аммонолиза сложных эфиров наблюдаются следующие основные закономерности:
· метиловые эфиры легче подвергаются аммонолизу, чем этиловые; эфиры первичных спиртов реагируют легче, чем эфиры вторичных спиртов;
· первичные амины реагируют с большей скоростью, чем аммиак; вторичные амины в большинстве случаев реагируют значительно медленнее аммиака;
· реакция катализируется небольшими количествами воды; более эффективными катализаторами являются алкоголяты щелочных металлов (особенно при ацилировании ароматических аминов).
Для получения незамещенных амидов часто бывает достаточно перемешивания сложных эфиров с концентрированным водным раствором аммиака:
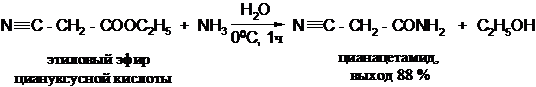
Вместо водного раствора аммиака часто используют раствор аммиака в метаноле или этаноле:

Диэтиловые эфиры алкилмалоновых кислот легко реагируют с аммиаком в метаноле в присутствии каталитических количеств метилата натрия; в то же время диэтиловые эфиры диалкилмалоновых кислот в эту реакцию не вступают:

Взаимодействие эфиров с первичными и вторичными аминами, если оба компонента жидкие, можно проводить без растворителей:

Если термическая стабильность и летучесть компонентов позволяют проводить реакцию при повышенных температурах, то продолжительность реакции значительно сокращается:
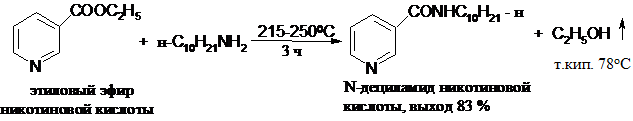
Важное значение аммонолиз сложных эфиров имеет в синтезе b-кетокислот, так как сами кислоты и их хлорангидриды неустойчивы. Например, при кипячении (145-1500С) этилового эфира бензоилуксусной кислоты с анилином в ксилоле с выходом 84 % получают бензоилацетанилид (N -фениламид бензоилуксусной кислоты):

Скорость реакции взаимодействия сложных эфиров с аминами во многих случаях повышается при применении в качестве ацилирующих агентов таких сложных эфиров, спиртовые остатки которых легко поддаются замещению. Такими наиболее легко уходящими группами в сложных эфирах являются цианометильная (NCCH2), п -нитрофенильная (4-O2NC6H4) и изопропенильная [СН2=С(СН3)-]. Например, изопропенилацетат бурно реагирует с аминами уже при комнатной температуре, при этом из реакционной смеси отгоняется образующийся ацетон:
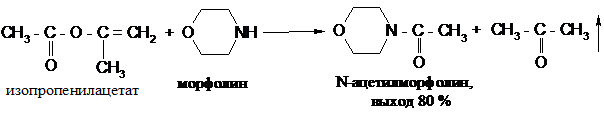
Из многочисленных реакций сложных эфиров карбоновых кислот с амидами наибольшее значение имеют реакции циклизации, протекающие при взаимодействии диэфиров дикарбоновых кислот с мочевиной в присутствии эквивалентных количеств алкоголята щелочного металла:
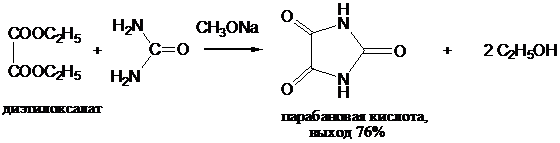

Гораздо легче, чем амины, с эфирами карбоновых кислот реагирует гидразин (реакция гидразинолиза). Простейшие эфиры алифатических кислот чаще всего превращаются в гидразиды кислот (N -ацилгидразины) уже при комнатной температуре в результате экзотермической реакции, однако лучше проводить реакцию при непродолжительном нагревании на водяной бане:

Так же, как при аммонолизе, эфиры карбоновых кислот с разветвлением в a -положении реагируют с гидразингидратом медленнее, чем неразветвленные сложные эфиры. Продолжительность реакций сокращается при использовании в качестве растворителей спиртов с более высокой температурой кипения (например, бутанола-l, т. кип. 1180С) или при взаимодействии с безводным гидразином.
С-Ацилирование
Экспериментальная часть
B -нафтилпропионат

Реактивы: b-нафтол – 2 г (0,014 моль);
пропионовый ангидрид – 1,8 г (1,76 мл, 0,014 моль);
NaOH 10%-ый раствор – 6,2 мл (0,0145 моль).
Посуда: кругдодонная колба; воздушный холодильник; колба Бунзена; воронка Бюхнера.
В круглодонную колбу на 100 мл помещают 2 г b-нафтола и 6,2 мл 10%-ного раствора NaOH. Колбу соединяют с обратным воздушным холодильником и перемешивают при комнатной температуре до полного растворения b-нафтола. Затем в колбу добавляют 12 г измельченного льда и при перемешивании небольшими порциями прибавляют 1,76 мл пропионового ангидрида. После этого колбу встряхивают 15 мин и образующийся b-нафтилпропионат отфильтровывают на воронке Бюхнера, промывают водой и сушат на воздухе. Выход – 2,7 г (97%); т. пл. 90-92 0С.
АЦЕТАНИЛИД

Реактивы: уксусная кислота – 15 г (14,3 мл, 0,25 моль);
анилин – 15,7 г (15,4 мл, 0,17 моль)
соляная кислота 5%-ная – 50 мл.
Посуда: кругдодонная колба на 100 мл; елочный дефлегматор; холодильник Либиха; термометр; приемник; колба Бунзена; воронка Бюхнера; химический стакан на 250 мл.
В круглодонную колбу на 100 мл помещают 15,4 мл анилина, 14,3 мл уксусной кислоты. Колбу соединяют с елочным дефлегматором, холодильником. Колбу нагревают на воздушной бане и отгоняют смесь уксусной кислоты и воды со скоростью 5 мл в час при температуре 103-105 0С. Когда температура паров достигнет 115 0С, нагревание прекращают и горячую реакционную смесь выливают в стакан со смесью 50 мл холодной воды и 50 г измельченного льда. Выпавший ацетанилид отфильтровывают на воронке Бюхнера, промывают 50 мл 5%-ной соляной кислотой и водой 2 раза по 50 мл. Затем осадок сушат на воздухе. Выход – 15,8 г (70,2%); т.пл.=112-114 0С.
Анилид пропионовой кислоты

Реактивы: анилин – 4,65 г (4,55 мл, 0,05 моль);
пропионовый ангидрид – 7 г (6,8 мл, 0,054 моль).
Посуда: плоскодонная колба; колба Бунзена; воронка Бюхнера.
В плоскодонную колбу на 100 мл помещают 4,55 мл анилина и 15 мл воды и при энергичном перемешивании добавляют 6,8 мл пропионового ангидрида. Реакционная смесь разогревается и вскоре превращается в густую массу. Колбу охлаждают до комнатной температуры, осадок отфильтровывают, промывают водой и сушат на воздухе. Выход – 6,8 г (83%); т. пл. 91-93 0С.
Анилид пропионовой кислоты

Реактивы: гидрохлорид анилина – 2,7 г (0,021 моль);
пропионовый ангидрид – 2,9 г (2,8 мл, 0,022 моль);
ацетат натрия – 3,8 г (0,046 моль).
Посуда: плоскодонная колба; термометр; колба Бунзена; воронка Бюхнера.
В плоскодонной колбе на 250 мл растворяют 2,7 г гидрохлорида анилина в 60 мл воды. Полученный раствор нагревают до 50-55 0С. Нерастворимые примеси отфильтровывают. К профильтрованному раствору при температуре 50-55 0С прибавляют 2,8 мл пропионового ангидрида и раствор 3,8 г ацетата натрия в 10 мл воды. Колбу охлаждают до комнатной температуры, осадок отфильтровывают, промывают водой и сушат на воздухе. Выход – 2,5 г (81%); т. пл. 88-90 0С.
О-нитроацетофенон

Реактивы: малоновый эфир – 35,2 г (0,22 моль);
этиловый спирт (абсолютный) – 19,5 г (25 мл, 0,43 моль);
магний (стружка) – 5,4 г (0,22 моль);
хлористый о -нитробензоил – 37 г (0,2 моль);
диэтиловый эфир (абсолютный) – 225 мл;
уксусная кислота – 60 мл;
серная кислота (конц.) – 7,6 мл.
Посуда: трехгорлая колба; холодильник Либиха; термометр; механическая мешалка; делительная воронка; капельная воронка; хлоркальциевая трубка.
В трехгорлую круглодонную колбу емкостью 500 мл, снабженную мешалкой с глицериновым затвором, капельной воронкой и обратным холодильником, защищенным хлоркальциевой трубкой, помещают 5,4 г магниевых стружек. Затем туда же прибавляют 5 мл абсолютного этилового спирта и 0,5 мл четыреххлористого углерода. Если реакция не начнется немедленно, то колбу нагревают в течение короткого времени на паровой бане. После протекания реакции в течение нескольких минут к смеси при осторожном перемешивании прибавляют 150 мл абсолютного эфира, а затем раствор 35,2 г малонового эфира в 20 мл абсолютного этилового спирта и 25 мл абсолютного эфира. Прибавление ведут со скоростью, при которой поддерживается энергичное кипение смеси; в случае необходимости применяют нагревание извне. Смесь кипятят с обратным холодильником на паровой бане в течение 3 ч; за это время большая часть магния растворяется. К жидкости, окрашенной в серый цвет, прибавляют в течение 15 мин раствор 37 г хлористого о -нитробензоила в 50 мл абсолютного эфира. Кипячение с обратным холодильником на паровой бане не прерывают в течение всего периода прибавления хлористого о -нитробензоила и продолжают его до тех пор, пока раствор, окрашенный в зеленый цвет, не станет слишком вязким для перемешивания. Затем реакционную смесь охлаждают и медленно добавляют 200 мл 10%-ной серной кислоты до растворения всего осадка.
После этого эфирный слой отделяют, а водный экстрагируют эфиром (75 мл). Эфирные вытяжки соединяют вместе и промывают водой, а растворитель отгоняют.
К неочищенному диэтиловому эфиру о-нитробензоилмалоновой кислоты прибавляют раствор 60 мл ледяной уксусной кислоты и 7,6 мл концентрированной серной кислоты в 40 мл воды и смесь кипятят в течение 4 ч или до тех пор, пока не прекратится выделение углекислого газа. Затем реакционную смесь охлаждают в бане со льдом, подщелачивают 20%-ным раствором едкого натра и экстрагируют несколькими порциями эфира. Соединенные вместе эфирные вытяжки промывают водой и сушат безводным сернокислым натрием, после чего растворитель отгоняют. Остаток подвергают фракционированной перегонке и получают 27,0-27,4 г (82 – 83%) светло-желтого о-нитроацетофенона с т. кип. 158 -159 оС (16 мм рт. ст.), nD20 1,551.
A -тетралон

Реактивы: g-фенилмасляная кислота – 22 г (0,13 моль);
полифосфорная кислота – 150 г.
Посуда: трехгорлая колба; термометр; механическая мешалка; делительная воронка.
В трехгорлую колбу на 500 мл, снабженную механической мешалкой и термометром, загружают 150 г полифосфорной кислоты и при температуре 90 0С прибавляют 22 г g-фенилмасляной кислоты, перемешивают при этой температуре 0,5 ч. Смесь охлаждают до 60 0С и выливают в 1 кг льда. Выпавший продукт экстрагируют бензолом 3´50 мл, бензольный раствор сушат над сульфатом натрия и отгоняют досуха в вакууме. Сырой продукт очищают перегонкой. Выход 14 г (75%); т. кип. 130 0С (12 мм. рт. ст).
N -метилизобутирамид
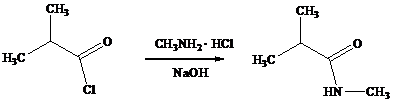
Реактивы: хлорангидрид изомасляной кислоты – 42,4 г (0,4 моль);
гидрохлорид метиламина – 27,8 г (0,4 моль);
гидроксид натрия – 32,0 г (0,8 моль).
Посуда: трехгорлая колба; термометр; механическая мешалка; делительная воронка.
Осторожно смешивают раствор 32,0 г NaOH в 100 мл воды с раствором 27,8 г гидрохлорида метиламина в 69 мл воды и охлаждают. К смеси при перемешивании прибавляют по каплям 42,4 г (0,4 моль) хлорангидрид изомасляной кислоты с такой скоростью, чтобы температура не превышала 10 0С. После этого доводят температуру до комнатной, отделяют слой амида, а из водной фазы три раза экстрагируют амид эфиром порциями по 20 мл. Слой амида и эфирные растворы объединяют, сушат над сульфатом натрия и перегоняют. Выход амида – 30,3 г (75%); т. кип. 120-121 0С (27 мм рт. ст.); nD20 1,4350.
N -метоксиацетофенон

Реактивы: анизол 10 г – (9,8 мл, 0,11 моль);
хлористый алюминий – 14 г (0,11моль);
хлористый ацетил – 8,6 г (7,9 мл, 0,11 моль);
четыреххлористый углерод (абсолютный) – 60 мл.
Посуда: трехгорлая колба; термометр; механическая мешалка; делительная воронка; капельная мешалка; холодильник Либиха.
В трехгорлую колбу емкостью 250 мл, снабженную механической мешалкой, обратным холодильником и капельной воронкой, помещают раствор 14 г безводного AlCl3 в 60 мл сухого четыреххлористого углерода и при сильном перемешивании и охлаждении в бане со льдом медленно добавляют по каплям 8,6 г хлористого ацетила, а затем при охлаждении льдом и солью (0 – 5 0С в реакционной смеси) из той же воронки прибавляют 10 г анизола. Смесь перемешивают при комнатной температуре до прекращения выделения НCl и выливают (постепенно) в смесь 150 мл 2 н. НCl и 100 г льда. Тяжелый органический слой отделяют, промывают (по 2 раза порциями по 25 мл) 2 н. НCl, 2 н. раствором Na2CO3 и водой. Четыреххлористый углерод отгоняют. Остаток перегоняют в вакууме. Выход n -метоксиацетофенона – 12 г (85%); т. кип. 163 0С (28 мм рт. ст.); т. пл. 37 0С.
Ацетамид

Реактивы: этилацетат 17,6 г – (19,5 мл, 0,2 моль);
аммиак 25%-ный водный раствор – 200 мл
Посуда: трехгорлая колба; термометр; механическая мешалка; холодильник Либиха.
В трехгорлую колбу емкостью 250 мл, снабженную механической мешалкой и термометром, наливают 70 мл раствора аммиака, охлаждают смесью льда и соли до -10 0С и насыщают газообразным аммиаком, получающимся при кипячении раствора 25%-ного аммиака (130 мл). Затем при этой температуре к смеси добавляют 19,5 мл этилацетата в течение 15 мин и продолжают перемешивать в течение 1 ч. После этого реакционную смесь выливают в плоскодонную колбу с притертой пробкой и оставляют в холодильнике при температуре -15 0С на 24 ч.
Продукты реакции переливают в перегонную колбу, которую соединяют с холодильником, и без термометра под тягой отгоняют аммиак, воду и спирт до тех пор, пока в колбе не останется примерно четвертая часть первоначального объема жидкости. Остаток переливают в маленькую перегонную колбу, вставляют термометр и продолжают перегонку, пока термометр не покажет 190 0С. Тогда заменяют водяной холодильник коротким воздушным и, используя в качестве приемника небольшую коническую колбу, перегоняют ацетамид при температуре 210-216 0С. Застывший в приемнике ацетамид нагревают до плавления, переливают в фарфоровую чашку. Выход - 9,6 г (70%); т. пл. 78-81 0С.
Н-Бутилакрилат

Реактивы: метилакрилат – 8,6 г (0,1 моль);
н -бутиловый спирт – 3,7 г (0,1 моль);
п -толуолсульфокислота – 0,1 г;
гидрохинон – 0,2 г
Посуда: двугорлая колба; термометр; механическая мешалка; холодильник Либиха.
В двугорлую колбу на 100 мл, в одно из горл которой вставлена стеклянная трубка с оттянутым капилляром, помещают 3,7 г н -бутилового спирта, 8,6 г метилового эфира акриловой кислоты, 0,2 г гидрохинона и 0,1 г п -толуолсульфокислоты. К колбе елочный дефлегматор, и раствор нагревают на масляной бане до кипения. Колонка работает с закрытым краном и с полным возвратом дистиллята до тех пор, пока температура паров в головке не упадет до 62 – 63 0С, т. е. до температуры кипения азеотропной смеси «метиловый спирт – метиловый эфир акриловой кислоты». Эту азеотропную смесь отгоняют с такой скоростью, с какой она образуется, причем следят за тем, чтобы температура в головке не поднималась выше 65 0С. Когда образование метилового спирта замедлится через 6-10 ч, отгоняют избыток метилового эфира акриловой кислоты, после чего перегоняют бутиловый эфир акриловой кислоты при 39 0С (10 мм рт. ст.). Выход – 5 – 6 г (78 – 94%).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- Шабаров Ю.С. Органическая химия. Учебник для вузов. М.: Химия, 2000.
- Беккер Г., Бергер В. и др. Органикум: Практикум по органической химии. М.: Мир, 1992. Т.1, 453 с. Т.2, 442 с.
- Агрономов А.Е. Избранные главы органической химии. М: Изд-во МГУ, 1975.
- Голодников Г В., Мандельштам Т.В. Практикум по органическому синтезу. Л.: Изд-во ЛГУ, 1976. 373 с.
- Юрьев Ю.К., Левина Р.Я., Шабаров Ю.С. Практические работы по органической химии. Вып. 4. М.: Изд-во МГУ, 1969. 253 с.
- Днепровский А.С., Темникова Т.И. Теоретические основы органической химии. Л.: Химия, 1991.
- Титце Л., Айхер Т. Препаративная органическая химия. М.: Мир, 1999. 704 с.
- Бюлер К., Пирсон Д. Органические синтезы. М.: Мир, 1973. Ч.1, 620 с. Ч.2, 591 с.
- Вейганд - Хильгетаг. Методы эксперимента в органической химии.
М.: Химия, 1968. 944 с.
М. Ю. СКОМОРОХОВ, А. К. ШИРЯЕВ, Ю. Н. КЛИМОЧКИН
АЦИЛИРОВАНИЕ
Методическое пособие
Самара 2005
ОГЛАВЛЕНИЕ
| Введение…………………………………………………………………………................
1. Методы получения сложных эфиров карбоновых кислот (О-ацилирование)...
1.1. Реакции этерификации карбоновых кислот……………………...…. …...................
1.2. Ацилирование спиртов и фенолов хлорангидридами кислот…………...................
1.3. Ацилирование спиртов и фенолов ангидридами кислот…………………………...
1.4. Реакция переэтерификации (алкоголиз сложных эфиров)…………………………
2. Методы получения амидов карбоновых кислот (N -ацилирование)…………….
2.1. Ацилирование аммиака и аминов галогенангидридами и ангидридами
карбоновых кислот……………………………………………………………...........
2.2. Аммонолиз сложных эфиров……………………………………………....................
3. С-Ацилирование……………………………………………………………..................
3.1. Ацилирование ароматических соединений (реакция Фриделя-Крафтса)…………
3.2. синтез карбоциклических систем внутримолекулярным ацилированием по
реакции Фриделя-Крафтса………………………………………………....................
3.3. Ацилирование непредельных соединений………………………………..................
3.4. Ацилирование b -дикарбонильных соединений……………………...…………...
4. Экспериментальная часть……………………………………………………………
Библиографический список……………………………………………………..............
| 4
5
6
13
15
16
17
17
21
24
24
32
33
34
35
44
|
ВВЕДЕНИЕ
Реакции ацилирования органических соединений являются важнейшими методами современной синтетической органической химии. При помощи этих реакций могут быть синтезированы различные типы органических соединений, например, сложные эфиры, первичные, вторичные и третичные амиды карбоновых кислот, алифатические и ароматические кетоны, карбоциклические системы и многие другие органические соединения.
Ацилированием в органическом синтезе называют реакции введения ацильной группы (RCO-) в молекулы органических соединений путем замещения атома водорода. В более широком смысле ацилированием называют замещение любого атома или группы атомов на ацильную группу. В зависимости от типа атома, к которому присоединяется ацильная группа, различают С-ацилирование, N-ацилирование, О-ацилирование. Реакции, при которых вводится ацетильная группа (СН3СО-), называются ацетилированием, бензоильная группа (С6Н5СО-) – бензоилированием и т.д. Наиболее распространенные ацилирующие агенты - хлорангидриды и ангидриды карбоновых кислот (табл. 1, 2).
Таблица 1. Основные производные насыщенных карбоновых кислот
| Карбоновая кислота
| HCOOH
Муравьиная
| CH3COOH
Уксусная
| CH3CH2COOH
Пропионовая
| CH3CH2CH2COOH
Масляная
|
| Ацильный остаток
|  Формил
Формил
|  Ацетил
Ацетил
|  Пропионил
Пропионил
|  Бутирил
Бутирил
|
| Хлорангидрид
кислоты
| -
|  Ацетилхлорид
Ацетилхлорид
|  Пропионилхлорид
Пропионилхлорид
|  Бутирилхлорид
Бутирилхлорид
|
| Ангидрид
кислоты
| -
|  Уксусный ангидрид
Уксусный ангидрид
|  Пропионовый ангидрид
Пропионовый ангидрид
|  Масляный ангидрид
Масляный ангидрид
|
| Первичный амид кислоты
|  Формамид
Формамид
| 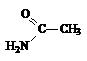 Ацетамид
Ацетамид
|  Пропиоамид
Пропиоамид
|  Бутирамид
Бутирамид
|
| Этиловый эфир кислоты
| HCOOC2H5
Этилформиат
| CH3COOC2H5
Этилацетат
| CH3CH2COOC2H5
Этилпропионат
| CH3CH2CH2COOC2H5
Этилбутират
|
Таблица 2. Основные производные ненасыщенных и ароматических карбоновых кислот
| Карбоновая кислота
|  Акриловая
Акриловая
|  Метакриловая
Метакриловая
|  Бензойная
Бензойная
|  1-Нафтойная
1-Нафтойная
|
| Ацильный остаток
|  Акрилоил
Акрилоил
|  Метакрилоил
Метакрилоил
|  Бензоил
Бензоил
|  1-Нафтоил
1-Нафтоил
|
| Хлор - ангидрид
кислоты
|  Акрилоилхлорид
Акрилоилхлорид
|  Метакрилоил-хлорид
Метакрилоил-хлорид
|  Бензоилхлорид
Бензоилхлорид
|  1-Нафтоилхлорид
1-Нафтоилхлорид
|
| Первичный амид кислоты
|  Акриламид
Акриламид
|  Метакриламид
Метакриламид
|  Бензамид
Бензамид
| 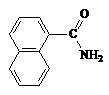 1-Нафтамид
1-Нафтамид
|
| Этиловый эфир кислоты
|  Этилакрилат
Этилакрилат
|  Этилметакрилат
Этилметакрилат
|  Этилбензоат
Этилбензоат
|  Этил-1-нафтоат
Этил-1-нафтоат
|



 Формил
Формил
 Ацетил
Ацетил
 Пропионил
Пропионил
 Бутирил
Бутирил
 Ацетилхлорид
Ацетилхлорид
 Пропионилхлорид
Пропионилхлорид
 Бутирилхлорид
Бутирилхлорид
 Уксусный ангидрид
Уксусный ангидрид
 Пропионовый ангидрид
Пропионовый ангидрид
 Масляный ангидрид
Масляный ангидрид
 Формамид
Формамид
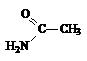 Ацетамид
Ацетамид
 Пропиоамид
Пропиоамид
 Бутирамид
Бутирамид
 Акриловая
Акриловая
 Метакриловая
Метакриловая
 Бензойная
Бензойная
 1-Нафтойная
1-Нафтойная
 Акрилоил
Акрилоил
 Метакрилоил
Метакрилоил
 Бензоил
Бензоил
 1-Нафтоил
1-Нафтоил
 Акрилоилхлорид
Акрилоилхлорид
 Метакрилоил-хлорид
Метакрилоил-хлорид
 Бензоилхлорид
Бензоилхлорид
 1-Нафтоилхлорид
1-Нафтоилхлорид
 Акриламид
Акриламид
 Метакриламид
Метакриламид
 Бензамид
Бензамид
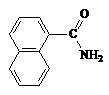 1-Нафтамид
1-Нафтамид
 Этилакрилат
Этилакрилат
 Этилметакрилат
Этилметакрилат
 Этилбензоат
Этилбензоат
 Этил-1-нафтоат
Этил-1-нафтоат