Допустимая норма суточного потребления
История вопроса
Экспертный комитет ФАО/ВОЗ по пищевым добавкам (ОКЭПД) оценил возможность использования кверцетина в качестве пищевого красителя в продуктах питания (ОКЭПД, 1978). На основании имеющихся на тот момент ограниченных данных о токсичности для проведения анализа, было невозможно установить допустимую норму суточного потребления. Международное агентство по изучению рака (МАИР) провело оценку потенциального риска канцерогенности кверцетина для людей в 1998 году (МАИР, 1999). На основании доступных экспертному совету МАИР данных, кверцетину была присвоена 3-я категория по классификации канцерогенных факторов (т.е. не классифицируемые как канцерогенные для человека). Хотя при ограниченном объеме данных о канцерогенности среди животных, свидетельства о канцерогенности для человека были признаны недостаточными.
Совокупность имеющихся данных
Безопасность кверцетина высокой степени очистки (99,5 %), производимого компанией «Кирсежин», основана на опубликованных результатах коротко- и долгосрочных исследованиях доклинической токсичности, эмбриофетотоксичности и репродуктивной токсичности, канцерогенности, мутагенности/генотоксичности invitro и invivo, а также нескольких ранее опубликованных и четырех недавних исследованиях кверцетина, подтверждающих ранее полученные результаты. Основным исследованием токсичности стало двухгодичное исследование хронической токсичности и канцерогенности при кормлении крыс, проведенное в рамках Национальной Токсикологической программы (НТП) (Данник и Хейли, 1992; НТП, 1992). Результаты других исследований мутагенности и генотоксичности при приеме высоких доз кверцетина подтверждают ранее полученные данные о безопасности природного флавоноида. Дополнительная информация, подтверждающая безопасность кверцетина, представлена несколькими клиническими и эпидемиологическими исследованиями с участием людей. Таким образом, совокупность научных данных, полученных из долгосрочных исследований токсичности и канцерогенности кверцетина, получаемого с пищей, показала отсутствие токсичности, канцерогенности и влияния кверцетина на образование опухолей.
Совокупность имеющихся сведений подтверждает безопасность кверцетина высокой степени очистки, производимого компанией «Кирсежин» при его использовании в качестве пищевой добавки. Таблица 8.2-1представляет обобщенную информацию об основных данных исследований хронической токсичности, которые подтверждают заключение, что допустимая норма суточного потребления в пределах 19-22 мг/день на 1 кг массы тела является научно обоснованной и достаточной для гарантии безопасности при соблюдении условий применения. Опубликованные и подтвержденные результаты исследований с участием людей, в ходе которых назначался препарат в количестве 1500 мг/день (25 мг/день на 1 кг массы тела при средней массе тела человека – 60 кг) в течение 12 недель, показали его безопасность, и, таким образом, подтверждается указанную допустимую норму суточного потребления кверцетина высокой степени очистки (Конкер и соавт., 1998; Кьюртон и соавт., 2009; Дэвис и соавт., 2010; Думке и соавт., 2009; Генсон и савт., 2008; МакАнулти и соавт., 2008; Ниман и соавт., 2007a,b,c, 2009; Куиндри и соавт., 2008; Шанели и соавт., 2010; Ниман, 2008 (неопубликовано); «Призм Рисёрч, 2010a,b,c (неопубликовано)).
|
Таблица 8.2-1 Допустимая норма суточного потребления согласно совокупности имеющихся данных
|
| Основание для допустимой нормы суточного потребления (фактор безопасности)
| Основные данные1
| Допустимая норма суточного потребления (мг/день на 1 кг массы тела)
|
| НТП, 1992 год
Хроническая токсичность/карценогенность (100х)
| ППУСТ = 2200 мг/день на 1 кг массы тела
| 22
|
| Ито и соавт., 189 год
Хроническая токсичность/карценогенность (100х)
| ППУСТ = 1900 мг/день на 1 кг массы тела
| 19
|
| Вывод
|
| 19-22
|
1 В каждом указанном случае основные данные представляют максимальные значения назначаемых доз вещества в проводимом исследовании
Краткий обзор
На основании 2 двухгодичных исследований, в которых вещество давалось крысам при кормлении (Ито и соавт., 1989; НТП, 1992), были установлены схожие значения ППУСТ, составляющие 1900-2200 мг/день на 1 кг массы тела. Опубликованные результаты поздних исследований подтверждают вывод о безопасности для потребителя приема препарата в количестве до 1500 мг/день. Совокупность имеющихся сведений, полученных из вышеуказанных исследований, подтверждает безопасность кверцетина высокой степени очистки, производимого компанией «Кирсежин».
9.0 Основание для определения вещества как общепринятого безопасного продукта (GRAS)
Нормативная база
Нормативная база для определения, может ли вещество считаться общепринятым безопасным (GRAS), соответствует разделу 201 (s) (Кодекс США 21, § 321 (s)) Федерального Закона о пищевых продуктах, лекарственных средствах и парфюмерно-косметических товарах (Кодекс США 21, § 301 и далее) («Закон») и изложен в разделе 21 Свода федеральных нормативных актов 170.30, где указано:
Общее признание безопасности может основываться только на мнении экспертов, получивших научное образование и имеющих опыт оценки безопасности веществ, прямо или косвенно добавляемых в пищевые продукты. Основанием для формулирования мнения могут быть (1) научные методики или (2) в случае, если вещество использовалось в пищевых продуктах до 1 января 1958 года, на общепринятом опыте использования вещества в продуктах питания. Общее признание безопасности требует наличия доступной информации о веществе, полученной от научного сообщества, хорошо осведомленного о вопросах безопасности веществ, прямо или косвенно добавляемых в пищевые продукты.
Общее признание безопасности, основанное на проведении научных методик, требует соответствия количества и качества научных данных таковым, необходимым для получения согласования технических требований к пищевым добавкам, входящим в состав продуктов питания. Общее признание безопасности на основании научных методик должно основываться на опубликованных результатах исследований, которые могут быть подтверждены неопубликованными результатами исследований или другой информацией.
Вышеуказанные критерии лежат в основе проводимого набазе научных методик анализа, является ли кверцетин, используемый в качестве пищевой добавки в выбранной категории продуктов питания (напитки и концентраты для приготовления напитков, мучные и макаронные изделия, переработанные фрукты и фруктовые соки, мягкие конфеты), общепринятым безопасным веществом.
Заключение: присвоение статуса GRAS
Безопасность кверцетина была проверена с использованием целого ряда опубликованных токсикологических и иных исследований вопросов, связанных с безопасностью. Механизмы всасывания, распределения, метаболизма и выведения (ADME) кверцетина у лабораторных животных и человека хорошо изучены и были описаны в доступных отчетах об исследованиях. Понимание механизмов ADME кверцетина позволило получить широкий массив данных для проведения оценки безопасности. Исследования безопасности кверцетина включали изучение острой, субхронической, хронической (канцерогенности) токсичностей, эмбриофетотоксичности, репродуктивной токсичности на лабораторных животных, а также ряд исследований генотоксичности вещества. В клинических исследованиях оценивалось потенциальное влияние кверцетина на ферментные системы цитохрома Р-450, Р-гликопротеин и уровень глюкозы в крови больных сахарным диабетом.
Совокупность имеющихся данных, как опубликованных, так и неопубликованных, но подтверждающих выдвинутые гипотезы, дает основание для заключения, что прием кверцетина с пищевыми продуктами, описанный в «Замечании об удовлетворении требованиям стандарта безопасности GRAS при обоснованной достоверности непричинения вреда» и при употреблении допустимой нормы суточного потребления, равной 19-22 мг/день на 1 кг массы тела (в форме кверцетина), которая подтверждается имеющимися сведениями, является допустимым с точки зрения безопасности.
Наконец, имеющиеся данные и сведения известны и приняты экспертным советом научного сообщества. Таким образом, информационная база не только гарантирует безопасность намеренного употребления кверцетина, но и подтверждаетобщеизвестное положение, что кверцетин признан безопасным при соблюдении условий применения.
Общие выводы о безопасности препарата
Кверцетин (регистрационный номер CAS 117-39-5), встречающийся в природе флавонол, является агликоном кверцитрина, рутина и других гликозидов, принадлежащих к обширной группе красящих веществ растительного происхождения, называемых флавоноидами (Мерк индекс, 2006). Кверцетин изготавливается отделом натуральных продуктов компании «Кирсежин Агрунегосиус 1 Лтда» (ранее – «Мерк С/А, Бразилия») в соответствии с действующими стандартами надлежащей производственной практики (GMP) и соответствующими спецификациями для пищевых продуктов. Технологический процесс изготовления кверцетина состоит в экстракции глюкозида кверцетина, рутина, из плодов бразильского растения семейства бобовых Favad’Anta (Dimorphandra mollis) или листьев ункарии (Uncaria), гидролиза гликозидадля получения агликона и всесторонней поэтапной очистки. В целях гарантии стабильности препарата, компанией «Мерк С/А» были разработаны строгие химические и микробиологические спецификации. Образцы серий препарата постоянно проверяются на соответствие этим спецификациям. Для соответствия спецификации результаты анализа проб должны не менее чем на 99,5 % соответствовать контрольным значениям кверцетина при проведении ВЭЖХ. При проведении 60-месячного исследования стабильности нерасфасованного кверцетина в форме сухого порошка, хранимого в пластиковых пакетах при температуре 30 ±2°С и относительной влажности70±5%, 24-месячного исследования стабильности кверцетина в форме сухого порошка, хранимого в пластиковых пакетах при температуре 30 ±2°С и относительной влажности75±5% и 6-месячных исследований кверцетина в форме сухого порошка, хранимого в пластиковых пакетах при температуре 30 ±2°С и относительной влажности70±5% и при температуре 40 ±2°С и относительной влажности75±5% кверцетин показал устойчивую стабильность при указанных условиях хранения.
Пищевой кверцетин высокой степени очистки, изготовленный компанией «Кирсежин», будет добавлен в состав многих пищевых продуктов, в том числе в напитки, концентраты для приготовления напитков, крупяные и макаронные изделия, переработанные фрукты, фруктовые соки и мягкие конфеты. В зависимости от типа пищевых продуктов кверцетин может использоваться в качестве пищевого ингредиента в количестве до 500 мг на порцию. При учете возможных условий употребления ингредиента среднестатистические значения совокупного потребления кверцетина человеком, полученные при традиционном подходе, составляют 205 мг на 1 человека в день или 4 мг/кг веса в день. При активном совокупном приеме потребителями (90-й процентиль) кверцетина из всех возможных пищевых продуктов доза вещества составила 461 мг на 1 человека в день или 9 мг/кг веса в день. Для полноты сведений совокупныйприем потребителями кверцетина из всех возможных пищевых продуктов был посчитан и для младенцев (в возрасте от 0 до 2 лет) и составил 53 мг/кг веса в день (при 90-м процентиле). Однако стоит отметить, что категории пищевых продуктов для предлагаемого добавления кверцетина не рассчитаны для приема младенцами, поскольку целевой группой являются взрослые люди, ведущие активный образ жизни. Таким образом, ожидается, что прием пищи, обогащенной кверцетином, младенцами и детьми будет строго ограничен. Соответственно, на основе массы тела, посчитанный 90-й процентиль совокупного приема кверцетина детьми и младенцами может считаться весьма переоцененным значением действительного воздействия вещества на младенцев при добавлении кверцетина в продукты питания.
В действительности кверцетин высокой степени очистки рекомендован в качестве добавки к выбранным категориямпродуктов питания и напитков для специального/функционального приема целевой группой потребителей, занимающихся спортом, и будет реализовываться прежде всего через специализированные каналы сбыта (сеть магазинов спортивного и функционального питания GNC, магазины спортивных товаров). Таким образом, оценки воздействия на младенцев и детей не только являются нереалистичными, но и не отражают целей планируемого употребления продукта. Среди взрослых потребителей, которые сознательно приобретают продукты питания и напитки, обогащенные кверцетином высокой степени очистки, количество потребляемого вещества оценивается в 1000 мг/день. Возможно, что взрослые потребители, занимающиеся спортом, при выборе кверцетина высокой степени очистки могут принимать от двух до четырех порций препарата в день в течение непродолжительных периодов времени, так, например, при приеме трех доз вещества в течение пяти дней организм получает от 1250 до 1500 мг/день. Однако длительный прием указанных доз является маловероятным при следовании описанному рациону питания. Предполагаемое ежедневное максимальное количество препарата, принимаемое целевой группой взрослых потребителей, занимающихся спортом, считается безопасным, что подтверждается многочисленными данными о доклинической и клинической безопасности кверцетина.
Обычные овощи и фрукты, употребляемые в пищу, такие как лук и яблоки, являются основными источниками кверцетина, которые содержат флавонол в количестве приблизительно 350 ppm (в виде агликона) (Дэй, Вильямсон, 1999). В Соединенных Штатах Америки потребление гликозидов флавонола в форме эквивалентов кверцтина при среднестатистической диете составляет примерно 100 мг/день, однако, среди активных потребителей овощей и фруктов, как отмечалось, количество кверцетина может достигать значений 250-500 мг/день (Джонс, Хью, 1982). Среднее значение и 90-й процентиль суммарного потребления кверцетина из продуктов растительного происхождения населением США составили 5,9 и 14,7 мг/день на 1 человека соответственно. Эти значения были получены на основании данных о содержании кверцетина в продуктах питания, содержащихся в базе данных флавоноидов и статистических данных NHANES (Национальная программа проверки здоровья и питания (США)) за 2003-2004 годы о питании (Центр Контроля Заболеваний (CDC), 2006; База данных продуктов питания (USDA), 2009a). Кроме того, было посчитано максимальное количество кверцетина для ежедневного потребления, которое составило 258,2 мг/день. Это значение представляет зарегистрированное максимальное значение количества кверцетина, потребленного из натуральных источников, среди мужского и женского населения. Представленная информация основана на утверждении, что кверцетин доступен только в специализированных продуктах питания, вероятно, что при фоновом приеме значения могут быть выше ожидаемых.
Максимальное суточное количество потребляемого кверцетина при фоновом приеме из природных источников (Таблица 5.1.2-1) составило 258,2 мг/день, т.е. значение входит в пределы потребления,составляющие 200-500 мг/день при приеме овощей и фруктов (Джонс, Хью, 1982). Таким образом, целевая группа потребителей, которые получали по 1000 мг кверцетина высокой степени очистки и которые также могли потреблять в большом количестве фрукты и овощи, могли получать примерно 1250 мг кверцетина в день. Такое ежедневное количество кверцетина читается безопасным согласно совокупности имеющихся данных.
После приема свободного агликона кверцетина может происходить его активное микробное разложение в желудочно-кишечном тракте перед всасыванием. После чего кверцетин или его производные всасываюсь в желудочно-кишечном тракте и позднее быстро и экстенсивно метаболизируются. Различные пути, вовлеченные в процесс метаболизма кверцетина, представленые ниже (рисунок 7.0-1), взаимодействуют с целью ограничения биодоступности кверцетина invivo и предупреждения потенциальных нежелательных эффектов, связанных с его употреблением. Наконец, конъюгаты кверцетина после завершения метаболизма выводятся с мочой, неметаболизированный кверцетин или продукты бактериального распада производных кверцетина выводятся с калом, метаболиты кверцетина секретируются через желчь или выводятся с углекислым газом при выдохе. Следует отметить, что кверцетин, являясь одним из многих природных флавоноидов, широко распространен в рационе питания человека. Таким образом, адаптивные механизмы, такие как экстенсивный метаболизм, препятствующий появлению нежелательных эффектов, не могут быть прерваны.
Рисунок 7.0-1 Схематическая презентация абсорбции, метаболизма и выведения кверцетина у млекопитающих
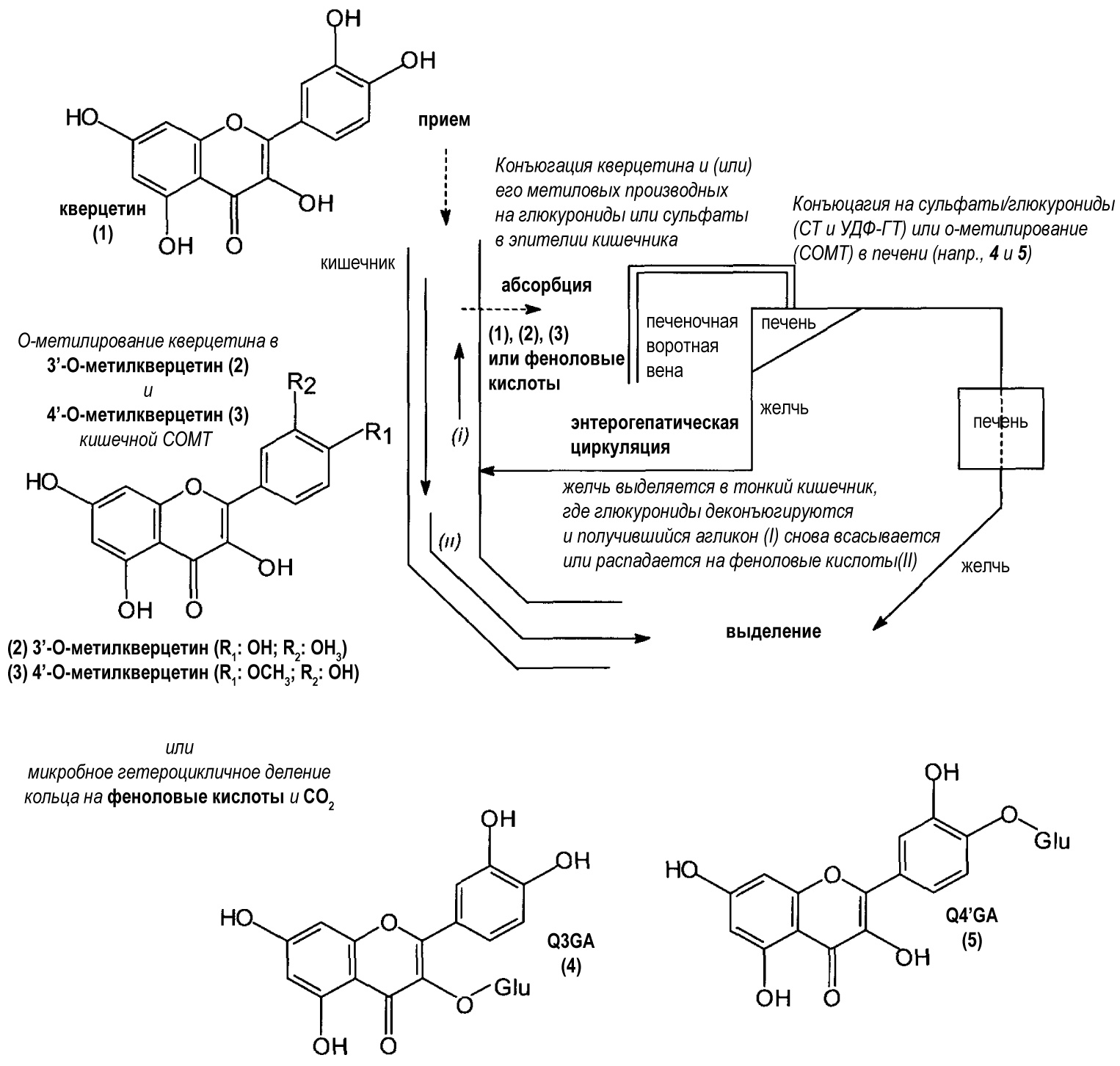
Приведено по Дэю и Вильямсону (1999)
На основании совокупности имеющихся данных можно заключить, что при пероральном применении кверцетин не оказывает негативного влияния на следующие биохимические явления.
Данные, полученные в результате исследования invitro, о том, что кверцетин ингибирует всасываемость моносахаридов, сомнительны (Квон и соавт., 2007; Сермак и соавт., 2005; Барренеткс и соавт., 2006), поскольку доступные результаты исследования показывают, что при ежедневном приеме человеком 1500 мг кверцетина в жидкой форме в течение пяти дней не влияет на уровень глюкозы в крови в сравнении в группой пациентов, страдающих сахарным диабетом 2 типа и принимавших плацебо («Призм Рисёрч», 2010а).
Данные, полученные в результате исследования invitro, показывают, что кверцетин может стимулировать или подавлять активность метаболических ферментов, относящихся к семейству P450 и (или) субстратов P-гликопротеина. В большинстве случаев данные исследований на животных соответствуют результатам исследования invitro при пероральном назначении кверцетина перед приемом лекарства (Хсиу и соавт., 2002; Чой и соавт., 2004а; Чой, Хан, 2004; Чой, Ли, 2005; Умат и соавт, 2008; Бансал и соавт., 2008; Ванг и соавт., 2004; Шин и соавт., 2006; Ли и Чой, 2009). Однако многочисленные данные исследований среди людей не подтверждают вывод о влиянии кверцетина на биодоступность лекарственного препарата, поскольку в 5 из 7 исследований изменений биодоступности лекарственного препарата после последовательного приема кверцетина в количестве 1500 мг/день отмечено не было (Рашид и соавт., 1993; ДиЧенцо и соавт., 2006; Чой и соавт., 2004b; Ким и соавт., 2005 2009; «Призм Рисёрч», 2010b,c).
Хотя кверцетин обладает антиоксидантными свойствами, в некоторых условиях invitro он выступал как прооксидант (так называемый «парадокс кверцетина») (Бутс и соавт., 2007). В условиях invivo существует множество механизмов защиты от возможного прооксидантного эффекта кверцетина (напр., низкая биодоступность кверцетина при пероральном применении, метилирование, психологические состояния, связывание с альбумином и др.) (Бутс и соавт., 2007; Гарвуд и соавт., 2007).
В качестве антиоксиданта глуатион связывается с химически активным кверцетином и в таком виде существует до распада глуатиона после приема кверцетина, однако, при анализе уровня глуатиона у людей, в течение продолжительного времени принимавщих кверцетин (1000 мг в течение 12 недель), влияния на окисление или уменьшение уровня глуатиона отмечено не было (Ниман, 2008; Шанели и соавт., 2010).
Результаты многочисленных исследований мутагенности и генотоксичности invitro показали устойчивые мутагенные эффекты, связанные с приемом кверцетина, однако, сходные результаты были получены в исследовании invitro других антиокислителей (напр., витамина С, третичного бутилгидрохинона), благодаря из прооксидантным свойствам при нереалистично высоких концентрациях invitro; в условиях invivo такие результаты не достижимы. Более того, мутагенные свойства кверцетина, наблюдаемые в условиях invitro,не были зафиксированы в условиях invivo при пероральном применении, о чем свидетельствует, по меньшей мере, 10 исследований. Это расхождение между положительными результатами исследования in vitro и негативными результатами исследования invivo может быть объяснено ограниченным всасыванием invivo кверцетина в виде агликона, экстенсивным микробным распадом в кишечнике и пост-абсрбционным ферментным метаболизмом, - факторами, выступающими совместно для ограничения потенциальных нежелательных эффектов в условиях invivo после приема кверцетина.
Потенциальные канцерогенные свойства кверцетина проверялись в многочисленных долгосрочных исследованиях на животных; в большинстве из них случаев образования опухолей зафиксировано не было (Амброз и соавт., 1951; Саито и соавт., Хироно и соавт., 1981; Хосака и Хироно, 1981; Морино и соавт., 1982; Тканаши и соав., 1983, Стоевсанд и соавт., 1984; Ито и соавт., 1989; НТП, 1992). Исследование НТП показало влияние дозы кверцетина на организм, в том числе значительное снижение массы тела и мужчин и женщин, а также прогрессирование хронической нефропатии, гиперплазии и бластом тубулоэпителиальной системы почек (провоцирующих в основном доброкачественные опухоли тубулоэпителиальной системы почек) у мужских особей крыс (у женских особей наличия подобных эффектов не было зарегистрировано) при воздействии 40 000 ppmкверцетина (средняя доза составила около 2200 мг/день на 1 кг массы тела) в рационе животных в течение 2 лет. На этом основании был сделан вывод, что в условиях исследования существует некоторая вероятность канцерогенной активности кверцетина среди мужских особей крыс F344/N, связанная с увеличением случаев тубулярной аденомы почек, при отсутствии канцерогенной активности кверцетина на особей женского пола крыс F344/N. При дальнейшей переоценке повреждений почек Хард и соавт. (2007) заключили, что наблюдаемые в исследовании отклонения в тканях почек мужских особей крыс явились результатом побочного механизма образования почечных опухолей (а именно обострения хронической прогрессирующей нефропатии поздней стадии) при отсутствии экстраполяции на человека. За неимением разницы в выживаемости группы животных, которым назначался кверцетин, и контрольной группы животных морфологические отклонения или токсическое влияние, оказываемые на внутренние органы, изменение массы тела и наблюдаемые в группе приема высоких доз препарата и контрольной группе крыс, не оцениваются как нежелательные эффекты. Согласно исследованию НТП биологически значимых нежелательных эффектов,при ежедневном приеме кверцетина в количестве 2200 мг на 1 кг массы тела и ниже не ожидается. Этот вывод подтверждается другим долгосрочным исследованием токсичности и канцерогенности, проводимым не только на крысах, но и на хомяках и мышах, котороепоказало отсутствие значимых гистопатологичесих эффектов, включая таковые со стороны почек, при сходных и даже более высоких дозах препарата (вплоть до 12 г/день на 1 кг массы тела) (Амброз и соавт., 1951; Саито и соавт., 1980; Памуку и соавт., 1980; Хироно 1981; Хосака и Хироно, 1981; Морино и соавт., 1982; Таканаши и соавт., 1983; Строевсанд и соавт., 1984; Ито и соавт., 1989). Но основании всех имеющихся данных многочисленных долгосрочных исследований на животных можно заключить, что кверцетин не оказывает канцерогенного влияния на почки и (или) другие органы и ткани при постоянном присутствии в рационе питания лабораторных животных.
Были проведены дополнительные экспериментальные двухэтапные (инициация - стимулирование) исследования канцерогенности, в которых изучался кверцетин во взаимодействии со стандартными химическими канцерогенами. Хотя в нескольких немногочисленных исследованиях указывалось усиление активности, вызванное кверцетином (Вернер и соавт., 1985; Жу и Льехр, 1994; Перейра и совт., 1996; Баротто и соавт., 1998; Матсукава и соавт., 2002; Валентик и соавт., 2006), результаты большинства исследований показывают отсутствие связи прогрессирования канцерогенеза с приемом кверцетина или его хемозащитных свойств (Морино и соавт., 1982; Фукушима и соавт., 1983; Хироз и соавт.,1983; Като и соавт., 1984, 1985; Сато и соавт., 1987; Ито и соавт., 1988; Верма и соавт., 1988; Дешнер и соавт., 1991; Акаджи и соавт., 1995; Эксон и соавт., 1998; Танака и соавт., 1999;Янг и соавт., 2000; Волат и соавт., 2005; Чой и соавт., 2006; Девиприйя и соавт., 2006; Дихал и соавт., 2006; Джин и соавт, 2006). Эти исследования служат подтверждением отсутствия, вызванного приемом кверцетина, образования опухолей в целом ряде органов, в том числе в почках, толстом кишечнике и мочевом пузыре, о чем свидетельствует малое количество новообразований в группе испытуемых, которым назначался исключительно кверцетин.
Совокупность данных исследований субхронической и хронической токсичности у разных особей при приеме кверцетина с пищей не показывает значительной системной токсичности. Значения предпорогового уровня системной токсичности (ППУСТ) составляют 2203 и 2231 мг/день на 1 кг веса для особей мужского и женского пола (НТП, 1992) или 1926 и 2372 мг/день на 1 кг веса для особей мужского и женского пола (Ито и соавт., 1989) соответственно, которые были определены в ходе указанных исследований.
Доступная информация показывает, что кверцетин при пероральном назначении не обладает репродуктивной токсичностью или эмбриофетотоксичностью. При исследовании клеточных культур invitro и при внутрибрюшном введении грызунам, кверцетин не метаболизировался кишечной микрофлорой до контакта с половыми клетками, которые могут рассматриваться как патологические клетки и (или) наблюдался эффект на репродуктивную функцию (Насс-Арден и Брейсбарт, 1990; Свишер и соавт., 1994 (резюме); Трехо и соавт., 1995; Хандуйя и соавт., 2001). При этом в исследованиях на грызунах invivo, в которых кверцетин назначался перорально и соответственно имели место метаболизм микрофлорой кишечника и пресистемный метаболизм, патологий в сперме, эмбриофетотоскичности и влияния на репродуктивные функции отмечено не было. При пероральном назначении кверцетина особям мужского пола швейцарских мышей-альбиносов в количестве 150 мг/день на 1 кг веса препарат не вызвал значительного учащения патогенности спермы (Нандан и Рао, 1983).Эмбриофетотоксичности или тератогенных патологий у беременных крыс, вызванных пероральным приемом кверцетина в дозировке вплоть до 2000 мг на 1 кг веса в день, отмечено не было (днигестации от 6 до 15) (Вилльхайт, 1982). В исследовании репродуктивной способности одного поколения крыс и мышей, в котором содержание кверцетина в рационе животных достигало 0,2 %, не было отмечено разницы в репродуктивных показателях и показателях развития, в том числе родовых показателях, показателях средней жизнеспособности плода, живорождения, выживаемости на 3-й день жизни, лактации, массы при рождении и на 21-й день жизни (Стоевсанд и соавт., 1984).
Клинические данные о безопасности кверцетина были получены в ходе рандомизированных двойных слепых клинических исследований (Шоскес и соавт., 1999; Кайзеветтер и соавт., 2000; Лозойа и соавт., 2002; Ниман, 2008; Шанели и соавт., 2010). Лозойя и соавт. (2002) исследовали краткосрочную безопасность фитолекарства, содержащего стандартное количество кверцетина (1 мг флавоноидов в виде кверцетина), в то время как Кайзеветтер и соавт. (2000) оценивали безопасность экстракта красных листьев винограда в течение 12 недель, в котором содержался кверцетин-3-О-бета-гликозид и изокверцетин (данные об их количестве отсутствуют). Нежелательных эффектов, связанных с приемом компонента, ни в одном из указанных исследований отмечено не было, в том числе отсутствия различий в результатах клинических анализов. Также нежелательных эффектов не было отмечено в исследовании эффективности, в котором кверцетин назначался мужчинам ежедневно в дозировке 16,7 мг на 1 кг массы тела (Шоскес и соавт., 1999). Недавно было проведено рандомизированное двойное слепое плацебо-контролируемое 12-тинедельное клиническое исследование, в котором 1002 субъекта принимали плацебо / 500 мг кверцетина / 1000 мг кверцетина ежедневно (Ниман, 2008; Шанели и соавт., 2010). Кверцетин принимался дважды в день в виде жевательных таблеток. Во время исследования значимых различий между группами испытуемых в части химических показателей отмечено не было, за исключением понижения уровня креатинина в сыворотке крови и повышения уровня клубочковой фильтрации в группах, принимавших кверцетин. Различий в части наличия нежелательных эффектов или понижения уровня глутатиона или его окислению среди трех групп отмечено не было. Средние показатели артериального давления понизились в группах приема кверцетина по сравнению с группой плацебо. Было заключено, что включение в рацион от 500 до 1000 мг кверцетина в день на протяжении 12 недель во время исследования является безопасным, поскольку нежелательных симптомов или изменений в биохимии крови и показателей глуатиона не было отмечено.
Были проверены результаты двух других 4-хнедельных исследований, в которых оценивался потенциальный эффект кверцетина (730 мг/день) на артериальное давление среди субъектов с гипертонией и в прегипертоническом состоянии (Джалили и соавт., 2006 (резюме); Эдвардс и др., 2007).Нежелательных эффектов в обоих исследованиях не было отмечено, понижение артериального давления наблюдалось только у больных гипертонией. Нежелательных эффектов в течение 6 недель приема кверцетина (150 мг/день) не было отмечено, однако, кверцетин снижал систолическое давление и концентрацию окисленного холестерина ЛПНП в плазме крови у субъектов с фенотипом высокой вероятности сердечно-сосудистых заболеваний (Егерт и соавт., 2009). В исследовании, в котором ежедневная доза кверцетина 60 мг принималась в комбинации с куркумином, пациентами с семейным аденоматозным полипозом (САП) в течение 6 месяцев, изменений клинических показателей в сравнении с начальными значениями отмечено не было (Круз-Кореа и соавт., 2006).
В нескольких исследованиях, проведенных с целью изучения возможных потенциальных эффектов кверцетина, оказываемых на иммунную систему, оксидативный стресс, вызванный физической нагрузкой, или функционирование, при ежедневном прием 600-1000 мг кверцетина здоровыми субъектами в течение от одной до шести недель, не было отмечено нежелательных эффектов (Кюретон и соавт., 2009; Дэвис и соавт., 2010; Думке и соавт., 2009; Хенсон и соврт., 2008; МакРе и Мефферд, 2006; МакАнулти и соавт., 2008; Ниман и соавт., 2007a,b.c, 2009, 2010; Квиндри и соавт., 2008).
В дополнение к контролируемым клиническим испытаниям, значительное количество эпидемиологических отчетов подтверждают отсутствие какой-либо связи потребления флавоноидов в диете (до 68 мг/день) и повышением риска возникновения рака (Хертог и соавт., 1994, 1995; Голдбом и соавт., 1995 (резюме); Нект и соавт., 1997, 2002; Лэм и соавт., в СМИ; Лин и соавт., 2006).
Наиболее часто случаи, не связанные с безопасностью, сообщались в трех подтверждающих фармакокинетических исследованиях: два invivo исследования взаимодействия лекарственных препаратов (а именно варфарин и дигоксин) проводились с приемом кверцетина среди здоровых субъектов так же, как и оральный глюкозотолерантный тест (ОГТТ) среди пациентов с диабетом 2-го типа («Призм Рисёрч», 2010а,b,c). Кроме того, о нежелательных явлениях в ходе проведения обозначенных исследований не сообщалось. Данные о фармакокинетике показали, что ни показатели содержания варфарина и дигоксина в плазме крови, ни уровень глюкозы в крови у пациентов с диабетом 2-го типа не изменились при совместном назначении кверцетина и обозначенных препаратов.
Продукты, приводящие к возможному распаду кверцетина (флороглюцинол, флороглюциновая кислота, протокатеховая кислота), весьма распространены в природе и не оказывают нежелательных эффектов на организм человека. О признаках токсичности среди крыс, получавших в диете пироглутаминовую кислоту в концентрации 1000 ppm (приблиз. 50 мг/день на 1 кг массы тела) в течение 32 недель не сообщалось (Танака и соавт., 1993). Не было отмечено нежелательных эффектов среди мышей, получавших 0,01 %-ный водный раствор протокатеховойкислоты в течение 60 дней (Намикура и соавт., 2001). В клиническом исследовании с участием людей, проводимом с целью оценки эффективности флороглюцинола (80 мг/день), оказываемой на ускорение производительности, не наблюдалось нежелательных явлений, кроме того, нежелательных явлений не наблюдалось у беременных женщин и плодов (Табассум и соавт., 2005). Также сведения, связанные с метаболизмом флороглюцинола и протокатеховой кислоты, показывают, что обакомпонента так же, как и кверцетин, подвержены экстенсивным метаболическим реакциям фазы 1 и фазы 2 с последующим всасыванием; по окончании метаболизма они быстро выводятся из организма (Долло и соавт., 1999; Ксу и соавт., 2007).Таким образом, при распаде немигрированного кверцетина на эти компоненты нежелательных эффектов на организм человека не оказывается.
Совокупные научные данные, представленные в настоящем документе, показывают, что при условии намеренного использования в продуктах питания кверцетин не оказывает нежелательных эффектов на организм потребителей. Многочисленные публикации приводят данные, полученные из исследований с участием животных и людей, об ограниченной биодоступности при пероральном применении кверцетина (в виде агликона) с быстрым и экстенсивным метаболизмом принятой порции и последующим эффективным ее выведением.Безопасность кверцетина подтверждается опубликованными отчетами о продолжительных исследованиях токсичности и канцерогенности препарата среди животных, а также недавно проведенными опубликованными клиническими исследованиями с участием людей и эпидемиологическими исследованиями, подтверждающими отсутствие токсикологических эффектов при реализации исследовательских сценариев, соответствующих условиям намеренного потребления вещества с продуктами питания. Совокупность представленных в настоящем документе данных о влиянии вещества на человека и животных показывает, что кверцетин соответствует техническим характеристикам высокой чистоты, предъявляемым к продуктам питания и является общепринятым безопасным продуктом (GRAS) согласно результатам проведенных научных методик, при условии намеренного приема с продуктами питания.







