

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
Топ:
Оснащения врачебно-сестринской бригады.
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Термодинамический и электрокинетический потенциалы поверхности минерала и их влияние на флотационные свойства
Дзета-потенциал (ξ) называется электрокинетическим или дзета-потенциалом. Знак дзета-потенциала зависит от знака заряда внутренней обкладки двойного слоя. Если в поверхности преобладают катионы, то дзета-потенциал будет положительным. Если в поверхностном слое наблюдается избыток анионов, то дзета-потенциал имеет отрицательный заряд.
Термодинамический (полный, электрохимический) потенциал ε, который можно характеризовать как разность потенциала между внешней обкладкой и внутренней обкладкой по физической границе минерала. Электрокинетический потенциал всегда меньше электрохимического и составляет его часть.
Состав и строение минералов. Типы химических связей в кристалле и их влияние на флотационные свойства
Структура кристалла − пространственное расположение атомов, ионов или молекул в кристаллах. Изоморфные вещества − это такие атомы или ионы, которые могут взаимно замещается в кристаллической решетке, которая остается формально без существенных изменений. В кристаллах минералов можно различить − ионные, ковалентные и Ван-дер-ваальсовые силы связи.
Ионная связь − наиболее простая, встречающаяся в ионных кристаллах. Характеризуется электростатическим взаимодействием между узлами кристаллической решетки, занятыми ионами.
Ковалентная связь: при переходе электронов в совместное владение атомами одного и того же элемента образуется ковалентная (атомная) связь, осуществляемая в простейшем случае парой электронов, причем эти электроны как бы располагаются по отношению к указанным атомам точно посередине.
|
|
Ван-дер-ваальсовые связь: аполярная поверхность минерала характеризуется молекулярными силами связи (силы Ван-дер-Ваальса). Силы притяжения между молекулами относительно малы по сравнению с химическими, которые слабее ионных и ковалентных в десятки раз. Самая слабая связь.
Водородная связь – атом водорода, ковалентно связанный с атомом сильно электроотрицательного элемента, может вступать в связь еще с другим атомом такого же элемента, например с кислородом. Водородная связь слабее ионной и ковалентной, но сильнее молекулярных сил.
НАЗНАЧЕНИЕ И КЛАССИФИКАЦИЯ ФЛОТАЦИОННЫХ РЕАГЕНТОВ. ОСНОВНЫЕ ФОРМЫ ЗАКРЕПЛЕНИЯ РЕАГЕНТОВ
СОБИРАТЕЛИ
Собиратели – это органические вещества, способствующие прилипанию минеральных частиц к пузырькам воздуха.
Молекулы ионногенных собирателей имеют сложное строение и состоят из 2х частей, отличных по своим свойствам – аполярной и полярной.
Аполярная часть – молекулы представляет собой углеводородный радикал, который практически не взаимодействует с диполями воды и характеризуется явно выраженной гидрофобностью, связанной с наличием у углеводородных радикалов весьма слабых боковых остаточных сил Ван–дер–Вальса при высоком значении сил связи внутри самих углеводородных цепей.
Полярная часть молекулы, в противоположность аполярной, отличается способностью к взаимодействию с водой.
На рисунке 2.2 представлена классификация реагентов – собирателей.
На рисунке 2.3 показаны в силовом изображении энергия химического взаимодействия – А между катионами решетки минерала и полярными группами собирателя, а также энергия дисперсного взаимодействия – Б между углеводородными цепями собирателя.
Адсорбционное закрепление молекул собирателя на поверхности минерала приводит к ослаблению силовых полей, создаваемых поверхностными атомами его кристаллической решетки, связи диполей воды с поверхностью минерала разрушаются.
|
|

Рис.2.2. Классификация реагентов-собирателей

Рис.2.3. Энергия взаимодействия собирателя с минералом.
Появление в зоне расположения гидратных слоев у поверхности минерала гидрофобных групп собирателя, практически невзаимодействующих с водой ведет:
1. К снижению устойчивости гидратных слоев и уменьшению их толщины.
2. Увеличению гистерезиса смачивания минерала, проявляющемуся в замедлении передвижения трехфазового периметра смачивания и возникновению известной жесткости его закрепления.
3. Сокращению времени прилипания в тысячи и десятки тысячи раз.
4. Увеличению прочности прилипания воздушного пузырька к минеральным частицам и, следовательно, повышению извлечения.
Сульфгидрильные собиратели
Ксантогенаты
К сульфгидрильным собирателям относятся реагенты, содержащие в своем составе сульфгидрильную группу. Ксантогенаты(техническое название −ксантаты) и дитиофосфаты (техническое название −аэрофлоты) являются важнейшими реагентами собирателями, наиболее широко применяемыми при флотации сульфидных руд цветных металлов, а также руд благородных металлов.
Ксантогенаты −это соли ксантогеновых кислот.
ROCSSH −ксантогеновая кислота.
Этиловый ксантогенат калия −C2H5OCSSK или CH3CH2OCSSК.
Пропиловый ксантогенат −C3H7OCSSK или CH3CH2CH2OCSSK.
Бутиловый ксантогенат −C4H9OCSSK или CH3CH2CH2CH2OCSSК.
Амиловый ксантогенат −C5H11OCSSK или CH3CH2CH2CH2CH2OCSSK.
Получение ксантогенатов основано на весьма быстро протекающей реакции между сероуглеродом и соответствующим алкоголятом: ROMe + CS2 = RO·CS·SMe.
Ксантогенаты обычно применяют в слабо щелочных пульпах (в кислой среде ксантогенаты разлагаются). Сильно щелочная пульпа также не благоприятна для собирательного действия ксантогената поскольку гидроксильные ионы способны вытеснять анионы ксантогената с поверхности минерала.
В кислой среде при pH=4−7:

В сильнощелочной среде ксантогенаты не используют, так как даже уже закрепившийся ксантогенат десорбируется с поверхности минерала: Pb(ROCSS)2+2KOH=Pb(OH)2+2ROCSSK
Ксантогенаты могут окисляться до диксантогенида: 2ROCSS↔2e+ROCSS-SSCOR
Последний закрепляется на поверхности сульфида (физическая адсорбция).
Важной положительной особенностью ксантогенатов является отсутствие у них пенообразующих свойств, что позволяет в широких пределах регулировать собирательные действия этих реагентов без нарушения процесса пенообразования.
|
|
Ксантогенаты не проявляют никакого собирательного действия по отношению к окислам, силикатам, алюмосиликатами и солеобразным минералам щелочноземельных металлов. Эта особенность ксантогенатов позволяет наиболее селективно разделять сульфиды при их флотации от минералов пустой породы. Расход ксантогенатов составляет в среднем 30–100 г/т руды.
Дитиофосфаты (соли дитиофосфорной кислоты)
Важным отличием дитиофосфатов от ксантогенатов является наличие двух углеводородных цепей, независимо друг от друга связанных с ядром молекулы (фосфором), что объясняется более высокой валентностью фосфора (пять) по сравнению с углеродом:

Имеются крезиловые дитиофосфаты 15, 25, 31.
Крезиловый дитиофосфат 15 представляет собой жидкость темного цвета, являющуюся раствором дитиофосфата в крезоле:

Благодаря большому количеству свободного крезола реагент обладает свойствами собирателя, вспенивателя и сульфидизатора. Расход дитиофосфата составляет 10 – 100 г/т.
Дитиокарбаматы
Дитиокарбаматы −это органические производные дитиокарбоновой кислоты.

Являются более сильными собирателями, но из-за дороговизны не нашли промышленного применения.
Меркаптаны и тиофенолы
Это −органические производные сероводорода. Меркаптаны и тиофенолы в химическом отношении являются тиоспиртами и имеют общую формулу RSH, где R −алкильный или арильный радикал. Алкил −углеводородный радикал
Являются эффективными собирателями окисленных медных минералов. Широкое применение ограниченно из-за очень сильного неприятного запаха.
СЦМ –2
Собиратель цементной меди применяется при переработки окисленных и смешанных медных руд по комбинированному методу. Предложен Гинцветметом в 1959г. Получается на основе бутилового ксаногената и метилхлороформиата в водной или ацетоновой среде. Расход 50 – 200 г/т.
Оксигидрильные собиратели
Это органические кислоты и мыла. Общие структурные формулы органических кислот и мыл включают в свой состав углеводородные радикалы R и карбоксильную группу:
|
|
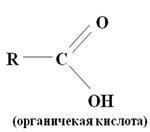
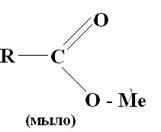
Прочность связи с минералом у этих собирателей больше чем у KX, так как у карбоновых кислот низкая константа диссоциации. По собирательным свойствам они уступают ксантогенатам. Основной причиной этого является наличие в солидофильной группе карбоновых кислот и мыл сильно полярной карбонильной группы >C=O, имеющей большое сродство к воде. Расход карбоксильных собирателей больше чем ксантогената.
У данной группы собирателей сильные пенообразующие свойства, рН – щелочная. Карбоновые кислоты и мыла, так же как и ксантогенаты, целесообразнее применять в щелочной пульпе:
При температуре ниже 10º результаты флотации начинают сильно снижаться и это понижение, как правило, компенсируется увеличением расхода реагента.
Характерными представителями карбоновых кислот и мыл является олеиновая кислота и олеат натрия.
Олеиновая кислота − C17H33COOH.
Расход 0,2-0,7 кг/т, растворимость −20 мг/л
Олеат натрия −C17H33COONa.
Представляет собой хорошо растворимую соль олеиновой кислоты.
Ниже приведены заменители олеиновой кислоты.
Нафтеновые кислоты:

Они получаются при перегонки нефти и каменноугольных сланцев. Это технические продукты.
Синтетические карбоновые кислоты получаются окислением таких алифатических углеводородов, как керосин, парафин. Получаются кислоты с длинной углеводородного радикала C18 −C44, из бурого угля −C22 −C50. Из них можно отметить:
Окисленный рисайкл −продукт окисления фракций нефти с температурой кипения 260–350ºC.
Реагент сравнительно недорогой Расход 0,5−2 кг/т.
Петролатум в 9 раз дешевле олеиновой кислоты, но расход в 3-4 раза больше.
При окислении петролатума получаются разнообразные кислородные соединения, в том числе и жирные кислоты типа карбоновых, в количестве 42-50%. Расход 0,5−3 кг/т.
Талловое (сульфатное) масло −один из продуктов, получаемых при производстве целлюлозы сульфатным способом, представляет смесь трех групп веществ: жирных кислот, смоляных кислот и нейтральных веществ. Кислотное число талового масла обычно равно 140−170, число омыления 165−175, йодное число 140−160. Расход 0,5−3 кг/т.
Алкилсульфаты
Они имеют общую формулу−ROSO3H и получаются действием 66% серной кислоты на спирт:
ROH + H2SO4↔ROSO3H + H2O
Применяются алкилсульфаты для селективной флотации минералов, содержащих Ba, Ca, а также легкорастворимых солей (сульфаты, хлориды). Алкилсульфаты не чувствительны к жесткости воды (расход 50−200г/т).
Катионные собиратели
|
|
К ним относятся амины и их соли, органические аналоги аммониевых соединений, органические сульфониевые, арсониевые и фосфониевые соединения, в которых сера, мышьяк или фосфор замещает атом азота в аммониевых соединениях, а также другие собиратели при ионизации которых углеводородный радикал и полярная группа остаются в катионе. Эти собиратели относятся к ионогенным. Их отличительными особенностями являются:
- гидрофобизирующим ионом является катион;
- закрепление их менее прочно чем анионных и процесс адсорбции их обратим.
Наименование аминов получается от названия углеводородного остатка, который замещает водород: лауриламин C12H2NH2, октилами C8H17NH, нафтиламин C10H7NH2 и т.д.
В щелочной среде с водой они образуют гидроокиси типа RNH3OH, а в кислой −соли RNH3CL.
Практический интерес представляет лауриламин −C12H25NH2, АНП–2, АНП–14, ИМ–11.
Причинами адсорбции иона катионного собирателя могут быть:
– кулоновское притяжение иона минеральной поверхности;
– поляризация адсорбента ионом;
– неполярные силы Ван-дер-Ваальса.
Флотационная активность катионных собирателей увеличивается с удлинением длины углеводородных радикалов. Однако, после 24-26 атомов углерода действие их ослабевает. Обычно применяемые собиратели содержат от 8 до 18 атомов углерода.
По флотируемости катионными собирателями минералы можно разделить на 3 группы:
– хорошо флотирующиеся (тальк, слюда, серицит);
– посредственно флотирующиеся (циркон, кианит);
– труднофлотирующиеся (кварц, силикаты). Расход катионных собирателей 50−150г/т, ПДК в сточных водах с числом атомов углерода (С7-9) −0,1мг/л, с (С10-16) −0,04 мг/л, с (С16-18) −0,03мг/л.
Аполярные собиратели
К ним относятся аполярные масла (керосин, солярка). Аполярные собиратели используются для:
– флотации аполярных минералов (графит,тальк);
– как добавка к анионным собирателям для флотации зерен избыточной крупности;
– для флокуляции мелких частиц (расход 100-1000г/т).
ПДК −0,03мг/л
РЕГУЛЯТОРЫ рН ПУЛЬПЫ
Реагенты применяемые для изменения щелочности делятся на 2 группы:
– щелочи и кислоты: NaOH, CaO, H2SO4;
– реагенты изменяющие среду вследствие гидролиза: Na2S, Na2SiO3, Na2CO3, NaCN и другие.
Помимо этого изменение щелочности среды может происходить за счет состава руды. Окисленная руда создает кислую среду.
Наличие в руде карбонатов щелочноземельных металлов (CaCO3 и другие) дает щелочную среду. При определении среды необходимо учитывать аналитическую и активную кислотность и щелочность.
Ионное произведение воды: KW = [H+][OН-]=[H2O]·1,8·10-16 (22ºC),
Учитывая малую диссоциацию воды и считая, что (H2O)=1000 г.
1000/М=1000/18=56,56 моль/л.
KW=56,56·1,8·10-16=10-14
Сущность влияния рН сводится к следующему:
1. Ионы водорода изменяют степень гидратации поверхности минералов.
2. Щелочность или кислотность оказывает влияние на электрическое состояние поверхности, изменяя потенциал.
3. Щелочность оказывает действие при депрессии минералов.
4. В воде обычно содержатся ионы тяжелых металлов, которые могут быть выведены из процесса в виде гидратов окисей.
5.Щелочность влияет на степень диссоциации реагентов.
ДЕПРЕССОРЫ
Депрессия − это временное предотвращение флотации одного или группы минералов. Это один из наиболее важных вопросов флотации, так как с этим связано комплексное извлечение металлов. Флотироваться могут все минералы.
В качестве депрессоров широко используются щелочи, цианиды, сернокислый цинк, сернистый натрий, двухромовые соли, жидкое стекло, органические соединения. Применение реагентов − депрессоров является основным средством получения максимальной селективности при флотационном разделении минералов с близкими свойствами.
АКТИВАТОРЫ
Активация – изменение поверхности минерала, в результате которого становится возможным закрепление на ней собирателя (в обеих формах).
Активаторы применяются тогда, когда минералы депрессированы, или когда природная флотируемость самих минералов недостаточна. Активаторы можно разделить на катионные и анионные.
Катионные активаторы - Это такие соединения, которые адсорбируясь на поверхности минералов, могут образовать малорастворимое соединение с собирателем. В большинстве случаев активаторы – соли тяжелых металлов. При подборе активаторов пользуются рядом электрохимических напряжений. Более благородный металл может быть активатором для благородного.
Для активации металлических минералов (ZnS, Sb2S3 – антимонит) применяются соли меди и свинца. Для активации неметаллических (SiO2, CaCO3) – применяют соли двухвалентного железа и свинца. Для гипса-бария, для кварца-соли бария, железа, кальция, алюминия.
Анионные активаторы
H2SO4 – типичный активатор для пирита депрессируемого известью. При этом происходит разрушение гидратной оболочки на поверхности пирита и очистка поверхности минерала от продуктов окисления и обнажение сульфидной поверхности. Для активации никеленосных пирротинов – лучше щавелевая и сернистая кислоты.
Растворение поверхностных пленок кислотами повышает флотируемость борилла, касситерита, ильменита, вольфрамита, флюорита и других минералов. Например, применение плавиковой кислоты для берилла объясняется растворением гидрофильных кремнекислородных осадков на его поверхности.
При применении анионных активаторов необходимо гуммировать аппаратуру.
К этим активаторам с гетерогенной химической реакцией относятся сульфидизаторы-реагенты, образующие на поверхности минералов сульфидную пленку (Na2S, NaHS, K2S, KHS, (NH4)2S, NH4HS, CaS, BaS) Наиболее широко применяется Na2S.
Малахит, азурит, церуссит обладает низкой флотационной активностью и с ксантогенатом не образуют химических соединений.
ПЕНООБРАЗОВАТЕЛИ
Большая поверхность раздела газ – жидкость воздушных пузырьков, на которой происходит закрепление минеральных частиц, и необходимая прочность минерализованной пены на поверхности пульпы, обеспечивается при флотации применением пенообразователей или вспенивателей.
Термодинамический и электрокинетический потенциалы поверхности минерала и их влияние на флотационные свойства
Дзета-потенциал (ξ) называется электрокинетическим или дзета-потенциалом. Знак дзета-потенциала зависит от знака заряда внутренней обкладки двойного слоя. Если в поверхности преобладают катионы, то дзета-потенциал будет положительным. Если в поверхностном слое наблюдается избыток анионов, то дзета-потенциал имеет отрицательный заряд.
Термодинамический (полный, электрохимический) потенциал ε, который можно характеризовать как разность потенциала между внешней обкладкой и внутренней обкладкой по физической границе минерала. Электрокинетический потенциал всегда меньше электрохимического и составляет его часть.
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!