

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
До конца XIX века изучение комплексных соединений носило чисто описательный характер. 1893 год швейцарский химик Альфред Вернер создал координационную теорию. Суть ее заключается в следующем: в комплексных соединениях имеется правильное геометрическое размещение атомов или групп атомов, называемых лигандами или аддендами, вокруг центрального атома – комплексообразователя.
Таким образом, химия комплексных соединений изучает ионы и молекулы, состоящие из центральной частицы и координированных вокруг нее лигандов. Центральная частица – комплексообразователь и непосредственно связанные с ней лиганды, образуют внутреннюю сферу комплекса. Для неорганических лигандов, чаще всего, число их совпадает с координационным числом центральной частицы. Таким образом, координационное число – это общее число нейтральных молекул илиионов (лигандов), связанных с центральным атомом в комплексе.
Первоначально к комплексным (координационным) соединениям относили только те соединения, в которых была превышена стехиометрическая валентность (степень окисления элемента) центрального атома. По этим представлениям комплекс состоит из центрального атома, окруженного непосредственно связанными с ним отдельными атомами (или ионами) и электронейтральными группами (молекулами); остальные (не связанные непосредственно с центральным атомом) ионы образуют внешнюю сферу комплексного соединения. Атомы (или ионы) и группы связанные с центральным атомом называются лигандами, а их суммарное число - координационным числом центрального атома. Координационное число всегда больше числа, определяющего стехиометрическую валентность (степень окисления элемента) центрального атома.
|
|
Ионы, находящиеся за пределами внутренней сферы, образуют внешнюю сферу, комплексного соединения. В формулах внутреннюю сферу заключают в квадратные скобки.
 лиганды
лиганды

 K4 [Fe(CN)6] [Fe(CN)6]4- - внутренняя сфера или комплексный ион
K4 [Fe(CN)6] [Fe(CN)6]4- - внутренняя сфера или комплексный ион
ион- координационное число
комплексообразователь
Комплексообразователями служат:
1) положительные ионы металлов (чаще d-элементы): Ag+, Fe2+, , Fe3+, Cu2+, Al3+, Co3+; и др. (ионы- комплексообразователи).
2) реже - нейтральные атомы металлов, относящиеся к d-элементам: (Сo, Fe, Mn и др.)
3) некоторые атомы неметаллов с различной положительной степенью окисления - B+3, Si+4, P+5 и др.
Лигандами могут быть:
1) отрицательнозаряженные ионы (OH-, Hal -, CN - -цианогруппа, SCN- - тиоцианогруппа, NH2- -аминогруппа, и др.)
2) полярные молекулы: H2O (название лиганда - «аква»), NH3 («аммин»),
CO («карбонил»).
Таблица 5.
Названия некоторых лигандов
| формула | название | формула | название |
| CH3COO- | -ацетато | CN- | -циано |
| CO32- | -карбонато | H- | -гидридо |
| SO42- | -сульфато | SO32- | -сульфито |
| C2O42- | -оксалато | H2O | -аква |
| SCN- | -тиоцианато (роданидо) | NH3 | -аммин |
| NO2- (-ONO) | -нитро (нитрито) | CO | -карбонил |
| OH- | -гидроксо | Вr - | -бромо |
| S2- | -тио | Cl - | -хлоро |
| SO3S2- | -тиосульфато | F - | -фторо |
Таким образом, комплексными соединениями (координационными соединениями) называются сложные химические соединения, в составе которых имеются комплексные ионы, образованные центральным атомом в определенной степени окисления (или с определенной валентностью) и связанными с ним лигандами.
Классификация комплексных соединений:
I. По характеру лигандов:
1. Аквакомплексы (H2O)
2. Гидроксокомплексы (OH)
3. Амминкомплексы (NH3) - аммиакаты
4. Ацидокомплексы (с кислотными остатками - Сl-, SCN-, S2O32- и другие)
5. Карбонилкомплексы (СО)
6. Комплексы с органическими лигандами (NH2-CH2-CH2-NH2 и др.)
7. Анионгалогенаты (Na [I Cl4])
8. Аминокомплексы (NH2)
|
|
II. По заряду комплексного иона:
1. Катионного типа - заряд комплексного иона - положительный
2. Анионного типа - заряд комплексного иона - отрицательный.
Для правильного написания комплексного соединения необходимо знать степень окисления центрального атома, его координациооное число, природу лигандов и заряд комплексного иона.
Координационное число можно определить как число σ - связей между нейтральными молекулами или ионами (лигандами) и центральным атомом в комплексе.
Величина координационного числа определяется, главным образом, размерами, зарядом и строением электронной оболочки комплексообразователя.
Наиболее часто встречается координационное число 6. Оно характерно для следующих ионов: Fe2+, Fe3+, Co3+, Ni3+, Pt4+, Al3+, Cr3+, Mn2+ , Sn4+.
K3[Fe(CN)6] калия гексацианоферрат (III)
Na3[Co(NO2)6] натрия гексанитрокобальтат ( III)
[Cr(H2O)6] Cl3 гексааквахрома (III) хлорид
Координационное число 4 встречается у 2-х-зарядных ионов и у алюминия или золота: Hg2+, Cu2+, Pb2+, Pt 2+, Au3+ , Al3+.
[Cu(NH3)4] (OH)2 - тетрааммин меди(II) гидроксид;
Na2[Cu(OH)4 ] – тетрагидроксокупрат (II) натрия
K2 [HgI4] – тетраиодомеркурат (II) калия;
H[AuCl4] – тетрахлороаурат(III) водорода.
Часто координациооное число определяется как удвоенная степень окисления иона-комплексообразователя: у Hg2+, Cu2+, Pb2+ - координационное число равно 4; у Ag+, Cu+ - координационное число равно 2.
Определение заряда комплексообразователя и комплексного иона:
1.Заряд комплексного иона равен заряду внешней сферы с обратным знаком; он также равен сумме заряда комплексообразователя и всех лигандов.
+2 х -1
K2[HgI4] +2+ (- 1) ·4 =х х = -2
2. Заряд комплексообразователя равен алгебраической сумме зарядов лигандов и внешней сферы (с обратным знаком).
х 0 -1
[Ag(NH3)2] Cl х +0·2 +(–1)·2 = 0; х=2-1= +1
х 0 2-
[Cu(NH3)4] SO4 х+ 4· 0 -2 = 0 х = +2
3.Чем больше заряд центрального атома и меньше заряд лиганда, тем больше координационное число.
Существует несколько способов названий комплексных соединений.
1.Традиционные специфические вненоменнклатурные названия.
Например:
K4 [Fe(CN)6] – желтая кровяная соль, ферр о цианид калия;
K3 [Fe(CN)6] - красная кровяная соль, ферр и цианид калия.
2. Номенклатура, предложенная Альфредом Вернером, которую усовершенствовали его последователи:
|
|
а) комплексные катионы называли так: вначале отрицательнозаряженные лиганды внутренней сферы с окончанием «О» (хлоро-, родано- и т.д.); для обозначения их количества добавляли греческие числительные: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса (моно - не принято указывать). Затем называли нейтральные лиганды, причем молекулу воды «аква», молекулу аммиака – «аммин». Затем называли атом металла – комплексообразователя и внешнесферные анионы. Атом металла - на латинском языке с окончанием, зависящем от степени окисления металла.
Таблица 6
Окончания металла – комплексообразователя в зависимости от степени окисления
| степень окисления | I | II | III | IV | V | VI | VII | VIII |
| окончание | а | о | и | е | ан | он | ин | ен |
Например:
[Pt (NH3)4] CI2 – тетраамминплатинохлорид;
[Co(NH3)5CI] SO4 – хлоропентаамминкобальтисульфат.
б) комплексные анионы называли следующим образом: также называли лиганды, как и в катионном комплексе, после чего следует название металла с соответствующим окончанием, характеризующим его степень окисления, к которому добавляется суффикс «ат». В заключение в родительном падеже называют внешнесферные катионы.
Например:
K[Ag(CN)2] – дицианоаргенат калия;
К2 [PtCI6] - гексахлороплатинат калия.
в) нейтральные комплексы: названия строят аналогично, но к наименованию металла – комплексообразователя не прибавляют никаких окончаний. Например:
[Cr(NH3)3(NO2)3] - тринитротриамминкобальт.
3. Номенклатура, рекомендованная Международным союзом по чистой и прикладной химии. Ее можно рассматривать как усовершенствованную и модернизированную номенклатуру Вернера. Лиганды называют аналогично и в том же порядке. После этого называют металл – комплексообразователь, указывая степень окисления римскими цифрами в скобках. Если комплекс - анион, то к названию атома добавляют суффикс «ат». Если лиганды – сложные молекулы, то числительные изменяют на бис-, трис-, тетракис-, пентакис-, гексакис-.
Катион можно называть вместе с анионом в именительном падеже и слитно, если катион в родительном падеже, то наименования катиона и аниона – отдельно.
|
|
Например:
[Co(NH3)5CI]SO4 – хлоропентаамминкобальт (III) сульфат,
или хлоропентаамминкобальта (III) сульфат.
Возможна перемена местами названия аниона и катиона: сульфат хлоропентаамминкобальта (III).
[UCI2{(CH3)2SO}6] [UCI6] - гексакис(диметилсульфоксид)дихлоруран (IV) гексахлороуранат (IV).
В последнем случае и катион, и анион – координационные частицы. Как видно, порядок расстановки скобок иной, чем в математике: квадратные, фигурные, круглые.
В русском названии комплексных соединений однозначно в катионных комплексах металл – комплексообразователь называют русским названием элемента, а в анионных – латинским.
Например:
[Cu(NH3)4] SO4 тетраамминмеди (II) сульфат
[Ag(NH3)2] Cl диамминсеребра (I) хлорид
[CoI6] Cl3 – гексаиодокобальта (Ш) хлорид
[Al(C2O4)(H2O)5] Cl – оксалатопентаакваалюминия (Ш) хлорид
(окалат - двухзарядный анион щавелевой кислоты)
[Fe(H2O)6]Cl3 –гексаакважелеза (Ш) хлорид
[Zn(H2O)4](NO3)2 - тетрааквацинка (II) нитрат
[Pt(NH3)4Cl2]Cl2 - дихлоротетраамминплатины (IV) хлорид
K3[FeF6] – калия гексафтороферрат (Ш);
Na3[Co(NO2)6] – натрия гексанитрокобальтат (III);
NH4 [Hg(CO)2 (SCN)2] –аммония дитиоцианодикарбонилмеркурат (I)
K3[Fe(CN)6] – калия гексацианоферрат (III)
(или трикалий гексацианоферрат)
K2[Zn(CNS)4] – калия тетрароданоцинкат (II)
K4[Fe(CN)6] – калия гексацианоферрат (II)
(или тетракалий гексацианоферрат)
K[Au(OH)4] – калия тетрагидроксоаурат (III)
Na2[Fe(CN)5NO] – натрия нитрозилпентацианоферрат (III)
K3[Fe(CN)5CO] – калия карбонилпентацианоферрат (II)
K[Fe(NH3)2(CN)4] – калия тетрацианодиамминферрат (III)
(NH4)2[Рt(OH)2Cl4] – аммония дигидроксотетрахлороплатинат (IV)
Нейтральные комплексы:
[Fe(CO)5] – пентакарбонилжелезо
[Co(NH3)3(NO2)3] - тринитротриамминкобальт (III)
[Pt(P(C6H5)3)2Cl2] - дихлорбистрифенилфосфинплатина (III)
[Сг(Н2О)3 Fe3] - трифторотриаквахром
[Со(NН3)3(NО2)2C1] – динитритохлоротриамминкобальт.
В некоторой литературе даны и другие модификации названий комплексных соединений.
III. Примеры и задания для самостоятельного решения
Пример 1. Назвать следующие соединения: I205, НIO4, H5IO6, КIO3.
Решение.
I205 - оксид иода (V) или пентаоксиддииода;
НIO4 - метаиодиая кислота, тетраоксоиодат водорода;
H5IO6 - ортоиодная кислота или гексаоксоиодат пентаводорода;
КIO3 - традиционное название - иодат калия, систематическое - триоксоиодат калия.
Пример 2. Написать формулы следующих веществ:
а) пероксосульфат диводорода;
б) трисульфиддиаммония;
в) триоксотиосульфат динатрия.
Решение.
а) пероксосульфат диводорода - K2S03(02) или KSO5 - содержит пероксогруппу О 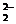 и серу в высшей степени окисления;
и серу в высшей степени окисления;
|
|
б) трисульфиддиаммония - (NH4)2S3;
в) триоксотиосульфат динатрия - N2S203 - содержит серу в степени окисления -2 (тио-) и серу в высшей степени окисления, то есть в сульфат-ионе один ион О2- заменен на S 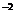 .
.
Пример 3. Классифицировать, полностью охарактеризовать и дать названия следующим комплексным соединениям: а) K3[Ag(SO3S)2];
б) [Co(NH3)4Cl2]Cl;
в) [W(CO)6].
Решение:
а)
1) K3[Ag(SO3S)2] - 3 иона К+ - внешняя сфера, ее общий заряд +3, [Ag(SO3S)2]3- - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3-);
2) Комплексное соединение анионного типа, так как заряд внутренней сферы - отрицательный;
3) Центральный атом - комплексообразователь - ион серебра Ag+
4) Лиганды - два двухзарядных остатка тиосерной кислоты H2S2O3, относится к ацидокомплексам;
5) Координационное число комплексообразователя в данном случае как исключение равно 4 (у двух остатков кислоты 4 валентных σ - связи без 4-х катионов водорода);
6) Заряд комплексообразователя равен +1:
+1 х -2
K3[Ag(SO3S)2]: +1 · 3 + Х + (-2) · 2 = 0 à X= +1
7) Название: – калия дитиосульфатоаргентат (I).
б)
1) [Co(NH3)4Cl2]Cl - 1 ион - Сl- - внешняя сфера, ее общий заряд -1, - [Co(NH3)4Cl2] - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3+);
2) Комплексное соединение катионного типа, так как заряд внутренней сферы – положительный;
3) Центральный атом - комплексообразователь - ион кобальта Со, вычисляем его заряд:
х 0 -1 1+
[Co(NH3)4Cl2]: Х + 0 · 4 + (-1) · 2 = +1 à Х = 0 +2 +1 = +3
4) Комплексное соединение смешанного типа, так как в его составе разные лиганды; ацидокомплекс (Cl-- остаток хлороводородной кислоты) и амминкамплекс - аммиакатный (NH3 - аммиак-нейтральное соединение);
5) Координационное число комплексообразователя равно 6;
6) Название – дихлоротетраамминкобальта(III) хлорид.
в)
1) [W(CO)6] - внешней сферы нет;
2) Комплексное соединение нейтрального типа, так как заряд внутренней сферы = 0;
3) Центральный атом - комплексообразователь - атом вольфрама,
его заряд =0;
4) Карбонилкомплекс, так как лигандом является нейтральная частица - карбонил - СО;
5) Координационное число комплексообразователя равно 6;
6) Название: – гексакарбонилвольфрам
Пример 4. Какие оксиды вступают в реакцию с соляной кислотой -HCl:
а) СuO; б) SiO; в) BeO?
Решение:
а) оксид меди (II) CuО - основной, следовательно, в реакuии с кислотой образует соль и воду:
CuO + 2НCl = CuCl2 + H2O;
б) оксид кремния (IV) SiО2 - кислотный, следовательно, в реакцию с кислотой не вступает;
в) оксид берилия BeО - амфотерный, следовательно, в реакuии с кислотой образует соль и воду:
BeO + 2НCl = BeCl2 + H2O.
Пример 5. Какие оксиды вступают в реакцию с гидроксидом натрия -NaOH:
а) FeO; б) SO2; в) Al2O3?
Решение:
а) оксид меди (II) CuО - основной, следовательно, в реакцию со щелочью не вступает;
б) оксид серы (IV) SО2 - кислотный, следовательно, в реакцию со щелочью вступает и образует соль и воду:
SО2 + 2NaOH = Na2SO3 + H2O;
в) оксид алюминия Al2O3 - амфотерный, следовательно, в реакuии со щелочью образует соль и воду:
Al2O3 + 2NaOH = 2Na AlO2 + H2O.
Пример 6. Составьте формулы гидроксидов, соответствующих оксидам:
а) FeO; б) SO2; в) Al2O3?
Решение:
а) оксид железа (II) FeО - основной, следовательно, соответствующий гидроксид - основание, в формуле число гидроксогрупп (ОН) равно валентности металла (II) или степени окисления (+2); формула гидроксида - основания Fe(OH)2;
б) оксид серы (IV) SО2 - кислотный, следовательно, соответствующий гидроксид - кислота:
SО2 + H2O = Н2SO3;
в) оксид алюминия - амфотерный, следовательно, соответствующий гидроксид - амфотерен. Амфотерные гидроксиды, чаще, записывают в форме оснований - Аl(OH)3.
Пример 7. Составьте формулы а) гидроксида хрома(+3);
б) фосфорной кислоты
Решение:
а) гидроксид хрома (+3) - амфотереный, формула Cr(ОН)3; кислотная ортоформа - H3CrO3 и метаформа (с меньшим содержанием воды) - HCrO2;
б) Данное название кислоты (- ная) соответствует максимальной валентности (степени окисления) фосфора (+5). Формулу кислоты можно вывести:
1) P 2О5 + H2O = 2НPO3 - метафосфорная кислота
P 2О5 + 3H2O = 2Н 3 PO4 - ортофосфорная кислота;
2) общая условная формула гидроксида фосфора Р(ОН)5; при последующем постепенном вычитании двух молекул воды получаются ортофосфорная и метафосфорная кислота, соответственно.
Пример 8. Составьте формулы: а) карбоната хрома (+3);
б) гидросульфата бария;
в) сульфита дигидроксоалюминия
Решение
а) Сr 3+ и CO32- - ион хрома и двухзарядный (двухвалентный) остаток угольной кислоты - карбонат-анион. Составляем формулу, учитывая валентности:Сr2(CO3)3;
б) Ba2+ и анион, в котором с сульфат-ионом связан один катион водорода HSO4-. Составляем формулу: Ba(HSO4)2
в) катион, в котором ион алюминия Al3+ связан с двумя гидроксогруппами OH- т.е., Al(OH)2+ и анион SO32-. Составляем формулу, учитывая валентности (заряды) этих двух ионов: (Al(OH)2)2 SO3.
Задание 9. Составьте формулы:
а) гидроксида марганца (+2);
б) хлорной кислоты (с высшей степенью окисления хлора);
в) гидроксида свинца (+4) и его кислотных орто- и метаформ.
Задание 10. Составьте формулы всех солей, которые могут быть образованы гидроксидом кальция и ортофосфорной кислотой. Дайте им название.
Задание 11. Составьте формулы:
а) карбоната хрома (+3);
б) гидросульфата бария;
в) дигидроксосульфита алюминия
(или сульфита дигидроксоалюминия).
Задание 12. Составьте формулы солей:
а) дигидрофосфата меди (+2);
б) нитрата кобальта (+3);
в) гидроксохлорида железа (+3).
Задание 13. Составьте формулы всех солей, которые могут быть образованы гидроксидом кальция - Ca(OH)2 и сернистой кислотой - H2SO3
Приведите названия полученным соединениям.
Задание 14. В реакциях, между какими веществами возможно образование кислых солей: a) Na2S + H2S;
б) KOH + H3PO4;
в) Al(OH)3+ HBr;
г) NaOH + SO2 (изб.).
Напишите уравнения реакций, дайте названия продуктам реакции.
Задание 1 5. Охарактеризуйте комплексные соединения:
а) Li3 Cr (OH)6]
б) [Zn(H2O)3 F] I2
в) [ Pt Cl2 (NH3)2]
и дайте им названия.
Задание 16. Назовите комплексные соединения и дайте им названия
[Co(NH3)4(NO2)2]NO3,
K3[Al (C2O4)3 ],
Na3[Co(NO2)6],
H[AuCl4],
Fe3[ Cr (CN)6]2
Библиографический список
1. Бокий Г.Б., Голубкова Н.А. Введение в номенклатуру ИЮПАК. Москва, «Наука», 1989.
2. Гликина Ф.Б., Ключников Н.Г. Химия комплексных соединений. Москва, «Просвещение», 1982
3. Бусев А. И., Ефимов И. П., Словарь химических терминов. Пособие для учащихся, М., 1971г.
4. Гринвуд Н., Эрншо А. Химия элементов. - Т.1. - М.: БИНОМ. Лаборатория знаний, 2008 г. - С. 150-155, 272-273.
5. Емельянов В.А. Общая химия. Классификация и номенклатура неорганических соединений: Методическое пособие для студентов геолого-геофизического факультета. - Новосибирск: НГУ, 2002 г. - 24 с.
6. Кан Р., Дермер О. Введение в химическую номенклатуру. - М.: Химия, 1983 г. - С. 20-60, 192-200.
7. Лабораторный практикум по общей химии, под ред. С. Л. Погодина, 2 изд., М., 1972 г., с. 27—33.
8. Лидин Р.А., Аликберова Л.Ю., Логинова Г.П. Неорганическая химия в вопросах. - М.: Химия, 1991 г. - С. 185-195.
9.Лурье Ю.Ю. Справочник по аналитической химии. Москва, «Химия», 1989.
10. Лучинский Г. П., Номенклатура неорганических соединений, в кн.: Краткая химическая энциклопедия, т. 3, М., 1964 г.
11. Материалы к проекту номенклатуры неорганических соединений, М., 1968 г.
12. Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973 г. - С. 54-57.
13. Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. - С-Пб.: АНО НПО Мир и семья. – 2002 г. - С. 5-23.
14. Nomenclature of Inorganic Chemistry. IUPAC recommendatins 2005. - International Union of Pure and Applied Ch.
Приложения.
Таблица 1.
|
|
|

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!