Бричкин В.Н.
Б 879 Металлургия легких металлов. Производство алюминия и магния: Лабораторный практикум / В.Н.Бричкин, В.М.Сизяков. Санкт-Петербургский государственный горный институт (технический университет). СПб, 2005. 88 с.
ISBN 5-94211-229-0
УДК 669.7, 669.712(075.80)
ББК 24.123
| ISBN 5-94211-229-0
| Ó Санкт-Петербургский горный
институт им. Г.В.Плеханова, 2005 г.
|
ВВЕДЕНИЕ
Получение легких металлов в элементарном состоянии – одна из труднейших задач химической технологии и металлургического производства, что обусловлено высокой химической активностью этих металлов и термодинамической прочностью образуемых ими соединений. В связи с этим выделение легких металлов в свободном виде стало практически возможным только в начале XIX в. благодаря успехам электрохимии и использованию в качестве восстановителя электрического тока или полученных электролизом щелочных металлов.
Электролиз расплавов и высокотемпературное металлотермическое восстановление являются основой современного промышленного производства алюминия, магния, бериллия и других легких металлов. Таким образом, близость химической природы этих элементов определяет единство используемых на практике приемов и технологий.
Легкие металлы, не говоря уже о щелочных и щелочно-земельных, имеют высокий отрицательный потенциал по отношению к водороду, что делает невозможным их выделение из водного раствора даже при больших плотностях тока, вызывающих, как известно, значительное перенапряжение выделения водорода. В этом случае водород представляет собой электроположительную примесь, что приводит к первичной потере по току металлов в ходе электролиза. Так как вода термодинамически не устойчива по отношению к легким металлам, то это вызывает их вторичные потери.
Попытки исключить воду из процесса были связаны с электролизом солей легких металлов в органических растворителях (спиртах, циклических углеводородах, ацетоне и др.). Эти способы оказались неудобными для крупного промышленного производства, хотя сохраняют определенное значение в лабораторной практике.
Все промышленно освоенные методы электролитического производства легких металлов основаны на электролизе расплавов, к проведению которого предъявляются однотипные требования:
· высокая чистота соединений, используемых при электролизе, в отношении более электроположительных примесей и воды;
· электрохимическая и термическая устойчивость соединений, применяемых в качестве растворителей или корректирующих добавок;
· возможность поддержания достаточно высокой активности разряжающихся ионов в расплаве;
· низкая температура плавления электролита и высокая электропроводность при температуре процесса;
· малая летучесть электролита, которая обеспечивается низким давлением паров над расплавом используемых компонентов;
· низкая вязкость и оптимальная плотность электролита, обеспечивающие эффективное разделение металла и электролита в расплавленном состоянии (ликвацию);
· низкая химическая активность электролита по отношению к выделенному металлу и возможно более низкая коррозионная активность.
Получение ряда легких металлов (Mg, Ca, Ba) производится металлотермическим способом, особенно удобным в тех случаях, когда протеканию процесса способствует вакуумирование. В качестве восстановителей применяют Al, Si, Mg, первичные алюмокремниевые сплавы или ферросилиций. Данная технология сближает производство легких металлов с металлургией таких активных металлов, как титан, цирконий, ниобий и др.
Углетермическое восстановление Al, Mg и Be требует высокотемпературных условий и сопровождается переходом значительной доли металлов в газообразное состояние, что осложняет их последующее выделение. В связи с этим восстановление Al и Be ведут в присутствии другого металла (с высокой точкой кипения), образующего соответствующие сплавы Al-Si, Cu-Be, Ni-Be. Одновременно понижается вероятность образования карбидов Al и Be, затрудняющих ведение процесса и ухудшающих его показатели. В настоящее время углетермическое производство первичных алюмокремниевых сплавов реализовано в промышленном масштабе и позволяет получать литейные алюминиевые сплавы (силумины) прямым восстановлением.
Несмотря на значительные успехи, достигнутые металлургией в области получения легких металлов, их производство остается технически сложным, высокоэнергоемким, опасным и, безусловно, требует дальнейшего совершенствования.
Требования к содержанию отчета по лабораторной работе следующие:
· формулировка цели работы;
· краткая характеристика изучаемой технологии, процесса или явления;
· описание лабораторной установки или используемого лабораторного оборудования;
· задание на проведение исследований, включающее сведения об используемых материалах, условиях проведения опытов, изменениях в ходе работы и рекомендации по обработке полученных данных;
· расчетные и экспериментальные данные, результаты их обработки в виде таблиц, графиков и аналитических зависимостей;
· выводы по работе.
Учебные работы
Работа 1. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОГО СОСТАВА КРИОЛИТА
Цель работы. Знакомство с технологическими основами производства фтористых солей и физико-химическими свойствами криолитоглиноземного расплава, экспериментальное определение молекулярного состава криолита.
Основные определения, теория и технология
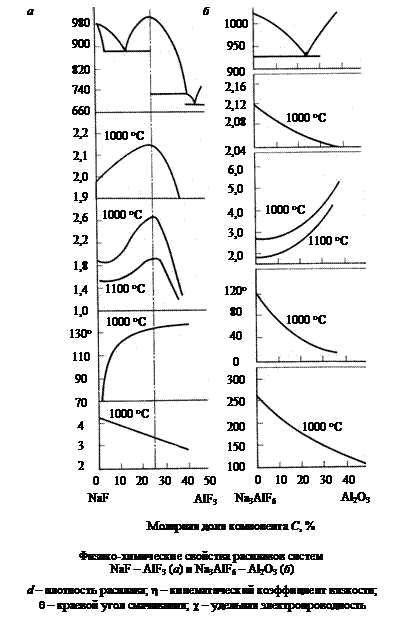
Криолит 3NaF×AlF3 или Na3AlF6 – натриевая соль гексафторалюминиевой кислоты. Название происходит от греческих слов криос – холод, лед и литос – камень (по блеску и показателям преломления криолит похож на лед). Синоним – ледяной шпат. Единственное промышленное месторождение этого минерала Ивигтут (Западная Гренландия) на сегодняшний день отработано, поэтому алюминиевая промышленность почти полностью работает на искусственном криолите.
Молекулярное отношение NaF/AlF3 в криолите называется криолитовым отношением (к.о.). В криолите теоретического состава это отношение равно трем. Искусственный криолит обычно готовят с избытком фтористого алюминия, вплоть до состава с к.о. = 1,5. По внешнему виду искусственный криолит представляет собой мелкокристаллический порошок белого цвета с насыпной массой 1,1-1,2 г/см3. Алюминиевая промышленность является крупным потребителем фтористых солей. Криолит при электролитическом получении алюминия служит расплавленной средой (растворителем) для глинозема, а фтористый алюминий необходим для корректировки состава криолитоглиноземного расплава (электролита).
Исходное сырье для получения фтористых солей – флюорит СаF2 (синоним – плавиковый шпат) и отходящие газы суперфосфатного производства. Дополнительным источником фтора служат утилизируемые технологические газы, пыли и футеровка алюминиевых электролизеров.
Для получения фтористых солей кислотным способом используют флотационный концентрат плавикового шпата, содержащий не менее 92 % CaF2. Этот концентрат смешивают в необходимом соотношении с концентрированной серной кислотой (92,5-95 % H2SO4) и подают на разложение в трубчатый вращающийся реактор. В результате разложения CaF2 образуются фтористый водород и гипс по реакции
CaF2 + H2SO4 = 2HF + CaSO4.
После абсорбции фтористого водорода водой плавиковая кислота имеет следующий состав, % по массе: HF 28-30, H2SiF6 3-5, H2SO4 1-2. Образующийся при разложении плавикового шпата гипс содержит 80-85 % СаSO4, 10-15 % H2SO4 и 2-5 % CaF2. После нейтрализации известью гипс удаляется на шламовое поле или используется в цементной промышленности. Для очистки от кремнезема в раствор плавиковой кислоты вводят соду до образования малорастворимого кремнефтористого натрия
H2SiF6 + Na2CO3 = Na2SiF6 + CO2 + H2O.
Для получения (варки) криолита в раствор чистой плавиковой кислоты вводят расчетные количества гидроксида алюминия и соды. Варку ведут в две стадии:
6HF + Al(OH)3 = H3AlF6 + 3H2O;
2H3AlF6 + 3Na2CO3 = 2Na3AlF6 + 3CO2 + 3H2O.
Фтористый алюминий получают на основе реакции нейтрализации при температуре 90-95 °С:
3HF + Al(OH)3 = AlF3 + 3H2O.
Фтористый алюминий кристаллизуется в виде кристаллогидрата А1F3×ЗН2О и в дальнейшем подвергается кальцинации при температуре t = 350¸400 °С до содержания остаточной влаги 6 %. Более прогрессивный «сухой способ» основан на непосредственном взаимодействии газообразного HF c g-Al2O3 при t = 450¸500 °С:
g-Al2O3 + 6HF = 2AlF3 + 3H2O.
Применяемый в настоящее время для электролиза алюминия промышленный электролит состоит в основном из обогащенного фтористым алюминием криолитоглиноземного расплава, свойства которого улучшены добавками различных химических соединений, чаще всего CaF2, LiF, NaCl, MgF2. Сумма этих добавок, как правило, не превышает 8-10 %. Основное назначение добавок – снижение температуры плавления электролита и увеличение его электропроводности. Однако все добавки в той или иной степени приводят к снижению растворимости глинозема в электролите, что ограничивает их содержание в расплаве. Кроме того, с исходными материалами в электролит поступают CaF2, K2O, Na2O, а также следующие примеси: Fe2O3, SiO2, P2O5, V2O5, SO42-, CuO и др.
Поскольку основу электролита составляют фториды натрия и алюминия, то их молярное отношение (к.о.) определяет наиболее важные свойства расплава (см. рисунок). Представленные на рисунке зависимости для реальных промышленных электролитов под влиянием добавок и примесей могут существенно искажаться.
Содержание основных компонентов в кислых промышленных электролитах (к.о. 2,5-2,9) находится в следующих пределах, % по массе: криолит 75-90, AlF3 5-12, CaF2 2-4, MgF2 2-5, AI2O3 1-10. Промышленный электролит, содержащий по массе 5 % AI2O3 и 4 % СаF2, при изменении к.о. от 2,1 до 2,7 обладает соответственно следующими свойствами: температура начала кристаллизации 935-960 °С; плотность 2,09-2,11 г/см3; вязкость 0,295-0,325 Па×с; удельная электропроводность 1,85-2,05 Ом/см. Если учесть, что перегрев электролита, необходимый для нормального протекания процесса, составляет 15 °С, то рабочая температура электролита такого состава должна достигать 950-975 °С.
Ведущим технологическим показателем электролиза, зависящим от состава (к.о.) и свойств электролита, является выход по току. Потери алюминия минимальны при к.о. = 2,4¸2,6. При больших к.о. решающую роль играет реакция образования натрия (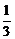 А1 + NaF = Na +
А1 + NaF = Na + 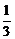 А1F3), при малых к.о. – реакция образования субфторида алюминия (А1 +
А1F3), при малых к.о. – реакция образования субфторида алюминия (А1 +  AlF3 =
AlF3 = 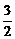 AlF).
AlF).
Расход электролита при электролизе связан с высокой летучестью фторидов (особенно АlF3), их взаимодействием с алюминием и примесями, разложением во время анодных эффектов. Это приводит к необходимости компенсации возникающих потерь и корректировки состава электролита по к.о., определение которого обычно производится «ториевым методом» или методом горячего титрования.
Ториевый метод заключается в спекании электролита при 600-650 оС с избытком NаF. При этом происходит разрушение соединений AlF3 с фторидами кальция и магния с образованием криолита и нейборита (NaMgF3). Фтористые кальций и литий выделяются в виде отдельных фаз. Спек выщелачивают водой и определяют свободный NaF с использованием азотнокислого тория, что и дало название методу.
Метод горячего титрования основан на том, что водный раствор, равновесный с криолитом и нейборитом, нейтрален. При избытке AlF3 или NaF реакция раствора, соответственно, кислая или щелочная. Поэтому электролиты с к.о. > 3 называют щелочными, а с к.о. < 3 – кислыми. Титрование заключается в том, что к пробе расплавленного электролита небольшими порциями добавляют NaF или А1F3, после чего определяют pH водного раствора. Титрование ведут до нейтральной реакции, а затем вычисляют к.о.
Лабораторное оборудование. Электрическая печь сопротивления, набор графитовых (графито-шамотных) тиглей, механическая или ручная ступка для измельчения и истирания проб, pH-метр или набор индикаторов, весы.
Содержание задания. Перечень используемых реагентов, количество и состав анализируемых проб, применяемых для построения градуировочного графика, режим плавления проб и их подготовки к определению pH.
Порядок работы
1. На основе химически чистых солей (NaF и AlF3) приготовить их смеси с заданным криолитовым отношением (2,0; 2,5; 3,0; 3,5; 4,0), удовлетворяющие условиям:
m NaF + m AlF3 = m к;  ,
,
где m NaF – масса чистого NaF, г; m AlF3 – масса чистого AlF3, г; m к – заданная масса криолита, m к = 2¸4 г.; 84 и 42 – молекулярная масса AlF3 и NaF соответственно, г/моль.
2. Приготовленные смеси засыпать в тигли и по очереди довести их до плавления в электропечи при температуре 1000-1050 °С. Время плавления криолита подбирается экспериментально. Тигли с расплавом вынуть из печи и охладить на воздухе. Закристаллизовавшиеся пробы криолита по отдельности истереть в фарфоровой ступке с добавлением 10-15 мл дистиллированной воды.
3. Провести калибровку pH-метра по стандартному буферному раствору и определить pH полученных растворов. По результатам измерений построить калибровочный график в координатах pH = f (к.о.).
4. Пробу исследуемого электролита (криолита) довести до плавления, далее определить pH водного раствора и по калибровочному графику его криолитовое отношение (к.о.)эл. Рассчитать количество NaF и AlF3 в исследуемой пробе и выполнить расчетную корректировку величины криолитового отношения с учетом содержания MgF2, участвующего в образовании нейборита, по формуле
(к.о.)'эл =  ,
,
где  – соответственно масса электролита, NaF и AlF3 в пробе анализируемого электролита;
– соответственно масса электролита, NaF и AlF3 в пробе анализируемого электролита; 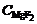 – концентрация в электролите MgF2, доли ед.; 62 – молекулярная масса MgF2, г/моль.
– концентрация в электролите MgF2, доли ед.; 62 – молекулярная масса MgF2, г/моль.
5. Рассчитать массу добавки (NaF или AlF3), необходимой для корректировки условного количества электролита с (к.о.)'эл до производственного технологического уровня.
Работа 2. БАЛАНСОВАЯ ОЦЕНКА АЛЮМИНИЕВОГО ЭЛЕКТРОЛИЗЕРА
Цель работы. Знакомство с устройством и балансовый расчет модельного электролизера.
Основные определения, теория и технология
Принципиальная идея, положенная в основу конструкций современных ванн для электролиза глинозема, принадлежит американцу Бредлею, который в 1883 г. впервые предложил электролизер без внешнего подогрева. Независимые заявки на получение патента на способ электролитического получения алюминия были поданы 23 апреля 1886 г. П.Эру во Франции и 9 июля 1886 г. Ч.Холлом в США, которые и стали основоположниками современного производства алюминия (рис.1).
Для электролитического получения алюминия служит электролизер, часто называемый электролизной или алюминиевой ванной. Устройство электролизера схематически представлено на рис.2. Неглубокая шахта (ванна электролизера) заполнена электролитом. В электролит опущен анод из угольной массы, катодом служит угольная подина ванны, точнее, в работающем электролизере им служит слой жидкого алюминия, постоянно находящийся на подине. К аноду и подине (катоду) подведены токопроводящие шины. Над расплавом на границе с воздухом образуется корка застывшего электролита. Слоем застывшего электролита покрыты изнутри боковые стенки (боковой гарнисаж) и отчасти (около стенок) подовая поверхность ванны.
Таким образом, алюминиевый электролизер любой конструкции и мощности состоит из катодного устройства, анодной системы, ошиновки (анодной и катодной) и опорных металлоконструкций. Кроме этих основных узлов, электролизеры снабжены специальными приспособлениями для улавливания и отвода газов, выделяющихся при электролизе.
По конструкции катодного устройства электролизеры разделяются на оборудованные кожухом без днища (рис.2) и с днищем (рис.3).
По анодному устройству различают электролизеры с одним самоспекающимся анодом (сокращенно СА) и многоанодной конструкции с предварительно обожженными электродами (ОА). Конструкции типа СА, кроме того, по токоведущей части разделяются на электролизеры с боковым (БТ) и верхним (ВТ) подводом тока.
Наиболее прогрессивной и развивающейся с 70-х гг. ХХ в. является конструкция с предварительно обожженными анодами. Основные преимущества электролизеров этого типа следующие:
· меньшее падение напряжения в анодном узле за счет хорошего контакта анод – ниппель (на 0,15-0,20 В), что позволяет снизить падение напряжения на электролизере и уменьшить удельный расход электроэнергии;
· возможность широкого регулирования теплового хода электролизера за счет засыпки анодов слоем глинозема;
· снижение интенсивности электромагнитных и гидродинамических сил;
· минимизация перегрева электролита под серединой анода, что способствует получению более высоких выходов по току;
· возможность повышения единичной мощности электролизеров.
Вместе с тем, электролизерам ОА присущи и некоторые недостатки, в частности, большие затраты труда на перестановку и регулирование каждого анода (тогда как на электролизерах БТ и ВТ регулируется положение всего анодного блока) и использование более дорогого анодного материала. Чтобы получить предварительно обожженный анод, необходимо иметь специальное производство анодов, участок их демонтажа и монтажа, в то время как для электролизеров СА требуется лишь сырая анодная масса. Следовательно, увеличиваются капитальные вложения и общие затраты труда. Необходимо также отметить, что в производство анодов должны быть возвращены «огарки» – несгораемая часть анодов.
Однако преимущества электролизеров ОА, в том числе улучшение санитарно-гигиенических условий из-за отсутствия газообразных погонов коксования в атмосфере корпусов электролиза, привели к тому, что современная алюминиевая промышленность использует электролизеры только этого типа.
Катодное устройство служит механической основой электролизера любой конструкции. Оно обеспечивает также условия, необходимые для протекания процесса электролиза в криолитоглиноземном расплаве. Поскольку электролиз идет в весьма агрессивной среде при 950-1000 °С, к катодному устройству предъявляются довольно жесткие требования:
· устойчивость к действию расплавленных фтористых солей;
· достаточно высокие теплоизоляционные свойства;
· электропроводность в зоне протекания процесса;
· способность выдерживать тепловые и механические напряжения;
· продолжительная работоспособность между ремонтами и мобильность при замене в целях сокращения простоя электролизера в ремонте.
Катодное устройство представляет собой заключенную в металлический кожух шахту, выложенную угольными блоками или набитую углеродистой массой. Между кожухом и угольной футеровкой размещены теплоизоляционные материалы (как правило, шамотный кирпич или шамотная засыпка). Угольная футеровка монтируется на цоколе из теплоизоляционных материалов. Такая футеровка устойчива к воздействию криолитового расплава и сравнительно хорошо проводит ток, что особенно важно, так как подина служит катодом электролизера. Во время работы электролизера расплавленный алюминий и электролит проникают в толщу теплоизоляционных материалов, вызывая в них физико-химические превращения, приводящие к появлению значительных деформирующих напряжений. Для защиты шахты от разрушающего действия этих напряжений служит металлический кожух.
Глубина шахты катодного устройства зависит от единичной мощности электролизера, геометрических размеров анодного массива, типа применяемого катодного кожуха и составляет обычно 400-600 мм. Внутренние размеры шахты в плане зависят от геометрических размеров анодного массива. В промышленных электролизерах расстояние от продольных и торцовых сторон анода до стенки шахты принимается равным 550-650 и 500-600 мм соответственно.
Устройство катодного кожуха и его прочность во многом определяют продолжительность межремонтного срока работы электролизера. Поэтому с ростом единичной мощности электролизеров все большее распространение получают катодные кожухи рамного типа прямоугольной формы без металлического днища и контрфорсного типа с днищем.
Кожух без днища (см. рис.2) выполняется в виде сварной конструкции из стальных балок и листа. Наибольшее распространение получили кожухи без днища, сваренные из двутавровых балок или швеллеров. В верхней части кожуха с внутренней его стороны приварены кронштейны для установки бортового листа, закрывающего сверху боковую футеровку и защищающего ее от окисления во время эксплуатации. В нижней части кожуха вдоль продольной его стороны прорезаны окна для катодных токоотводящих стержней.
Катодные кожухи с днищем (см. рис.3) состоят из двух частей: корыта кожуха, сваренного из листовой стали, и балок-контрфорсов. Прочность таких кожухов определяется жесткостью конструкции контрфорсов, число которых зависит от длины электролизера. Бортовой лист, кронштейны для его крепления, окна для катодных стержней в кожухе этого типа выполняются так же, как и в кожухе рамного типа без днища.
Анодное устройство (см. рис.2 и 4) в электролизерах ОА представляет собой массив, состоящий из одного или двух обожженных анодов. В современных конструкциях применяют аноды размером 1450 ´ 700 ´ 600 мм. В анодах предусмотрены гнезда для ниппелей, контакт с которыми осуществляется залитым в гнезда чугуном. Ниппели соединены стальной траверсой, приваренной к алюминиевой анодной штанге. Контакт между штангой и алюминиевой несущей шиной осуществляется с помощью винтового зажима. Шины подвешены на домкратах подъемного механизма, укрепленного на анодной раме. В середине верхней части ванны находится короб, через который удаляются анодные газы. К нижней части короба приварены поперечные балки, на которые опираются крышки укрытия электролизера.
По мере срабатывания анодов анодная рама опускается до определенного предела, после которого она должна быть перетянута. Для этого каждую анодную штангу зажимают временным зажимом и, отпустив основные зажимы, придают раме движение вверх на 300-400 мм, после чего основные зажимы закрепляют, а временные освобождают.
Ошиновка электролизера, выполняемая из алюминиевых шин и лент, должна обеспечивать равномерное распределение тока по поверхности электродов, способствовать уменьшению действия электромагнитных сил в зоне электролита и быть достаточно дешевой.
Для современных электролизеров большой мощности предложена конструкция ошиновки с двусторонним подводом тока к анодной шине и расщеплением катодного пакета (рис.5). Расщепление катодных шин позволяет более равномерно распределять ток по поверхности электродов. Анодные стояки состоят из пакетов шин (жесткая часть) и алюминиевых лент (гибкая часть). Число шин в пакетах определяют, исходя из допустимой плотности тока. Для районов с дорогой электроэнергией оптимальной плотностью тока в алюминиевых шинах считается 0,25 А/мм2, с более дешевой энергией 0,40 А/мм2.
Независимо от типа электролизера, его конструкция должна обеспечивать оптимальный баланс процесса по расходуемым материалам и производимым продуктам, отвечать требованиям минимального потребляемого напряжения и стабильного температурного режима, т.е. балансу подведенного и расходуемого тепла. Соответствие конкретной конструкции перечисленным требованиям проверяется путем составления балансов.
Материальный баланс электролизера учитывает, что в процессе электролиза криолитоглиноземного расплава образуется алюминий, а расходуется глинозем и угольный анод с выделением газов. Кроме того, в результате испарения электролита, химического разложения его компонентов примесями, а также в результате уноса пыли вентиляционными газами из процесса постоянно выбывает некоторое количество фтористых солей и глинозема. В случае применения самообжигающегося анода часть анодной массы выбывает из процесса в виде летучих составляющих коксования.
При материальном расчете определяют производительность электролизера и расход сырья на производство алюминия. Расчет обычно ведут на 1 ч работы установки.
Производительность электролизера в килограммах алюминия в час может быть определена из закона Фарадея:
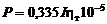 ,
,
где 0,335 – электрохимический эквивалент алюминия, г/(А×ч); I – сила тока, А,  i а – анодная плотность тока, А/см2;
i а – анодная плотность тока, А/см2;  – площадь сечения одного электрода, см2; n а – число электродов в анодном блоке;
– площадь сечения одного электрода, см2; n а – число электродов в анодном блоке;  – выход по току алюминия, %.
– выход по току алюминия, %.
Для расчета материального баланса принимаем по данным практики следующие расходы сырья и вспомогательных материалов на 1 кг получаемого алюминия, кг: глинозем 1,920; фтористый алюминий 0,025; криолит 0,020; анодная масса 0,520. Чтобы получить расход сырья в час для действующего электролизера, эти численные данные следует умножить на Р.
Потери глинозема объясняются наличием в его составе примесей и механическими потерями. Их можно определить, исходя из теоретического расхода глинозема – 1,89 кг на 1 кг алюминия, соответствующего стехиометрии реакции
Al2O3 = 2Al + 1,5 O2, (1)
в то время как реальные электродные процессы на катоде и аноде в большей мере соответствуют уравнениям
 + 6e = 2Al +
+ 6e = 2Al +  +
+  ;
;
 – 6e + 1,5С = 1,5СО2 + 3Al3+ +
– 6e + 1,5С = 1,5СО2 + 3Al3+ +  .
.
При этом потери глинозема составят P (1,92 – 1,89) кг.
Расход анодной массы обусловлен, в основном, реакциями горения на поверхности анода, связанными с выделением кислорода в процессе электролиза. За 1 ч по стехиометрии реакции (1) выделится 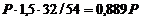 кг кислорода и с учетом его горения до СО и СО2 масса анодных газов (в килограммах)
кг кислорода и с учетом его горения до СО и СО2 масса анодных газов (в килограммах)
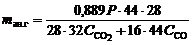 , (2)
, (2)
где  – соответственно массовая концентрация в анодных газах СО и СО2, доли ед.
– соответственно массовая концентрация в анодных газах СО и СО2, доли ед.
Тогда механические потери электродной массы и потери с угольной пеной (в килограммах)
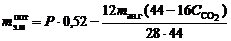 . (3)
. (3)
По данным расчета можно составить материальный баланс электролиза (табл.1).
Электрический баланс электролизера составляется на основе баланса напряжения
 , (4)
, (4)
где U ср – среднее напряжение; Е – теоретическое напряжение разложения с учетом поляризации; U эл – падение напряжения в электролите; 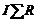 – падение напряжения в ошиновке, аноде, катоде, контактах и т.д.
– падение напряжения в ошиновке, аноде, катоде, контактах и т.д.
Таблица 1
Таблица 2
Таблица 3
Режим восстановления
| t, мин
| Р, мм рт.ст.
| t, °С
| D t /Dt, °С/мин
|
| 0
|
|
|
|
| 10
|
|
|
|
| ...
|
|
|
|
4. После завершения процесса в присутствии преподавателя отключить нагрев; кварцевую трубку с ретортой переместить в низкотемпературную зону и охладить под вакуумом в течение 15 мин. Затем заполнить систему воздухом и отключить вакуум-насос.
Взвесить конденсатор и твердый остаток, определить извлечение магния и выход огарка в процентах по формулам соответственно
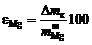 ;
; 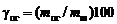 ,
,
где 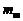 – масса брикетированной шихты;
– масса брикетированной шихты; 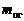 – масса огарка;
– масса огарка; 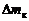 – изменение массы конденсатора;
– изменение массы конденсатора;  – масса магния в брикетированной навеске (по данным о количестве и составе магнийсодержащего компонента).
– масса магния в брикетированной навеске (по данным о количестве и составе магнийсодержащего компонента).
5. Используя графики 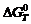 = f (Т) для образования оксидов (см. рис.1) выполнить термодинамические расчеты:
= f (Т) для образования оксидов (см. рис.1) выполнить термодинамические расчеты:
· Определить термодинамическую вероятность протекания реакции 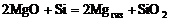 при температурах 1100, 1400, 1600, 2000 °С по данным о стандартном сродстве к кислороду магния и кремния при этих температурах.
при температурах 1100, 1400, 1600, 2000 °С по данным о стандартном сродстве к кислороду магния и кремния при этих температурах.
· По аналогии дать термодинамическую оценку реакции
2MgO + 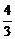 Al = 2Mg +
Al = 2Mg + 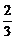 Al2O3.
Al2O3.
· Для указанного температурного диапазона дать термодинамическую характеристику возможности протекания реакций (2) и (3). Вычислить константы равновесия и равновесные давления паров магния при этих температурах:
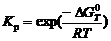 ;
; 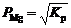 .
.
· Для реакций (2) и (3) по уравнению изотермы (1) определить возможность их протекания при температуре 1100 °С и давлении паров магния  , равном 0,5; 0,1; 0,01; 0,001; 10-4 ат.
, равном 0,5; 0,1; 0,01; 0,001; 10-4 ат.
6. Дать анализ вероятности протекания приведенных реакций в условиях лабораторного опыта. Объяснить результаты эксперимента.
Работа 4. ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ МАГНИЯ ИЗ РАСПЛАВЛЕННЫХ ХЛОРИДОВ
Цель работы. Знакомство с теоретическими и технологическими основами производства магния электролизом расплавленных хлоридов. Приобретение практических навыков проведения электролиза расплавленных сред. Выполнение термодинамических и технологических расчетов.
Основные определения, теория и технология
Впервые магний был выделен при восстановлении MgO парами калия английским физиком Х.Дэви в 1800 г. Французский химик С.-К.Девиль в середине XIX в. получил магний, восстанавливая MgCl2 парами калия и натрия. К концу XIX в. во Франции, Германии и США работали небольшие заводы, использующие этот процесс, остававшийся, однако, мало эффективным. В 1830 г. М.Фарадей впервые получил магний электролизом расплава MgCl2. В последующем этот способ был усовершенствован Матиссеном и С.-К.Девилем и в настоящее время является наиболее распространенным в производстве металлического магния.
Обладая низкой плотностью (1,745 г/см3), высокой коррозионной стойкостью и химической активностью, магний находит применение в автомобиле- и самолетостроении, в производстве космической техники, в металлургии коррозионно-устойчивых сплавов, в производстве тугоплавких редких металлов. Этим объясняется неизменный рост производства магния, чему способствует неисчерпаемые ресурсы природного сырья и высокое (2,4 %) содержание магния в земной коре.
Главным сырьевым источником для получения магния электролитическим методом служат его хлориды: бишофит MgCl2×6H2O и карналлит KCl×MgCl2×6H2O.
Технико-экономические показатели электролитического получения магния в значительной мере определяются физико-химическими свойствами электролита и обусловливаются его составом. При питании электролизеров расплавом карналлита содержание основных компонентов в электролите устанавливается самопроизвольно, исходя из их содержания в исходном обогащенном карналлите. Состав такого электролита не является оптимальным. Содержание, например, NaCl в нем не превышает 14 %.
Сопоставление физико-химических свойств различных электролитов и их технологических показателуй, показало, что наиболее благоприятным сочетанием свойств обладает натриево-калиевый электролит, содержащий 8-18 % MgCl2, и по 38-42 % NaCl и КС1. Однако в таком электролите MgCl2 имеет повышенную активность способствующую интенсивному шламообразованию, что, в свою очередь, приводит к пассивации катодов и снижению выхода магния по току.
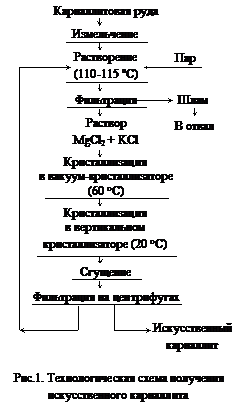
К магниевому электролиту предъявляются высокие требования по чистоте и постоянству состава, поэтому природную карналлитовую руду после дробления и отделения пустой породы направляют на производство так называемого искусственного карналлита, (рис.1). Искусственный карналлит имеет примерно следующий состав, % по массе: MgCl2 31-32,5, КС1 25-26, NaCl 5-6, Н2О 34-36. При производстве магния в электролизер периодически вводят хлорид магния или карналлит, которые должны быть предварительно тщательно обезвожены.
При нагревании MgCl2×6H2O ступенчато теряет кристаллизационную воду, переходя с повышением температуры от одной формы кристаллогидрата к другой:
MgCl2×6H2O ® MgCl2×4H2O (более 117 °C);
MgCl2×4H2O ® MgCl2×2H2O (более 182 °C);
MgCl2×2H2O ® MgCl2×H2O (более 242 °C).
Однако уже при температуре выше 184 °С идет образование гидроксохлорида магния по реакции
MgCl2×2H2O = MgOHCl + HCl + H2O.
При температуре выше 554 °С происходит распад гидроксохлорида магния по реакции
MgOHCl = MgO + HCl.
Таким образом, полного обезвоживания гидратов хлорида магния простым нагреванием на воздухе достигнуть невозможно, так как повышение температуры сверх 150-260 °С приводит только к их гидролизу с образованием в конечном счете МgО и НСl. Для предотвращения гидролиза необходи



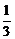 А1 + NaF = Na +
А1 + NaF = Na +  AlF3 =
AlF3 = 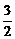 AlF).
AlF).



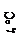
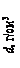

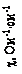
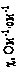
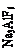
 ,
, ,
, – соответственно масса электролита, NaF и AlF3 в пробе анализируемого электролита;
– соответственно масса электролита, NaF и AlF3 в пробе анализируемого электролита; 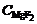 – концентрация в электролите MgF2, доли ед.; 62 – молекулярная масса MgF2, г/моль.
– концентрация в электролите MgF2, доли ед.; 62 – молекулярная масса MgF2, г/моль.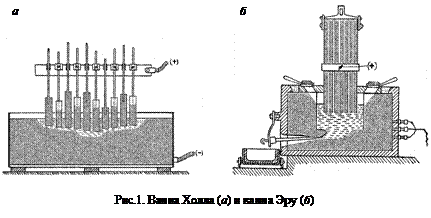




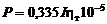 ,
, i а – анодная плотность тока, А/см2;
i а – анодная плотность тока, А/см2;  – площадь сечения одного электрода, см2; n а – число электродов в анодном блоке;
– площадь сечения одного электрода, см2; n а – число электродов в анодном блоке;  – выход по току алюминия, %.
– выход по току алюминия, %. + 6e = 2Al +
+ 6e = 2Al +  +
+  ;
;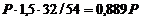 кг кислорода и с учетом его горения до СО и СО2 масса анодных газов (в килограммах)
кг кислорода и с учетом его горения до СО и СО2 масса анодных газов (в килограммах)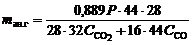 , (2)
, (2) – соответственно массовая концентрация в анодных газах СО и СО2, доли ед.
– соответственно массовая концентрация в анодных газах СО и СО2, доли ед.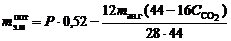 . (3)
. (3) , (4)
, (4)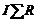 – падение напряжения в ошиновке, аноде, катоде, контактах и т.д.
– падение напряжения в ошиновке, аноде, катоде, контактах и т.д.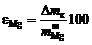 ;
; 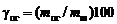 ,
,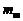 – масса брикетированной шихты;
– масса брикетированной шихты; 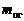 – масса огарка;
– масса огарка; 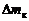 – изменение массы конденсатора;
– изменение массы конденсатора;  – масса магния в брикетированной навеске (по данным о количестве и составе магнийсодержащего компонента).
– масса магния в брикетированной навеске (по данным о количестве и составе магнийсодержащего компонента).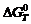 = f (Т) для образования оксидов (см. рис.1) выполнить термодинамические расчеты:
= f (Т) для образования оксидов (см. рис.1) выполнить термодинамические расчеты: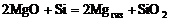 при температурах 1100, 1400, 1600, 2000 °С по данным о стандартном сродстве к кислороду магния и кремния при этих температурах.
при температурах 1100, 1400, 1600, 2000 °С по данным о стандартном сродстве к кислороду магния и кремния при этих температурах.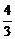 Al = 2Mg +
Al = 2Mg + 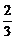 Al2O3.
Al2O3.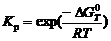 ;
; 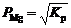 .
. , равном 0,5; 0,1; 0,01; 0,001; 10-4 ат.
, равном 0,5; 0,1; 0,01; 0,001; 10-4 ат.