И.С. Почекутов, С.Р. Лоскуто в


Красноярск, 2014
 Министерство образования и науки Российской Федерации
Министерство образования и науки Российской Федерации
ФГБОУ ВПО «Сибирский государственный технологический университет»
П.В. Миронов, Е.В. Алаудинова
И.С. Почекутов, С.Р. Лоскутов
Инструментальные методы исследования в химической технологии и биотехнологи
Утверждено редакционно-издательским советом СибГТУ в качестве учебного пособия по самостоятельной работе для студентов
Направления 240100.62 (18.03.01) «Химическая технология»,
профиля подготовки «Химическая технология переработки древесины»; направления 240700.62 (19.03.01) «Биотехнология»
Очной и заочной форм обучения
Красноярск, 2014
 Миронов, П. В. Инструментальные методы исследования в химической технологии и биотехнологии: учебное пособие по самостоятельной работе для студентов направления 240100.62 (18.03.01) «Химическая технология» профиля подготовки «Химическая технология переработки древесины»; направления 240700.62 (19.03.01) «Биотехнология» очной и заочной форм обучения / П. В. Миронов, Е. В. Алаудинова, И. С. Почекутов, С. Р. Лоскутов. – Красноярск: СибГТУ, 2014. – 135 с.
Миронов, П. В. Инструментальные методы исследования в химической технологии и биотехнологии: учебное пособие по самостоятельной работе для студентов направления 240100.62 (18.03.01) «Химическая технология» профиля подготовки «Химическая технология переработки древесины»; направления 240700.62 (19.03.01) «Биотехнология» очной и заочной форм обучения / П. В. Миронов, Е. В. Алаудинова, И. С. Почекутов, С. Р. Лоскутов. – Красноярск: СибГТУ, 2014. – 135 с.
В учебном пособии рассмотрены основные современные методы физико-химического анализа, широко применяемые в различных областях науки, техники и технологии. Важнейшей задачей пособия является ознакомление студентов с теоретическими основами физико-химических методов исследования; устройством и принципами работы современной аналитической аппаратуры; приобретение необходимых знаний и навыков, необходимых для дальнейшей исследовательской работы.
Кроме того, пособие, несомненно, будет полезно магистрам, аспирантам и специалистам, занимающимся исследованиями в многообразных сферах науки и производства с применением инструментальных методов.
Рецензенты: канд. техн. наук Киселёв Е.Г. (CФУ);
канд. техн. наук, доцент Решетова Н.C. (научно-методический совет СибГТУ)
Одобрено и рекомендовано к печати редакционно-издательским советом
СибГТУ
© П.В. Миронов, Е.В. Алаудинова, И.С. Почекутов, С.Р. Лоскутов
© ФГБОУ ВПО «Сибирский государственный технологический университет», 2014
ОГЛАВЛЕНИЕ
|
| С.
|
| Введение.………………………………………………………………........
| 4
|
| ГЛАВА 1 О бщие вопросы теории физико-химического анализа.......
| 6
|
| 1.1 Характеристика физико-химических методов…………......................
| 6
|
| 1.2 Оформление результатов эксперимента................................................
| 14
|
| ГЛАВА 2 О птические методы анализа……………..………………….
| 31
|
| 2.1 Теоретические основы оптических методов анализа.................……..
| 31
|
| 2.2 Инфракрасная спектроскопия, спектроскопия комбинационного
|
|
| рассеяния.........................................................................................................
| 40
|
| 2.3 Инфракрасная спектроскопия: качественный и количественный анализ...............................................................................................…………
| 52
|
| 2.4 Спектроскопия в УФ- и видимой областях: качественный и
|
|
| количественный анализ.................................................................................
| 62
|
| 2.5 Фотометрия мутных сред………………………………………............
| 77
|
| 2.6 Люминесцентный анализ……………………………………….............
| 82
|
| ГЛАВА 3 Рентгеновская спектроскопия
| 92
|
| 3.1 Рентгеновская спектроскопия: возбуждение внутренних электронов....
| 92
|
| 3.2 Рентгенофлуоресцентный анализ...................................................................
| 94
|
| 3.3 Рентгенодифракционные методы...........................................................
| 104
|
| ГЛАВА 4 Хроматографические методы анализа...................................
| 106
|
| 4.1 Газовая хроматография............................................................................
| 106
|
| 4.2 Жидкостная хроматография....................................................................
| 122
|
| Библиографический список...........................................................................
| 131
|
| Приложение А (справочное) Перечень ключевых слов.............................
| 133
|
ВВЕДЕНИЕ
Для проведения исследований в различных областях науки необходима специальная, часто сложная и дорогостоящая аппаратура. Для работы с ней требуются высококвалифированные работники, которые обязаны чётко знать принципы и теоретические основы применяемого инструментального метода, его возможности и ограничения, а также устройство конкретного прибора, порядок работы на нём, источники возможных ошибок.
Инструментальные методы объединяют большое число количест-венных методов, основанных на измерении различных физико-химичес-ких свойств соединений или простых веществ, таких как: плотность, поверхностное натяжение, вязкость, поглощение электромагнитной энергии, преломление света, вращение плоскости поляризации, флуоресценция и фосфоресценция, дифракция электронов и рентгеновских лучей, ядерный магнитный резонанс, электрохимические, термодинамические и др.
Широкое распространение инструментальных методов, в первую очередь, связано с их значительно большей чувствительностью по сравнению с химическими. Если при помощи обычных химических методов можно установить концентрацию вещества порядка 10-5 моль/л, то для некоторых физико-химических методов определяемый минимум – 10-9-10-10 моль/л, что, примерно, на пять порядков меньше. Это преимущество особенно важно в тех случаях, когда должна решаться задача определения токсичных микропримесей (например, при оценке содержания или эмиссии вредных веществ из различных материалов). Другое преимущество инструментальных методов – селективность. Спектральные, хроматографические, масс-спектромет-рические и др. методы позволяют одновременно определять десятки компонентов, что делает их незаменимыми не только в практике научных исследований, но и в производственных условиях для технологического контроля. Ещё одно несомненное преимущество физико-химических методов анализа и контроля перед обычными химическими методами заключается в возможности максимально автоматизировать аналитические процессы, а в ряде случаев выполнять анализы, не разрушая исследуемые объекты.
Сегодня наиболее широко применяются разнообразные хроматографические методы; методы спектрального анализа в видимой, УФ- и ИК-областях электромагнитного спектра; методы ЯМР и масс-спектроскопии; термического анализа и др. Эти методы неравнозначны как по аналитическим возможностям, так и по сложности решаемых с их помощью задач.
Основная задача настоящего учебного пособия – помочь студентам, изучающим дисциплины «Инструментальные методы исследования в биотехнологии», «Инструментальные методы исследования в химической технологии», а также «Основы научных исследований» самостоятельно ознакомиться с теоретическими основами инструментальных методов; устройством и принципами работы современной аналитической аппаратуры; статистической обработкой и оформлением экспериментальных результатов, формируя, таким образом, следующие профессиональные компетенции - для направления 240100.62 (18.03.01) «Химическая технология»: способность и готовность использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ПК-1); планировать и проводить физические и химические эксперименты, проводить обработку их результатов и оценивать погрешности, математически моделировать физические и химические процессы и явления, выдвигать гипотезы и устанавливать границы их применения (ПК-21);
- для направления 240700.62 (19.03.01) «Биотехнология»: владение основными методами и приемами проведения экспериментальных исследований в своей профессиональной области; способость проводить стандартные и сертификационные испытания сырья, готовой продукции и технологических процессов (ПК-7); владение планированием эксперимента, обработкой и представлением полученных результатов (ПК-8).

ГЛАВА 1 ОБЩИЕ ВОПРОСЫ ТЕОРИИ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
Оформление результатов эксперимента
Оценка воспроизводимости и правильности анализа – необходимый этап при решении задач физико-химическими методами. Эти показатели существенно зависят от различных видов погрешностей при анализах.
Вне зависимости от источника погрешности (ошибки) по своей природемогут быть грубыми (промахи), систематическими или случайными.
Грубые ошибки возникают, как правило, из-за невнимания и усталости исследователя, временного выхода из строя измерительного прибора. Обычно такие ошибки проявляются при записи измеренной величины на фоне результатов анализов других проб, например ошибка в порядке числа: 12,2 вместо 122 и пр. Для устранения грубых погрешностей требуются повторные измерения. Тщательная и аккуратная работа, контроль помогают избежать грубых погрешностей. Наиболее часто встречаются промахи – явные огрехи анализа, допущенные из-за некомпетентности аналитика. Типичный пример промаха – ошибочный отбор аликвотной пробы в объёмном анализе, когда пипетка, градуированная в двух сечениях, используется как пипетка, градуированная на полное вытекание жидкости.
Систематические погрешности – это односторонние (по знаку) погрешности, вызванные неисправностью измерительного прибора, недостатком метода. Если величина систематической погрешности известна, то учёт её (исключение) не представляет труда. Причины систематической погрешности можно установить при детальном рассмотрении процедуры анализа.
Случайные погрешности, в отличие от систематических, не имеют видимой причины. Точнее говоря, причины их столь многочисленны и каждая из них столь незначительно влияет на общий результат анализа, что рассматривать их индивидуально не имеет смысла. Общая случайная погрешность непостоянна ни по абсолютному значению, ни по знаку, но появление существенной случайной погрешности тем менее вероятно для каждого анализа, чем больше её абсолютное значение. Оценка случайных погрешностей проводится на основе теории математической статистики. К. Гаусс в начале XIX в. показал, что случайные ошибки подчиняются так называемому нормальному закону распределения, из которого следует: чем больше ошибка, тем реже она встречается, а положительные ошибки так же вероятны, как и отрицательные (рисунок 1.2).
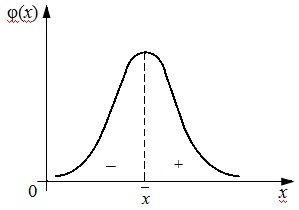
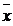 –среднее значение; φ(x) – относительная вероятность измерения х.
–среднее значение; φ(x) – относительная вероятность измерения х.
Рисунок 1.2 – Кривая плотности вероятности нормально
распределенной случайной величины
 Графики, полученные при многократных анализах в зависимости от наличия в них погрешностей
Графики, полученные при многократных анализах в зависимости от наличия в них погрешностей 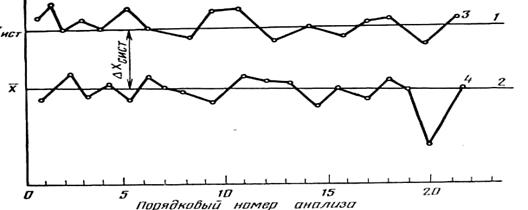 , представлены на рисунке 1.3.
, представлены на рисунке 1.3.
1 – безупречный анализ (х ист); 2 – то же с систематической погрешностью (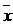 );
);
3 – ломаная линия, отвечающая эксперименту без систематической погрешности;
4 – реальный случай химического анализа; Δ х сист – систематическая погрешность.
Рисунок 1.3 – Случайные и систематические погрешности при
многократных анализах
На оси абсцисс отложен порядковый номер параллельного анализа из числа многократных определений, на оси ординат – найденные в процессе анализа значения содержания компонента х (Сх). Для наглядности точки, соответствующие результатам отдельных серий анализа, соединены ломаными или прямыми линиями. Прямая 1 отвечает безупречному анализу, когда во всех многократных определениях отсутствуют как систематические, так и случайные погрешности, равно как и промахи. Этот пример, несомненно, идеализирован. Идеализированными считают и примеры, которым отвечают прямая линия 2(отсутствие случайных погрешностей, все результаты анализа отягощены постоянной отрицательной систематической погрешностью) и ломаная линия 3 (отсутствие систематической погрешности, среднее значение определяемой величины совпадает с истинным).
Реальным случаям химического анализа отвечает ломаная линия 4, где результаты анализа осложнены постоянной систематической погрешностью и случайной погрешностью переменной величины. Результат анализа № 20 в четвёртой серии вызывает подозрение, так как он сильно отличается от среднего 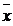 . Не исключено, что при выполнении этого анализа допущен промах. Систематическая погрешность характеризует правильность результата. Случайные ошибки определяют его точность и воспроизводимость.
. Не исключено, что при выполнении этого анализа допущен промах. Систематическая погрешность характеризует правильность результата. Случайные ошибки определяют его точность и воспроизводимость.
Для характеристики качества анализа рекомендуется использовать количественно определяемые понятия правильность и воспроизводимость, а термин точность оставлен как качественное понятие, характеризующее и правильность, и воспроизводимость метода одновременно.
Чувствительность анализа выражают как тангенс угла наклона калибровочного (градуировочного) графика. В аналитической химии это означает, что систематические погрешности нельзя устранить многократным повторением анализа, поэтому нужно выявить причины и учесть их при подведении результатов анализа. Случайные погрешности нельзя устранить. Их только можно и нужно свести к минимуму. Чем больше случайный разброс данных при анализе, тем больше должно быть число определений. Усреднение последних даст результат измерений, наиболее близкий к истинному, соответственно, меньше будет вероятность близости единичного результата измерений к истинному значению.
Погрешности могут возникнуть на всех этапах выполнения анализа. При отборе пробы, например, появляются случайные погрешности, связанные с негомогенностью вещества (гетерогенные фазы) или градиентом концентраций (гомогенные фазы). Перечисленных погрешностей нельзя полностью избежать даже при правильном отборе пробы. Неверный отбор пробы приводит к неизбежному преобладанию отдельных компонентов в пробе и возникновению систематической погрешности. Поэтому в процессе подготовки пробы к анализу её обычно растворяют. При этом случайными погрешностями можно пренебречь, а возможность появления систематических погрешностей (загрязнения от реактивов и материала сосудов) будет мала.
Методы разделения, применяемые при подготовке пробы к анализу, могут быть источником больших систематических и случайных погрешностей, связанных с неполным разделением из-за осаждения, частичного растворения, соосаждения, а также влияния на эти процессы изменения температурных условий. Непосредственный процесс измерения неизбежно связан с возникновением случайных погрешностей при получении сигнала, например, в результате температурных колебаний во время работы с пламенным фотометром, а также при трансформировании полученного сигнала в электрический, его усилении и преобразовании (шумы). Описанные случайные погрешности сказываются на результатах, как правило, занижая их. Систематические погрешности измерений и оценки результатов можно устранить точным соблюдением условий работы и правильной градуировкой.
Погрешности измерений и оценки результатов измерений должны быть меньше, чем погрешности самого аналитического метода. При работе с растворами несложно установить, даёт ли данный метод анализа систематические ошибки. Для этого значение, полученное в результате анализа, сравнивают с теоретическим, поскольку известно соотношение компонентов в приготовленном стандартном растворе. По-другому обстоит дело при работе с твёрдыми веществами, когда сложно приготовить стандарт с гомогенным составом. В таком случае правильность метода анализа для часто встречающихся на практике гетерогенных объектов считают доказанной, если найденное значение совпадает с результатом, полученным другим методом, отличным от первого. При расхождении результатов решить вопрос о том, какой из методов даёт систематическую погрешность, можно только с привлечением нескольких (большего числа) методов анализа.
Различают три вида систематических погрешностей. Аддитивные погрешности возникают, если, например, не учитывают расход реагентов на холостую пробу и др. Причиной появления погрешностей другого вида – мультипликативных – служит, например, неверный титр или неправильно проведённая градуировка. К третьему виду относятся погрешности, нелинейно связанные с изменяемой величиной. Причины их появления многообразны и должны быть определены в каждом конкретном случае.
Метод анализа, полностью свободный от систематических погрешностей, не свободен от случайных погрешностей. Выявление случайных погрешностей можно осуществить при статистическом описании вероятности их появления в процессе анализа определённого числа проб. Погрешности можно выразить в абсолютных единицах с размерностью определяемых величин (мг, моль, моль/л и т.д.) и относительных единицах (обычно %).
Точность метода анализа – довольно сложная его характеристика, в которой необходимо различать две стороны: воспроизводимость и правильность.Воспроизводимость измеряют отклонением отдельных результатов от среднего значения, правильность – отклонением среднего значения от истинного.
Воспроизводимость – необходимый, но недостаточный признак правильности результатов. Без удовлетворительной воспроизводимости нельзя ожидать и точности. Однако даже хорошая воспроизводимость вовсе не доказывает точность метода. Воспроизводимость устанавливается по обычным правилам статистической обработки результатов, её расчёт не вызывает затруднений.
Однако никакая математическая обработка результатов не может решить вопрос об их правильности или неправильности. Этот вопрос может быть решён только экспериментально, при помощи следующих приёмов:
- выполнение анализа другим методом;
- способ добавок, т.е. перед началом анализа в образец вводят точное количество вещества, подлежащего определению;
- полный анализ и учёт возможного влияния других элементов;
- параллельный анализ стандартного образца, близкого по составу.
Осуществление любых опытов, в том числе и определений физико-химическими методами, почти всегда предполагает не одно, а ряд повторных измерений, результаты которых будут пригодны для дальнейшей статистической обработки. Отдельные измерения всегда отличаются друг от друга, их разброс определяет точность анализа и характеризуется случайной погрешностью наблюдения. Погрешности связаны с несовершенством наших органов чувств, изменением внешних условий (температуры, влажности, давления), случайными причинами, например, грязными стенками бюретки, заеданием стрелки прибора и др.
Среднее значение полученного результата по разным причинам может отличаться от истинного. Разница между ними определяет правильность определения и представляет собой систематическую погрешность, которая повторяется от опыта к опыту. Причиной случайной погрешности могут быть несовершенство приборов, влияние посторонних компонентов, загрязнение реактивов и др.
Обработка результатов измерений включает следующие процедуры:
- определение среднего арифметического (n) по данным нескольких параллельных измерений;
- вычисление стандартного отклонения (S) по формуле
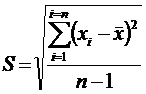 ; (1.1)
; (1.1)
- вычисление при необходимости величины стандартного отклонения среднего значения по формуле
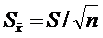 . (1.2)
. (1.2)
Математическая теория погрешностей требует определения ещё одной величины – точности прямого измерения (ε). Эту величину определяют по уравнению, вывод которого можно найти в математической теории погрешностей. При использовании этого уравнения задаются значением надёжности (α), т.е. долей случаев, в которых при данном числе измерений среднее арифметическое лежит в определённых пределах. При физико-химических и аналитических измерениях обычно принимают α = 0,95 или α = 0,99. Это означает, что 95 или 99 % всех измерений лежит в указанных пределах:
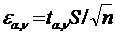 . (1.3)
. (1.3)
Коэффициент tα , ν называют коэффициентом нормированных отклонений, или критерием Стьюдента, его величину находят по специальным таблицам в зависимости от α и v = n – 1. Величину v называют числом степеней свободы. Коэффициенты нормированных отклонений для значений α,равных 0,95 и 0,99 приведены в таблице 1.1.
Таблица 1.1 – Коэффициенты нормированных отклонений tα , ν
| α
| v = n – 1
|
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
|
| 0,95
| 4,30
| 3,18
| 2.78
| 2,57
| 2,45
| 2,37
| 2,31
| 2,26
| 2,23
|
| 0,99
| 9,93
| 5,84
| 4.60
| 4,03
| 3,71
| 3,50
| 3,36
| 3,25
| 3,17
|
Математическая теория погрешностей позволяет определить грубые
погрешности (d груб) при помощи трех критериев:
- по стандартному отклонению, тогда
d груб > 3 S / 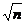 ; (1.4)
; (1.4)
- по точности прямого измерения, тогда
d груб > εα,ν  ; (1.5)
; (1.5)
- по Q -критерию, который вычисляют по формуле
Q = (x 1 – x 2)/ R, (1.6)
где R – размах варьирования.
Грубой погрешностью считают ту, для которой Q -критерий больше табличного, определённого в зависимости от числа степеней свободы v и надёжности α. Значения этого критерия приведены в таблице 1.2.
Таблица 1.2 – Значения Q -критерия
| α
| v = n – 1
|
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
|
| 0,95
| 0,94
| 0,77
| 0,64
| 0,56
| 0,51
| 0,48
| 0,46
| 0,45
|
| 0,99
| 0,99
| 0,89
| 0,76
| 0,70
| 0,64
| 0,58
| 0,53
| 0,48
|
Первые два критерия наиболее точные, но требуют полного расчёта погрешностей. Q -критерий часто позволяет исключить грубые погрешности, что может значительно сократить время обработки результатов. После исключения грубых погрешностей точность измерений значительно повышается. Таким образом, стандартное отклонение S, а также точность прямого измерения ε характеризуют точность результатов наблюдения (если для данной серии опытов можно вывести среднее значение). В некоторых случаях из серии наблюдений среднее вывести нельзя. Например, сравнивают результаты определений, полученные для разных навесок анализируемого вещества. В этом случае в качестве критерия точности измерений применяют стандартное отклонение S.
Если измерения сделаны неточно, то полученные значения измеряемых величин резко различаются, а квадратичная погрешность слишком велика. Если же наблюдатель внимателен и строго следит за тем, чтобы условия работы были одинаковыми, то результаты наблюдения близки. Для оценки точности наблюдений сравнивают значение стандартного отклонения S с точностью отсчётов на применяемых приборах. Если оно лежит в пределах точности отсчётов, то измерения проведены удовлетворительно. Для уменьшения стандартного отклонения иногда повторяют наблюдения или увеличивают их число, при этом всегда обращают особое внимание на точность отсчётов. В результате можно составить поэтапную схему обработки результатов измерений:
- определение среднего значения ряда вариантов;
- установление отклонения полученного значения от среднего для каждого варианта;
- определение стандартного отклонения;
- нахождение по таблицам коэффициента нормированных отклоне-ний при заданной надёжности и числе вариантов;
- определение точности прямого измерения;
- установление грубых просчётов по какому-либо критерию;
- повторная обработка данных по этой же схеме после исключения грубых просчётов (если снова обнаруживается необходимость исключения вариан-тов, что указывает на некачественный эксперимент);
- если грубый просчёт прерывает ряд вариантов, следовательно, в эксперимент вкралась ошибка, он должен быть повторён заново;
- при выполнении анализов физико-химическими методами погрешности могут возникать на разных этапах, наиболее важные среди них: отбор средней пробы и взятие навески, подготовка навески к анализу (растворение, выделение анализируемого вещества, осуществление аналитической реакции и т.д.), выполнение физико-химического измерения.
На каждом из этапов возникающие стандартные отклонения различны по величине. Общее стандартное отклонение определяется по формуле
S ∑ = 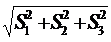 . (1.7)
. (1.7)
В некоторых случаях необходимо определить стандартные отклонения на каждом из указанных этапов:
- чтобы определить погрешность физико-химических измерений, отобранную навеску обрабатывают, делят на несколько параллельных проб и выполняют необходимые измерения. При таком способе работы погрешности анализа связаны исключительно с погрешностью, допускаемой при физико-химических измерениях, а суммарное стандартное отклонение определения равно стандартному отклонению физико-химических измерений: S ∑ = S 3;
- для определения погрешности, возникающей при подготовке пробы, обработанную навеску делят на несколько аликвотных частей, каждую из них обрабатывают отдельно и выполняют физико-химические измерения ряда параллельных проб. В этом случае суммарное отклонение будет зависть не только от погрешности, связанной с физико-химическими измерениями, но и от погрешности, связанной с подготовкой пробы: S ∑ =  . Если погрешность физико-химического определения известна (определена по предыдущей схеме), тогда: S 2 =
. Если погрешность физико-химического определения известна (определена по предыдущей схеме), тогда: S 2 =  ;
;
- для определения погрешности, возникающей при отборе пробы, выполняют ряд анализов из параллельно отобранных проб, отклонение вычисляют по формуле S ∑ =  , если известны S 2и S 3, то S 1=
, если известны S 2и S 3, то S 1=  .
.
Систематические погрешности можно обнаружить и устранить при помощи калибровки приборов по эталонам стандартным веществам или при осуществлении контрольных опытов.
Эталонными называют специально поверенные приборы, показа-ниям которых можно вполне доверять. Их изготовляют с особой тщательностью, проверяют в специальных лабораториях и снабжают паспортом, в котором указаны присущие прибору погрешности. Эталонные приборы служат исключительно для поверки приборов, применяемых в повседневной работе. При поверке опыт ставят так, чтобы можно было сделать одновременно отсчёты, как по эталонному, так и по калибруемому прибору. В некоторых случаях, когда изменение показаний идёт быстро и непрерывно, применяют метод чередующихся отсчётов. Например, для поверки амперметра составляют схему из аккумулятора, реостата, проверяемого и эталонного амперметров. Все приборы включают последовательно. Изменяя реостатом сопротивление цепи, а, следовательно, и силу тока, отсчитывают показания сразу по обоим амперметрам и находят отклонение показаний калибруемого амперметра от эталонного. Другим методом калибровки служит калибровка по стандартным веществам. Для этого, например, измеряют калибруемым термометром температуру плавления, кипения, превращения стандартных веществ и сравнивают полученные данные с данными, приведёнными в справочной литературе. На основании полученных данных строят графики поправок для любых температур в заданном интервале. При калибровке по стандартным веществам следует особое внимание обратить на чистоту реактивов, так как ничтожные примеси могут сильно изменить результаты калибровки.
В некоторых случаях систематическая погрешность может быть внесена не прибором, а самим методом анализа. Например, погрешность вследствие электропроводности или окраски фона при кондуктометрическом или колориметрическом определениях. Такую погрешность измерения находят, осуществляя анализ со всеми необходимыми для него реагентами, но без определяемого вещества – так называемый контрольный опыт. Соответствующие показания прибора характеризуют погрешности – отклонения, вносимые в показания приборов фоном.
Иногда систематическую погрешность метода, прибора или самого наблюдателя можно обнаружить анализом вещества с точно установленным содержанием определяемого компонента. Если по данным статистической обработки истинное значение определяемой величины (х ист) находится в пределах значения полученного среднего ( )с учётом точности прямого измерения:
)с учётом точности прямого измерения:  – εα,ν < х ист <
– εα,ν < х ист <  + εα,ν, то это свидетельствует об отсутствии систематической погрешности опыта.
+ εα,ν, то это свидетельствует об отсутствии систематической погрешности опыта.
Общих рекомендаций по выбору метода определения систематической погрешности нет. Ниже при рассмотрении отдельных методов физико-хими-ческого анализа приведены способы поверки приборов, методы обнаружения систематических погрешностей, пути их устранения в конкретных случаях.
До сих пор речь шла только об абсолютных значениях погрешностей, но эти значения не всегда достаточны для характеристики точности измерений, так как не связаны с абсолютным значением определяемой величины. В связи с этим часто прибегают к определению относительных погрешностей.
Относительным стандартным отклонением (V) называют выраженное в относительных единицах или процентах отношение стандартного отклонения S к среднему значению измеряемой величины  :
:
V = S /  или V = (S /
или V = (S / 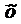 ) 100 %. (1.8)
) 100 %. (1.8)
Иногда относительное значение точности прямого измерения вычисляют по формуле
Е = εα,ν /  или Е = (εα,ν /
или Е = (εα,ν /  ) 100 %. (1.9)
) 100 %. (1.9)
В некоторых случаях относительное стандартное отклонение V называют коэффициентом вариации.
При расчётах всегда необходимо учитывать точность, с которой выполняют измерения физико-химических величин. Одной из грубейших и часто встречающихся погрешностей при вычислениях может быть излишняя, неоправданная точность вычислений. Например, масса т вещества установлена на технических весах с точностью до 0,01 г, а объём V измерен мензуркой с точностью до 0,1 мл. При этом получено: т = 28,34 г, V = 8,4 мл. При вычислении по таким данным плотности ρ нет необходимости делить с точностью до четвёртого знака: ρ = 28,34/8,4 = 3,3738, так как подобное выражение результата свидетельствует не о точности измерения, а об отсутствии элементарной математической грамотности. Правильная запись в данном случае будет иметь вид: ρ = 28,34/8,4 = 3,4.
Графическая обработка результатов анализа. При обработке результатов физико-химических измерений широко применяют методы графического изображения и анализа. Графический метод даёт наглядное представление о взаимной связи между изучаемыми величинами и позволяет непосредственно осуществлять измерительные и вычислительные операции (интерполяция, экстраполяция, дифференцирование, интегрирование), причём сделать это (зачастую с достаточно высокой точностью), не прибегая к расчётам, которые могут оказаться сложными и трудоёмкими, а подчас и невозможными из-за того, что некоторые зависимости не всегда можно выразить в математической форме.
Графики облегчают сравнение величин, помогают непосредственно обнаружить точки перегиба (например, при титровании), максимумы и минимумы, условия наибольших и наименьших скоростей изменения величин, периодичность и другие особенности, которые ускользают при записи результатов в уравнениях и недостаточно отчётливо проявляются в таблицах. Известно, например, что исторически метод физико-химичес-ког





 Министерство образования и науки Российской Федерации
Министерство образования и науки Российской Федерации Миронов, П. В. Инструментальные методы исследования в химической технологии и биотехнологии: учебное пособие по самостоятельной работе для студентов направления 240100.62 (18.03.01) «Химическая технология» профиля подготовки «Химическая технология переработки древесины»; направления 240700.62 (19.03.01) «Биотехнология» очной и заочной форм обучения / П. В. Миронов, Е. В. Алаудинова, И. С. Почекутов, С. Р. Лоскутов. – Красноярск: СибГТУ, 2014. – 135 с.
Миронов, П. В. Инструментальные методы исследования в химической технологии и биотехнологии: учебное пособие по самостоятельной работе для студентов направления 240100.62 (18.03.01) «Химическая технология» профиля подготовки «Химическая технология переработки древесины»; направления 240700.62 (19.03.01) «Биотехнология» очной и заочной форм обучения / П. В. Миронов, Е. В. Алаудинова, И. С. Почекутов, С. Р. Лоскутов. – Красноярск: СибГТУ, 2014. – 135 с.

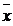 –среднее значение; φ(x) – относительная вероятность измерения х.
–среднее значение; φ(x) – относительная вероятность измерения х. Графики, полученные при многократных анализах в зависимости от наличия в них погрешностей
Графики, полученные при многократных анализах в зависимости от наличия в них погрешностей  , представлены на рисунке 1.3.
, представлены на рисунке 1.3.
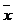

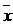 );
);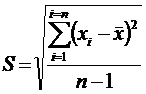 ; (1.1)
; (1.1)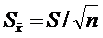 . (1.2)
. (1.2)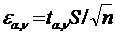 . (1.3)
. (1.3)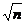 ; (1.4)
; (1.4) ; (1.5)
; (1.5)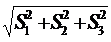 . (1.7)
. (1.7) . Если погрешность физико-химического определения известна (определена по предыдущей схеме), тогда: S 2 =
. Если погрешность физико-химического определения известна (определена по предыдущей схеме), тогда: S 2 =  ;
; , если известны S 2и S 3, то S 1=
, если известны S 2и S 3, то S 1=  .
. )с учётом точности прямого измерения:
)с учётом точности прямого измерения:  – εα,ν < х ист <
– εα,ν < х ист <  + εα,ν, то это свидетельствует об отсутствии систематической погрешности опыта.
+ εα,ν, то это свидетельствует об отсутствии систематической погрешности опыта. :
: или V = (S /
или V = (S /  ) 100 %. (1.8)
) 100 %. (1.8) ) 100 %. (1.9)
) 100 %. (1.9)


