Основные этапы получения моноклональных антител методом гибридомной технологии.
Долгое время единственным источником монАТ были опухолевые линии антитело- продуцирующих клеток миеломы и плазмацитомы, выделенные из больных людей и животных. Такие клетки могли быть адаптированы к росту в культуральных средах и секретировать моноклональные антитела, но было очень трудно и зачастую даже невозможно определить антиген, к которому эти антитела были направлены. Понятно, что использование таких монАТ было очень ограничено. Ситуация кардинально изменилась в 1975 году, когда ученые Kohler иMilshtein предложили метод получения моноклональных антител предопределенной специфичности, за что позднее были удостоены Нобелевской премии.
Смысл гибридомной технологии заключается в создании гибридной клетки (получившей название «гибридома»), получаемой путем слияния антитело- продуцирующего В-лимфоцита и опухолевой клетки миеломного или плазмацитомного ряда. (Рис.4). Такая гибридома обладает свойством секретировать антитела, взятой у В-лимфоцита, и способностью к бесконечному делению, взятой у опухолевой клетки.
Источником В-лимфоцитов для получения гибридомы служат лимфоидные органы животного, гипериммунизированного тем антигеном, против которого хотят получить монАТ. Гипериммунизация сильно повышает процентное содержание В-лимфоцитов, продуцирующих антитела желаемой специфичности, в общей популяции клеток лимфоидного органа. Лимфоциты, выделенные из тканей селезенки,лимфоузлов, периферической крови, не способны к самостоятельному делению и живут в культуре всего 10-14 дней. Миеломные клетки, напротив, могут жить и делиться в культуре сколь угодно долго, но не продуцируют антитела нужной специфичности (чаще используют линии миелом или плазмацитом, вообще не продуцирующие никаких антител).
В результате процедуры гибридизации (слияния) образуется гетерогенная популяция клеток, состоящая, во-первых, из неслившихсяклеток лимфоидного органа; во-вторых, из неслившихся клеток миеломы; в-третьих, из гибридов лимфоцит+лимфоцит и миелома+миелома; в четвертых, из гибридов лимфоцит+миелома, из которых лишь часть (часто весьма небольшая) стабильно продуцирует антитела нужной специфичности. Понятно, что необходимо отделить интересующие клетки от всех остальных. От неслившихся лимфоцитов и гибридовлимфоцит+лимфоцит избавляться не нужно: через несколько дней они умрут сами; от неслившихся опухолевых клеток и гибридов миелома+миелома избавляются с помощью селективных сред (подробности ниже); среди оставшихся клеток (гибридов лимфоцит+миелома) отбирают нужные путем клонирования, когда из одной клетки выращивают популяцию клеток (клеточный клон) и отбирают среди таких клонов лишь те, которые стабильно продуцируют антитела требуемой специфичности.
Секрецию антител определяют различными методами скрининга супернатантов гибридом, другими словами, проводят анализ тойкультуральной среды, в которой рос конкретный клон. При наличии в супернатанте желаемых антител проводят еще одно или несколькоклонирований, затем клетки нарабатывают для получения большего количества антител либо в культуре, либо в перитонеальной полости мышей (крыс). Далее антитела выделяют из культуральной или асцитной жидкости и проводят более детальные исследования на предмет их пригодности для использования в тех целях, для которых монАТ были получены. Клетки–продуценты можно заморозить и хранить в жидком азоте долгое время.

Рассмотрим теперь подробнее каждый из этапов получения монАТ:
Иммунизация.
Иммунизация- самый «творческий» этап в процессе получения моноклональных антител, именно эффективностью иммунизации определяется в наибольшей степени конечный успех всего предприятия. Тут невозможно дать какой-то единый рецепт, поскольку выбор схемы иммунизации и использование различных приемов, повышающих эффективность иммунизации, целиком зависят от свойств конкретного антигена.
3.1.1.Выбор объекта иммунизации.
В первую очередь необходимо выбрать объект иммунизации. На сегодняшний день известны три вида гибридомных систем: мышиная, крысиная и человеческая. Самой распространенной сегодня является мышиная гибридома, а самая редкая- человеческая, чему имеется ряд причин:
а) Мыши- наиболее хорошо изученный и доступный объект для работы в лаборатории, то же относится и к линиям мышиных миелом, используемых для слияния.
б) Все линии крысиных миелом, адаптированные для гибридомных работ, запатентованы, поэтому коммерческое использование крысиных гибридом регламентируется соответствующими патентами. Все мышиные линии миелом свободны от патентных ограничений.
в) Гипериммунизацию грызунов провести проще, чем иммунизацию человека. В большинстве случаев гипериммунизация человека вообще невозможна по этическим соображениям.
г) Источником иммунных В-лимфоцитов грызунов могут служить ткани любых лимфоидных органов, тогда как у человека возможно лишь взять периферическую кровь, где общее содержание В-лимфоцитов не превышает 20% от всех клеток. В редких случаях можно использовать удаленные миндалины пациентов, где содержание В-лимфоцитов может достигать 60%, но они, как правило, инфицированы и секретируют антитела именно против этого инфекционного агента.
д) При получении человеческой гибридомы существует проблема гистосовместимости клеток миеломы и В-лимфоцитов: у грызунов для слияния берутся В-лимфоциты и клетки миеломы, полученные от одной линии животных, и поэтому имеющих сходный репертуар антигенов гистосовместимости на клеточных поверхностях. Для человека это условие недостижимо, что в конечном итоге выражается очень низкой эффективностью слияния и крайне нестабильной антителопродукцией человеческих гибридом.
е) Мышиные и крысиные антитела достаточно просто нарабатывать в асцитных жидкостях; для человеческих гибридом возможна наработка лишь в культуре, либо с применением генноинженерных методов.
Для иммунизации мышей чаще всего используют линию BALB/c, все линии мышиных миелом происходят от этой линии. В случае низкоиммуногенных антигенов можно попытаться иммунизировать мышей другой линии, к некоторым антигенам они дают более сильный иммунный ответ по сравнению с BALB/c. Наработку таких гибридом в асцитных жидкостях производят на потомках первого поколения, полученных от скрещивания BALB/c и линии, использованной для иммунизации.
Для иммунизации крыс литература настойчиво рекомендует линию LOU/C, но вполне удовлетворительные результаты получаются с более доступными в нашей стране крысами линии WISTAR.
4.1.Схемы иммунизации мышей.
4.1.1.Короткая схема иммунизации.
Наиболее любима нашей лабораторией короткая схема иммунизации, когда антиген вводят дважды с двухнедельным интервалом в подушечки задних лап. Количество вводимого антигена берут в пределах от 5 до 200мкг на мышь в зависимости от его доступности и иммуногенности, для токсичных антигенов доза может быть понижена до 0,1мкг. Для первого введения антигена (раунда иммунизации) раствор антигена объемом 50-200 мкл смешивают с полным адъювантом Фрейнда (ПАФ), представляющего собой минеральное масло совзвесью убитых микобактерий. При активном перемешивании раствора антигена с ПАФ получается мелкодисперсная эмульсия, призванная замедлить и пролонгировать поступление антигена в ткани. Считается, что убитые микобактерии усиливают иммунный ответ, что, однако, у многих исследователей вызывает сомнение. Второй раунд иммунизации проводят так же, как и первый, но с использованием неполного адъюванта Фрейнда (НАФ), в котором отсутствуют микобактерии.
В случае проблемных антигенов полезно иммунизировать группу животных разными дозами антигена и с использованием разных схем иммунизации. На третий или четвертый день после второго раунда иммунизации нужно взять пробы крови и проанализировать их на содержание антител против требуемого антигена. Для дальнейшей работы выбирают животное с максимальным титром, исключение составляют антигены- белковые токсины, где иногда высокий титр специфических антител сочетается с большим процентом убитых токсином В-лимфоцитов. В таких случаях нужно брать животное, имеющее не самый высокий титр и/или обращать внимание на жизнеспособность клеток, берущихся для слияния.
На четвертый день после второго раунда иммунизации животное забивают, и клетки подколенных лимфоузлов сливают с клетками миеломы.
4.1.2. Длинные схемы иммунизации.
В случае неэффективности короткой схемы иммунизации пробуют различные виды длинных схем. При этом обычно животных иммунизируют с интервалом 2-4 недели либо внутрибрюшинно, либо подкожно (реже внутривенно или орально), используя для первого раунда иммунизации ПАФ, а для последующих- НАФ.
На 10-14 день после каждого раунда иммунизации (начиная со второго) кровь иммунизируемых животных проверяют на содержание специфических антител. Если титр антител достиг желаемого уровня, проводят последний раунд иммунизации (называемый бустированием), вводя раствор антигена внутривенно без адъювантов, в количестве 1/10 от предыдущих доз. В результате бустирования избирательно стимулируются клоны, продуцирующие антитела высокой аффинности к антигену.
4.2. Некоторые приемы, позволяющие усилить иммунный ответ.
4.2.1. Конъюгация (химическая сшивка) низкомолекулярного антигена (гаптена) с белком- носителем.
Существует целый ряд низкомолекулярных соединений, не способных самостоятельно вызвать иммунный ответ по причине малого размера молекулы. В таких случаях гаптен конъюгируют с белком- носителем (часто в качестве белка- носителя берут бычий сывороточный альбумин, яичный альбумин или гемоцианин улитки) и такой конъюгат используют для иммунизации. При этом возникает целый ряд проблем:
а) Основной иммунный ответ будет направлен на белок- носитель, а не на молекулу гаптена, и это нужно будет учитывать при тестировании сывороток иммунизируемых животных и супернатантов гибридом. Тестирование должно отражать содержание антител именно к гаптену, а не к конъюгату в целом.
б) Пространственное строение гаптена (конформация), как правило, существенно изменяется в процессе конъюгирования с носителем, иногда настолько, что все антитела против участков гаптена, находящегося в составе конъюгата, не способны узнавать свободную молекулу гаптена. В таких случаях пробуют разные варианты конъюгирования, которые затрагивают при сшивке разные функциональные группы молекулы гаптена, либо используют разные «линкеры»- органические соединения, связывающие функциональные группы гаптена и белка- носителя и увеличивающие экспонированность гаптена на поверхности носителя.
В целом метод конъюгирования хорошо зарекомендовал себя при получении антител против низкомолекулярных соединений.
4.2.2. Иммунизация иммунными комплексами (антиген- антитело).
Метод применяют, когда антигеном является консервативный низкоиммуногенный белок, либо, когда хотят получить антитела против минорных антигенных детерминант, на которые при иммунном ответе направлен очень низкий процент всех специфических антител. В первом случае антительным компонентом иммунного комплекса могут служить монАТ с неудовлетворительной аффинностью, полученные ранее после обычной иммунизации. Во втором случае берут монАТ против сильных антигенных детерминант, получение которых не представляет большой сложности.
Примером успешного использования такого подхода может служить получение антител против человеческого эритропоэтина, α и γ интерферонов, иммуноглобулинов близкородственных видов (крысиные монАТ против IgG мыши).
4.2.3. Конъюгация с адъювантным белком (hsp70).
Встречаются антигены, которые в силу своей сверх-консервативности не способны вызвать сколько-нибудь заметный иммунный ответ, несмотря на свою белковую природу и достаточный молекулярный вес (например, гемоглобин, некоторые ферменты). Выходом здесь может стать конъюгирование их с белком теплового шока (heat shock protein 70kDa, hsp70). Имеются данные, что hsp70 облегчает презентацию пептидных фрагментов, экспонируя их определенным образом, на практике же конъюгирование белков и пептидов с hsp70 приводит, как правило, к резкому усилению выработки антител против этих белков и пептидов.
Однако, случается полное подавление иммунного ответа в результате конъюгирования с hsp70, которое мы неоднократно наблюдали при иммунизации конъюгатом hsp70- интерферон γ.
4.3. Предварительная обработка антигенов перед иммунизацией.
а) Токсичные антигены часто подвергают денатурации нагреванием или добавлением денатурирующих агентов (мочевины, гуанидилхлорида и др.). Токсичность при этом снижается (не всегда), но утрачиваются многие антигенные детерминанты, присущие неденатурированному (нативному) антигену. В результате получаемые монАТ узнают лучше денатурированный антиген.
б) Иногда молекулы антигена сшивают друг с другом (полимеризуют) с целью увеличения молекулярного веса и/или уменьшения токсичности.
в) Вирусы и бактерии перед иммунизацией, как правило, инактивируют нагреванием, либо обработкой фенолом, формальдегидом, глутаральдегидом и др. для уменьшения их токсичности и эпидемиологической опасности. Грамотрицательные бактерии, кроме того, иногда обрабатывают лизоцимом, чтобы убрать ЛПС с их поверхности и обеспечить иммунный ответ против бактериальных белков.
5. Гибридизация В-лимфоцита с клеткой миеломы.
Отцы гибридомной технологии Келер и Мильштейн добивались слияния клеток при помощи вируса Сендай. Сейчас для этой цели все используют полиэтиленгликоль (ПЭГ), как более удобное, эффективное и безопасное средство. Формула ПЭГ:
HO(CH2CH2O)n CH2CH2OH, молекулярный вес ПЭГ, пригодного для слияния, от 20 до 20000, но чаще используют ПЭГ массой 600-6 000.
Полиэтиленгликоль токсичен для клеток, и его токсичность возрастает с уменьшением молекулярного веса. Слияние клеток происходит во время инкубации их в 35-50% ПЭГ, время инкубации зависит от концентрации ПЭГ и от его молекулярного веса (для 50% ПЭГ мол. веса 1 500 это приблизительно 1 минута). Недостаточное время инкубации приведут к очень низкому проценту слившихся клеток, а избыточное- к большому проценту погибших клеток вследствие токсичности ПЭГ. Хорошо работает такой компромиссный вариант, когда клетки сначала инкубируются при мягком перемешивании в 50% ПЭГ в течение 1 мин, затем процент ПЭГ снижается до 35% медленным добавлением бессывороточной среды, и клетки инкубируются еще 5-7 минут. Затем медленно, но с нарастающим темпом и при аккуратном перемешивании суспензия клеток далее разбавляется средой, потом центрифугируется и высевается на культуральные планшеты.
Точный механизм гибридизации клеток еще недостаточно изучен. Вначале, по-видимому, происходит агглютинация (склеивание) клеток, затем слияние клеточных мембран и, наконец, слияние ядер и перестройки хромосомного материала. Имеются данные, что сливаются, в основном, клетки, находящиеся в стадии интенсивного деления. По этой причине клетки миеломы за 12-24 часа до гибридизации переводят в условия, способствующие максимальной скорости роста клеток (повышение содержания фетальной сыворотки, витаминов и ростовых факторов в культуральной среде). Иммунизация в свою очередь стимулирует рост клонов В-лимфоцитов- продуцентов специфических к антигену антител.
Культивирование клеток.
Обычные условия культивирования миеломных и гибридомных клеток- 37°С и 5% СО2. Основа культуральной среды- это разные варианты предлагаемых на рынке сред DMEM или RPMI 1640, представляющих собой раствор солей, аминокислот, витаминов, углеводов и питательных добавок в разных концентрациях и цветового индикатора кислотности (как правило, феноловый красный). Кроме этого к среде добавляют эмбриональную телячью сыворотку или ее синтетические или полусинтетические заменители до концентрации 3-20% как источник белка и ростовых факторов. Качество сыворотки в наибольшей степени влияет на скорость роста клеток, особенно гибридомных, как более капризных по сравнению с миеломными. Помимо сыворотки в среду добавляют пируват натрия, антибиотики, глутамин (если он не содержался в исходной среде), реже- оксалоацетат, бета-меркаптоэтанол, инсулин и др.
Для культивирования клеток при низкой клеточной плотности (особенно при клонировании, когда из одной- единственной клетки в лунке необходимо вырастить целый клон) используют так называемый фидерный слой клеток (или просто фидер), облегчающий эту задачу. Клетки фидера не должны самостоятельно делиться, они призваны обеспечивать гибридомные клетки необходимыми для роста цитокинами и создавать клеточные контакты. В качестве фидера можно использовать клетки тимуса, селезенки, лимфоузлов, перитонеальной полости животных того вида, который использовался для получения иммунных В-лимфоцитов. Фидер от животных другого вида тоже может быть использован, но с меньшей эффективностью.
Культивирование клеток необходимо проводить в условиях, максимально приближенных к стерильным. Попавшие в культуру клеток бактерии и грибы, опережая гибридомы в скорости роста, очень быстро исчерпают питательные вещества ростовой среды и насытят ее своими токсинами. Это приведет к неизбежной гибели гибридомных клеток. Во избежание инфицирования пользуются стерильными ростовыми средами и стерильной культуральной посудой, применяют антибиотики, а все манипуляции с клетками проводят в условиях минимальной осемененности микробами (в ламинарном боксе с принудительной подачей стерильного воздуха).
Особую проблему представляет заражение клеток внутриклеточными паразитами- вирусами и микоплазмой. Детектировать их достаточно сложно, они, как правило, не убивают всю культуру гибридомных клеток и с легкостью переносятся от одной культуры к другой. Вирусы и микоплазма фильтруются сквозь бактериальные фильтры, поэтому фильтрование ростовых сред и воздуха в ламинарном боксе становятся неэффективными при борьбе с ними. Заражение клеток вирусами или микоплазмой приводит к резкому замедлению роста клеток, особенно в малой их плотности, а также к усиленной потере гибридомами их способности секретировать антитела. Против микоплазмы существуют специальные антибиотики, а против вирусов- интерфероны, но они помогают лишь снизить степень инфицированности клеток, не избавляя их от инфекции полностью. Более действенным является сочетание антибиотиков с неоднократным проведением зараженной культуры через организм животного, где клетки могут расти в виде асцитной жидкости и использовать иммунную систему животного против инфекции.
Клонирование гибридом.
Сразу после обнаружения в лунке с растущим клоном (или несколькими клонами) желаемых антител, нужно возможно скорее провести клонирование. Причины, по которым нужно торопиться с клонированием, такие же, что и для раннего тестирования первичных клонов, и были перечислены выше.
9.1. Метод клонирования в мягком агаре.
Отцы гибридомной технологии Келер и Мильштейн в своей пионерской работе использовали метод клонирования в мягком агаре. Сегодня этот метод имеет скорее историческое, нежели практическое значение, но из уважения к патриархам гибридомной технологии кратко рассмотрим и его. Гибридомы после процедуры слияния высевали в чашке Петри на стерильном 1%-ом агаре, приготовленном на селективной ростовой среде с аминоптерином. Белые бляшки растущих клонов тестировали на наличие специфических антител, используя метод фиксации комплемента. Те бляшки, вокруг которых наблюдали лизис эритроцитов барана, вырезали скальпелем, клетки суспендировали в ростовой среде и затем вновь высевали на агар. Процедуру повторяли до тех пор, пока не отбирали клоны, стабильно продуцирующие нужные антитела. Такие антитела являются моноклональными, поскольку секретируются клоном, выращенным из одной клетки.
9.2. Клонирование методом предельных разведений.
Самым распространенным сегодня методом клонирования является метод предельных разведений. Смысл его состоит в том, чтобы суспензию клеток развести в ростовой среде до такой концентрации, чтобы при посеве клеток на планшет в каждой лунке оказалась бы одна гибридомная клетка. На практике такое недостижимо, даже при самом тщательном расчете в какие-то лунки попадет две или даже большее число клеток, в какие-то не попадет вовсе. Кроме того, не все клетки могут выжить в тяжелых для них условиях одиночества и дать начало жизнеспособному клону. Поэтому делают несколько разных разведений клеток (как правило, три), в первом из них концентрацию клеток берут приблизительно равной 10 клеток на лунку, во втором- одна клетка на лунку, и в третьем- 0,1 на лунку. Приведенные цифры в разных пособиях могут варьировать. Клетки высевают, используя фидерный слой клеток, поскольку у одинокой гибридомной клетки практически нет шансов выжить в лунке.
Через несколько дней просматривают под микроскопом все лунки и фиксируют количество растущих в них клонов. Лунки с одним растущим клоном осматривают особенно тщательно на предмет отсутствия в них вторых мелких и малозаметных клонов. Затем, когда клоны достигнут достаточного для тестирования размера, проводят скрининг их супернатантов, используя тот же метод, что и для тестирования первичных клонов. Среди клонов, давших при тестировании положительный результат, отбирают самые продуктивные и здоровые на вид и повторяют процедуру клонирования. Если после второго клонирования все протестированные клоны дали положительный результат, самые лучшие из них отбирают для дальнейшей работы (наработки, заморозки и т.д.). В случае обнаружения несекретирующих клонов, что говорит о неустойчивой секреции антител, необходимо повторить клонирование, либо отказаться от дальнейшего использования этого клона.
9.3. Клонирование с помощью приборов.
В последнее время все большую популярность приобретают микроманипуляторы- приборы, позволяющие под визуальным контролем стерильно перенести одну выбранную клетку из одного культурального планшета в другой. Этот метод особенно удобен, если в лунке с положительно протестированным супернатантом имеется несколько клонов. Прибор позволяет взять из всех, даже самых маленьких клонов по несколько клеток и рассадить их по одной в лунки. Налицо экономия культуральной посуды и ростовых сред.
Другим прибором, использующимся для клонирования, является упомянутый выше проточный цитофлуориметр. Он может предложенную ему суспензию клеток рассадить по одной клетке в лунки культурального планшета.
Хранение клеток.
Клетки годами можно хранить в жидком азоте без существенной потери их жизнеспособности. Заморозку клеток производят, когда они находятся в логарифмической фазе роста. Суспензию клеток, предназначенных для заморозки, помещают в раствор, содержащий 10-90% сыворотки, 5-10% ДМСО и в остальном- ростовую среду. Присутствие сыворотки смягчает процессы замораживания- оттаивания клеток, ДМСО препятствует при заморозке образованию крупных кристаллов воды, губительных для клеточной стенки.
Понижение температуры при заморозке производят постепенно, существуют даже специальные приборы, позволяющие снижать температуру с заданной скоростью. В основном же бывает достаточно предварительно поместить ампулу с клетками в морозильник на -70ºС, а затем перенести в специальный сосуд с жидким азотом (сосуд Дьюара). Неудобство хранения клеток жидком азоте состоит в необходимости регулярно доливать азот в эти сосуды. Для менее продолжительного хранения клеток можно использовать морозильники с температурой от -70ºС и ниже.
Наиболее ценные гибридомы можно хранить в виде векторов (плазмид или нитчатых фагов), куда вставлены гены, кодирующие иммуноглобулины этих гибридом. Этот метод хранения более надежен, но требует предварительной работы по изготовлению таких векторов.
Заключение.
Гибридомная технология за 30 лет своего существования обросла многими дополнительными приемами, позволяющими получать моноклональные антитела к «сложным» антигенам. Некоторые из этих приемов запатентованы, некоторые используются лишь в тех лабораториях, которые их разработали, и недоступны всем желающим. Данное пособие отражает лишь небольшую часть всего накопленного опыта по получению гибридом, однако позволяет в общем понять смысл и значение гибридомной технологии. Для поиска путей, позволяющих получить монАТ к конкретному антигену, нужно изучать соответствующие публикации и патенты, либо самостоятельно, методом проб и ошибок, находить и отрабатывать нужные способы.
Введение.
Большая часть современных исследований по получению монАТ направлена на разработку удобных и эффективных методов получения человеческих моноклональных антител или их фрагментов. В предыдущей главе подробно описывались причины, по которым предпочтительнее использовать в терапии человеческие антитела, нежели мышиные или крысиные. При получении человеческих антител первые сложности возникают уже на этапе иммунизации.
Заключение.
Почти все новации в получении монАТ имели своей целью создание человеческих терапевтических антител. Впервые моноклональные антитела стали использоваться в терапии в 1986 году, но из-за своего мышиного происхождения их применение было очень ограничено. Спустя почти два десятка лет использование монАТ в терапии остается в зачаточном состоянии, несмотря на очевидные успехи в этом направлении. Большим сдерживающим фактором здесь является высокая стоимость производства терапевтических количеств моноклональных антител. Последние новости о работах по созданию трансгенных промышленных животных (коз, овец, коров), продуцирующих человеческие антитела в своем молоке, вселяют надежду на более широкое использование монАТ для лечения инфекционных, опухолевых и аутоиммунных заболеваний.
Традиционные методы получения моноклональных антител.
1. Общие свойства моноклональных антител.
Моноклональные антитела (монАТ), в отличие от поликлональных, являются продуктом секреции одной антитело- продуцирующей клетки, либо ее потомков (клона), образовавшихся в процессе деления этой клетки. Все монАТ, являющиеся продуктом одного клона, представлены идентичными молекулами, отсюда вытекают основные свойства моноклональных антител:
а) Все молекулы монАТ, являющиеся продуктом одного клона, имеют одинаковую специфичность, то есть, направлены против одинаковых мест связывания (антигенных детерминант) на каком-либо конкретном антигене, тогда как поликлональная сыворотка имеет в своем составе антитела к разным участкам связывания с антигенам и даже к разным антигенам.
б) Все молекулы монАТ, являющиеся продуктом одного клона, имеют одинаковое сродство к связываемому антигену (аффинность), то есть моноклональные антитела бывают высокоаффинными («прочно» связывающие антиген) и низкоаффинные (образующие легко диссоциирующий комплекс с антигеном). Поликлональная сыворотка всегда представлена антителами разной аффинности.
в) Все молекулы монАТ, являющиеся продуктом одного клона, имеют один изотип и субизотип иммуноглобулинов, чего нельзя сказать о поликлональной сыворотке.
2. Применение моноклональных антител.
Все вышеперечисленные свойства монАТ дают им преимущества перед поликлональными сыворотками в использовании их в диагностических целях, где монАТ нашли свое самое широкое применение.
2.1.Клиническая диагностика растворимых антигенов.
Почти все известные схемы анализа растворимых антигенов на основе монАТ можно отнести к двум типам: метод «двойного сэндвича» (рис.1.) и конкурентный анализ (рис.2.). В обоих случаях используют твердофазный носитель, на который прикрепляют (сорбируют) тем или иным способом монАТ. Далее, в случае «двойного сэндвича», этот носитель инкубируют с исследуемым раствором (чаще всего это биологические жидкости, которые хотят проверить на содержание в них какого-либо белка или низкомолекулярного соединения). Во время инкубации этот антиген (если он имеется в исследуемом растворе) связывается с монАТ, все несвязавшиеся компоненты образца удаляют, промывая твердый носитель буферными растворами или водой. Затем инкубируют со «вторыми» моноклональными антителами, которые, во-первых, должны быть направлены к другой части молекулы антигена, не экранированной первыми сорбированными монАТ, а, во-вторых, должны иметь на себе какую-либо метку, позволяющую регистрировать наличие или отсутствие присоединения «вторых» монАТ к твердому носителю и делать выводы о наличии и количественном содержании искомого антигена в растворе.
Недостатком этого метода является необходимость иметь два монАТ, направленных к разным участкам молекулы антигена и не мешающих друг другу связываться с антигеном. Существует ряд антигенов, как правило, низкомолекулярных, для которых невозможно получить такую пару монАТ по той причине, что антиген имеет только одну антигенную детерминанту, либо антигенные детерминанты расположены на недостаточном расстоянии друг от друга для того, чтобы две достаточно крупные молекулы антител могли независимо их связывать.
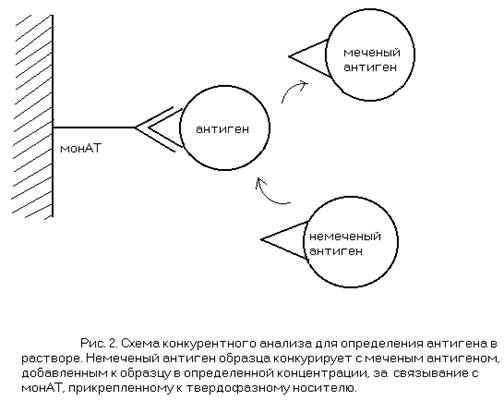
В таких случаях используют в среднем менее чувствительный конкурентный анализ. Для этого на твердофазный носитель прикрепляютмонАТ, затем инкубируют его с исследуемым образцом, куда предварительно добавили меченый антиген, который хотят обнаружить в образце. При наличии в образце искомого антигена (естественно, немеченого) последний препятствует связыванию меченого антигена ссорбированными монАТ (конкурирует с ним за связывание с монАТ). В результате самый сильный сигнал наблюдают при отсутствии в исследуемом растворе искомого антигена (отрицательный контроль), а о содержании антигена можно судить по уровню снижения сигнала по сравнению с отрицательным контролем.

2.2.Диагностика вирусов, бактерий и паразитов.
Для диагностики вирусов, бактерий и паразитов чаще применяют вышеописанный метод «двойного сэндвича». Все эти антигены относятся к крупным надмолекулярным образованиям, поэтому стерических проблем со связыванием антител не бывает, даже если и «первые», сорбированные, и «вторые» меченые монАТ направлены к одной и той же антигенной дереминанте, так как каждая антигенная детерминанта многократно повторена на целой клетке или вирусной частице.
Существуют некоторые особенности диагностики вирусов, бактерий и паразитов:
а) Многие из них могут представлять опасность для окружающей среды и людей, проводящих анализ, поэтому исследуемые образцы предварительно подвергают обработке, уменьшающую их возможную инфекционность.
б) Некоторые микроорганизмы представлены разными штаммами и линиями, среди которых могут быть и патогенные, и непатогенные (например, кишечная палочка Е.coli). Для диагностики конкретных патогенных штаммов необходимо использовать такие монАТ, которые избирательно связывают только искомые линии и штаммы. В этом случае применение моноклональных антител имеет особенную ценность, поскольку набор поверхностных антигенных детерминант у разных штаммов и линий микроорганизмов одного вида очень похож, и поликлональная сыворотка не в состоянии «отличать» патогенные штаммы одного вида от непатогенных.
в) Все грамотрицательные бактерии имеют на своей поверхности «шубу», состоящую из липополисахаридов (ЛПС) и предохраняющую бактериальную клетку от взаимодействия антител с бактериальными мембранными белками. Антитела против ЛПС являются не лучшими с точки зрения диагностики микроорганизмов, поскольку молекулы ЛПС очень похожи по структуре и даже часто идентичны не только у разных штаммов одного вида, но и у бактерий разных видов. В связи с этим для диагностики грамотрицательных бактерий необходимы монАТ со следующими свойствами: во-первых, они должны быть направлены против поверхностных бактериальных белков, а не ЛПС; во-вторых, избирательно связывать только искомые штаммы бактерий. Кроме того, иногда необходима предварительная обработка образца для того, чтобы удалить ЛПС и экспонировать белковые антигенные детерминанты.
2.3. Диагностика поверхностных антигенов эукариотических клеток, в частности CD антигенов.
В настоящее время только CD антигенов известно порядка сотни, кроме них на поверхности клеток имеются молекулы адгезии и разнообразные рецепторы. Качественный и количественный состав поверхностных антигенов может дать ценную информацию о функциях конкретной клетки, о ее принадлежности к опухолевым или вирус- инфицированным. Исследование поверхностных молекул клеток позволяет диагностировать ряд заболеваний человека или животного. И вновь моноклональные антитела оказываются незаменимыми в такой диагностике, так как направлены против конкретных поверхностных антигенов.
2.4. Персональные диагностические наборы.
Наиболее широко сейчас используются персональные наборы для определения беременности в домашних условиях. В их основе лежит цветная реакция взаимодействия хорионического гонадотропина мочи с соответствующими моноклональными антителами. Несомненно, большую перспективу могли бы иметь подобные наборы для ранней диагностики опухолевых и инфекционных заболеваний, для определения нежелательных примесей в воде, пищевых продуктах, лекарствах и парфюмерных товарах.
2.5. Использование моноклональных антител в препаративных целях.
С развитием методов генной инженерии особенно остро встал вопрос о необходимости наладить выделение генноинженерных продуктов из их источников (бактериальных и дрожжевых клеток и др.). Часто генноинженерные (или их еще называют рекомбинантные) белки используются в качестве компонентов фармакологических препаратов, производимых в промышленных масштабах, поэтому предъявляются особые требования к их чистоте и к стоимости их очистки. В этом случае выделение белков и пептидов с помощью моноклональных антител практически не имеет конкурентов, так как может производиться в один этап и с высокой степенью очистки.
Наиболее распространенным методом выделения белков с использованием моноклональных антител стала аффинная хроматография. Основной ее принцип заключается в следующем:
На полимерные гранулы (например, сефароза), называемые иначе сорбентом, химически пришивают молекулы моноклональных антител, и эти гранулы помещают в хроматографические колонки. Далее через эти колонки пропускают растворы (экстракты), из которых хотят выделить нужное вещество, при этом используют такие условия (величина ионной силы раствора, рН, температура и др.), когда с монАТ связываются только требуемые компоненты раствора, а все остальные вымываются. После тщательной промывки колонки от несвязавшихся веществ производят элюцию (смыв) тех веществ, которые специфически связались с монАТ на сорбенте, используя для этого предварительно подобранные условия элюции (изменяют рН раствора, ионную силу и др.). В результате относительно несложной процедуры получают практически чистый препарат белка или пептида. Примерно такой же подход применяют и в исследовательских целях, когда хотят обогатить образец конкретным веществом для последующего его использования в других методиках.
2.6. Применение моноклональных антител в терапии.
По сравнению с диагностикой и препаративным выделением, моноклональные антитела пока не очень широко используются для лечения заболеваний, и этому есть целый ряд причин:
а) бактериальные инфекции удобней лечить с помощью таких более доступных средств, как антибиотиков или солевых растворов (как, например, при лечении холеры);
б) вирусы, являясь внутриклеточными паразитами, плохо доступны для моноклональных









