

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Фазовое равновесие.
Фазовыми называются термодинамические равновесия в гетерогенных системах, в которых не происходит химического взаимодействия компонентов, а имеют место лишь процессы перехода компонента из одной фазы в другую.
Термодинамические системы по фазовому составу подразделяются на:
1) однородные или гомогенные, внутри которых нет поверхности раздела
2) разнородные или гетерогенные, где различные по составу части системы отдельны друг от друга поверхностью раздела
Фаза -однородная часть гетерогенной системы, одинаковая по физико-химическому составу и отделенная от других частей системы поверхностью раздела.
Составляющее вещество -любое вещество, которое может быть выделено из системы и существовать вне нее.
Компонент - наименьшее число составляющих веществ, достаточное для образования всех фаз данной системы. В отсутствии химического взаимодействия число компонентов = числу составляющих веществ.
При химическом взаимодействии число компонентов рассчитывается как число составляющих веществ минус число уравнений связывающих концентрации этих веществ.
К=составляющие вещества - уравнения

К=3 – 1 = 2


К=3 – 2 = 1


Число степеней свободы - это число независимых переменных (в основном Р и Т), которые можно менять в небольших пределах без нарушения числа фаз системы, находящихся в равновесии.
Условия равновесия фаз
Поскольку перенос компонента из одной фазы в другую может осуществляться только в открытых системах, то будет справедливо выражение:

Рассмотрим двухфазовую систему, где происходит перенос компонента из фазы 1 в фазу 2:
|
|

Перед химическим потенциалом 1 фазы ставим “ - ”, т.к. количество компонентов в ней убывает.


Этот вывод можно рассматривать на любое количество фаз.
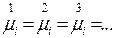
т.е. условием равновесия фаз является равенство химических потенциалов данного компонента во всех фазах системы.
Вывод: самопроизвольный процесс в открытых системах протекает из фазы с большим химическим потенциалом, в фазу с меньшим химическим потенциалом до тех пор, пока значения потенциалов не сравняются, т.е. наступит состояние равновесия.
Правила фаз Гиббса
Выводится из условия равновесия фаз.
Правило фаз Гиббса: Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов действуют только Р и T, равно числу компонентов плюс два минус число фаз
С=К+2-Ф
где С- число степеней свободы
К- число компонентов
Ф- общее число фаз, находящихся в равновесии
“2”- число внешних независимых переменных (Р и Т), которые могут
повлиять на систему.
Если Р=const или T=const, то число переменных заменяется на “1”, т.е. С=К+1-Ф
Однокомпонентные системы.
Для них т.к. К=1: С=3-Ф. По физическому смыслу число степеней свободы не может быть отрицательным, а число фаз может меняться от 1 до 3 и число степеней свободы от 2 до 0.
“2”- Р и Т можно менять
“0”- ничего трогать нельзя
Равновесие в однокомпонентной системе может быть реализовано 3 способами:
жидкое-твердое
жидкое-газообразное
твердое-газообразное
Взаимосвязь между химическим потенциалом и энергией Гиббса:
Известно выражение

Его интегрирование для однокомпонентной системы:

если 
Т.е. химический потенциал = энергии Гиббса одного моля чистого компонента
Осмос

 (Рауль) или
(Рауль) или 
Осмос – самопроизвольный переход молекул растворителя через полупроницаемую мембрану (перегородка проницаемая только для молекул растворителя) в раствор. При этом высота столба жидкости в трубке будет увеличиваться. Когда она достигает некоторой высоты, h осмос прекратится. Гидростатическое давление, которое нужно приложить к раствору, чтобы предотвратить осмос, называется осмотическое (П). Его можно вычислить по уравнению Вант-Гоффа
|
|
 |
П = CBRT
Осмос лежит в основе протекания многих биологических процессов: 5%-ный раствор сахара в крови дает П = 0,6 атм.
Примечание: в растворах электролитов, где число частиц гораздо больше исходных молекул (при диссоциации) во все уравнения в п. 1 – 4 вводится поправка «i» – изотонический коэффициент. Для предельно разбавленных растворов, где электролит достигает 100% диссоциации, поправка i равна числу ионов, на которые распался электролит.
Например: П = CBRT × i
NaCl ® Na+ + Cl– i =2
Fe2(SO4)3 ® 2Fe3+ + 3SO42– i =5

5. Давление летучего растворенного вещества над предельно разбавленным раствором. Закон Генри (установлен опытным путем)
При равновесии 


Потенцируем:
PB = k NB, где k – константа Генри (имеет размерность давления).
 ; NB = k ' PB; где
; NB = k ' PB; где 
Закон Генри: Мольная доля газа в растворе прямо пропорциональна давлению газа над раствором – применим только к идеальным растворам
Примечание: Закон Рауля является частным случаем закона Генри, когда
Pi 0 = const
Влияние температуры на растворимость: чем больше температура, тем меньше растворимость и наоборот. Для растворов электролитов растворимость газа увеличивается, если он образует с ионами химическое соединение – эффект всаливания. Если растворимость газа в растворе электролита уменьшается – эффект высаливания.
Неидеальные растворы
1. Система, где взаимодействие между молекулами в растворе меньше, чем в индивидуальном состоянии  наблюдаются положительные отклонения от закона Рауля. Образование такого раствора сопровождается поглощением тепла
наблюдаются положительные отклонения от закона Рауля. Образование такого раствора сопровождается поглощением тепла  и увеличением объема
и увеличением объема  .
.

2. Если силы взаимодействия между молекулами в растворе больше, чем у индивидуальных компонентов, отклонение от закона Рауля будет отрицательным. Образование раствора протекает с выделением тепла и уменьшением объема.  ,
,  ,
,  .
.

На диаграммах кружками обозначены области, в которых возможно применение законов Рауля и Генри:
1 и 2 – области применения закона Рауля для компонентов А и В.
|
|
3 – область применения закона Генри для компонента Б,
4 – область применения закона Генри для компонента А.
В растворах, где давление насыщенности паров компонентов (и Т кип) близки, но компоненты сильно отличаются по химической природе, отклонения от закона Рауля будет сильными. Поэтому на кривых общего давления возникают экстремальные точки – верхние при положительных отклонениях и нижние при отрицательных.

Эти точки, независимо от знака отклонения, называются азеотропными.
Фазовое равновесие.
Фазовыми называются термодинамические равновесия в гетерогенных системах, в которых не происходит химического взаимодействия компонентов, а имеют место лишь процессы перехода компонента из одной фазы в другую.
Термодинамические системы по фазовому составу подразделяются на:
1) однородные или гомогенные, внутри которых нет поверхности раздела
2) разнородные или гетерогенные, где различные по составу части системы отдельны друг от друга поверхностью раздела
Фаза -однородная часть гетерогенной системы, одинаковая по физико-химическому составу и отделенная от других частей системы поверхностью раздела.
Составляющее вещество -любое вещество, которое может быть выделено из системы и существовать вне нее.
Компонент - наименьшее число составляющих веществ, достаточное для образования всех фаз данной системы. В отсутствии химического взаимодействия число компонентов = числу составляющих веществ.
При химическом взаимодействии число компонентов рассчитывается как число составляющих веществ минус число уравнений связывающих концентрации этих веществ.
К=составляющие вещества - уравнения

К=3 – 1 = 2


К=3 – 2 = 1


Число степеней свободы - это число независимых переменных (в основном Р и Т), которые можно менять в небольших пределах без нарушения числа фаз системы, находящихся в равновесии.
Условия равновесия фаз
Поскольку перенос компонента из одной фазы в другую может осуществляться только в открытых системах, то будет справедливо выражение:

|
|
Рассмотрим двухфазовую систему, где происходит перенос компонента из фазы 1 в фазу 2:

Перед химическим потенциалом 1 фазы ставим “ - ”, т.к. количество компонентов в ней убывает.


Этот вывод можно рассматривать на любое количество фаз.
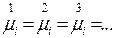
т.е. условием равновесия фаз является равенство химических потенциалов данного компонента во всех фазах системы.
Вывод: самопроизвольный процесс в открытых системах протекает из фазы с большим химическим потенциалом, в фазу с меньшим химическим потенциалом до тех пор, пока значения потенциалов не сравняются, т.е. наступит состояние равновесия.
Правила фаз Гиббса
Выводится из условия равновесия фаз.
Правило фаз Гиббса: Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов действуют только Р и T, равно числу компонентов плюс два минус число фаз
С=К+2-Ф
где С- число степеней свободы
К- число компонентов
Ф- общее число фаз, находящихся в равновесии
“2”- число внешних независимых переменных (Р и Т), которые могут
повлиять на систему.
Если Р=const или T=const, то число переменных заменяется на “1”, т.е. С=К+1-Ф
Однокомпонентные системы.
Для них т.к. К=1: С=3-Ф. По физическому смыслу число степеней свободы не может быть отрицательным, а число фаз может меняться от 1 до 3 и число степеней свободы от 2 до 0.
“2”- Р и Т можно менять
“0”- ничего трогать нельзя
Равновесие в однокомпонентной системе может быть реализовано 3 способами:
жидкое-твердое
жидкое-газообразное
твердое-газообразное
Взаимосвязь между химическим потенциалом и энергией Гиббса:
Известно выражение

Его интегрирование для однокомпонентной системы:

если 
Т.е. химический потенциал = энергии Гиббса одного моля чистого компонента
Фазовая диаграмма однокомпонентной системы.
Любая фазовая диаграмма или диаграмма состояния строится только по экспериментальным данным, при этом используются два принципа:
1) Принцип непрерывности: при непрерывном изменении параметров состояния (Р, Т и состав) свойства фаз на диаграмме меняются также непрерывно, пока не изменятся число и характер фаз.
2) Принцип соответствия: числу фаз, одновременно находящихся в равновесии, на диаграмме соответствует определённый геометрический образ. Линия – две фазы, точка – три фазы.
При построении диаграммы выбирается число осей координат, соответствующих выбранным параметрам состояния (для однокомпонентной системы на плоскости могут быть изображены Р и Т; для двухкомпонентной системы – Р или Т и состав; для трёхкомпонентной системы - только состав).
|
|
Пример: Диаграмма состояния воды.

АО – кривая плавления;
ВО – кривая кипения;
СО – кривая возгонки;
Для этих трёх случаев, исходя из правила Гиббса для однокомпонентной системы (К = 1)
C = 3 – Ф; Ф = 2; С = 1; т.е. можно менять в некоторых пределах либо Р, либо Т.
О – тройная точка, все 3 фазы находятся в равновесии.



 H2Oж H2Oт H2Oг
H2Oж H2Oт H2Oг
Ф = 3; С = 0, т.е., чтобы не нарушить одновременное сосуществование всех трех фаз, Р и Т должны быть зафиксированы (Р = 5,575 мм.рт.ст., t = 0,0076°С).
Для полей твёрдой СОА, жидкой АОВ и газообразной ВОС фаз, число степеней свободы С = 2.
|
|
|

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!