Гальванический элемент - устройство, в котором энергия химической реакции преобразуется в электрическую энергию.
Индикаторные электроды - электроды, потенциал которых зависит от активности ионов водорода в растворе. Обратимо реагирует на изменение состава анализируемого раствора, по наличию (отсутствию) аналитического сигнала и его интенсивности позволяет судить о том, есть ли интересующий компонент в растворе и сколько его. Индикаторные электроды: активный металлический электрод первого рода, окислительно-восстановительный электрод, мембранный (ионоселективный) электрод, стеклянный электрод.
Электрода сравнения – электрод с устойчивым потенциалом.Он должен иметь низкое электрическое сопротивление, не влиять на состав анализируемого раствора, вызывать появление значительного диффузионного потенциала, обладать простой конструкцией. К электродам сравнения относиться хлорсеребряный электроды, который представляет собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия.
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
ЭДС элемента Даниэля – Якоби рассчитывается с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
 ,
,
Концентрационный гальванический элемент состоит из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1> а2. Катодом в этом случае будет являться электрод с большей концентрацией.
ЭДС концентрационного гальванического элемента равна: 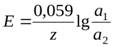 .
.
Методы потенциометрического анализа. Потенциометрические методы определения концентрации водородных ионов. РН-метр.
В основе потенциометрических измерений лежит зависимость равновесного потенциала электрода от активности (концентрации) определяемого иона, описываемая уравнением Нернста и находящаяся в прямой зависимости от логарифма концентрации определяемого иона. 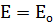 +
+  lna =
lna =  +
+ 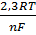 lga Е–разность потенциалов, Ео–стандартная разность потенциалов, R–универсальная газовая постоянная, n–заряд иона, F–число Фарадея, а–активная концентрация (активность) ионов, моль/л.
lga Е–разность потенциалов, Ео–стандартная разность потенциалов, R–универсальная газовая постоянная, n–заряд иона, F–число Фарадея, а–активная концентрация (активность) ионов, моль/л.
Потенциометрия бывает прямой и косвенной. В обоих случаях анализ проводят в потенциометрической ячейке, состоящей из двух электродов – электрода сравнения и индикаторного электрода, помещенных в исследуемый раствор. Во внешней электрической цепи электроды подключены к измерительному прибору – потенциометру, измеряющему разность потенциалов электродов ячейки или потенциал индикаторного электрода относительно потенциала электрода сравнения (разница потенциалов между ними – ЭДС гальванического элемента). Прямая потенциометрия основана на измерении потенциала индикаторного электрода, погруженного в исследуемый раствор, относительно электрода сравнения и расчете концентрации (активности) ионов согласно уравнению Нернста. В потенциометрическом методе анализа титрование проводят, измеряя потенциал после добавления каждой порции титранта. Заметив объем, при котором наблюдается резкое изменение потенциала (скачок титрования) проводят точное титрование.
Наибольшее распространение среди прямых потенциометрических методов получил метод определения рН. рН – метр измеряет разность потенциалов между этими электродами, опущенными в исследуемый раствор. Каждой разности потенциалов соответствует определенное значение рН.
Количественные методы в прямой потенциометрии.
1.Метод градуировочного графика;
2.Калибровка по двум стандартным растворам;
3.Метод добавок.
Билет №4



 ,
,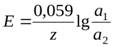 .
.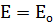 +
+  lna =
lna =  +
+ 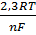 lga Е–разность потенциалов, Ео–стандартная разность потенциалов, R–универсальная газовая постоянная, n–заряд иона, F–число Фарадея, а–активная концентрация (активность) ионов, моль/л.
lga Е–разность потенциалов, Ео–стандартная разность потенциалов, R–универсальная газовая постоянная, n–заряд иона, F–число Фарадея, а–активная концентрация (активность) ионов, моль/л.


